Актуальность
Рак яичников (РЯ) cлужит основной причиной смерти от онкогинекологических заболеваний в мире [1]. Почти у 75% женщин с РЯ заболевание выявляется уже на поздней стадии заболевания (стадия III или IV) [2, 3].
Мутации в генах BRCA1 и BRCA2 служат важным фактором риска развития РЯ [4]. Для женщин с мутацией BRCA1/2 вероятность развития РЯ в течение жизни примерно на 40% выше, чем без мутации [6]. Мутации в генах BRCA1/2 могут быть либо наследственными, либо приобретенными (соматическими) во время туморогенеза. Данные литературы предполагают, что примерно 25% от общей популяции пациенток с РЯ имеют мутации BRCA1/2 на момент постановки диагноза, 18% из которых наследственные и 7% соматические [7, 8].
При мутации BRCA нарушается известный путь репарации ДНК, системы гомологичной рекомбинационной репарации (HRR), но опухолевые клетки при этом начинают использовать другую систему восстановления ДНК – через восстановление однонитевых разрывов ДНК при помощи поли- (АДФ-рибоза) полимеразы (PARP) [5]. Ингибирование PARP в опухолевых клетках с дефицитом гомологичной рекомбинации (HRD) приводит к гибели клеток из-за синтетической летальности [5]. HRD не ограничивается только мутациями BRCA, а также включает другие механизмы геномной нестабильности, такие как соматические мутации и эпигенетические модификации других генов, участвующих в пути HRR, таким образом подтверждая биологическую достоверность эффективности PARP [5].
Клинический случай
Пациентка Т. 1970 г.р. с декабря 2018 г. стала отмечать увеличение живота в объеме, слабость, запоры. Обратилась к врачу с данными жалобами в феврале 2019 г.
При обследовании статус ECOG (Eastern Cooperative Oncology Group) – 1.
Магнитно-резонансная томография: в малом тазу оба яичника солидно-кистозной структуры с неровными бугристыми контурами увеличены в размерах – общим размером справа 9,0×6,0, слева 5,4×8,4 см. Брюшина малого таза и дугласова пространства утолщена, деформирована с формированием объемных образований с бугристыми контурами размером от 0,5 до 1,9 см. В большом сальнике 2 опухолевых образования – 2,5×3,0 и 1,5×2,8 см. В забрюшинном пространстве в парааортальной зоне несколько увеличенных лимфоузлов размером от 1,8 до 4,4 см. Незначительный асцит в брюшной полости.
СА-125 – 3980 МЕ/мл, HE4 – 464,6 пкмоль/л, ROMA>50%.
Сопутствующие заболевания: поверхностный гастрит.
Семейный анамнез: не отягощен.
Цитология: аденокарцинома, вероятно, яичников (из асцитической жидкости).
Диагноз: рак яичников IIIC-стадии.
С февраля 2019 по апрель 2019 г. проведено 3 курса химиотерапии (ХТ): паклитаксел 175 мг/м2+карбоплатин AUC6+бевацизумаб 7,5 мг/кг каждый 21-й день с частичным эффектом.
В апреле 2019 г. проведена интервальная циторедукция в оптимальном объеме: экстирпация матки с придатками, частичная перитонэктомия, тазовая, поясничная лимфодиссекция (IV уровень). Удален большой сальник. остаточная опухоль в виде мелких диссеминатов по диафрагмальной поверхности печени.
Гистология: серозная аденокарцинома яичников high-grade с прорастанием брюшины прямой кишки, метастазы в большом сальнике и в 17 из 78 забрюшинных лимфоузлов, pT3CN1.
СА-125 после операции – 380 МЕ/мл.
Диагноз: рак яичников – T3CN1M0 IIIC-стадии.
С мая 2019 по июль 2019 г. проведено 4 курса ХТ: паклитаксел 175 мг/м2+карбоплатин AUC6+бевацизумаб 7,5 мг/кг каждый 21-й день.
Компьютерная томография (КТ) после лечения: признаков опухоли нет.
СА-125 после лечения – 34 ME/мл.
Далее бевацизумаб 7,5 мг/кг каждый 21-й день.
В Германии в сентябре 2019 г. пациентке сделан анализ на HRD (Myriad BRACA nalysis) и получен HRD 65 баллов.
С сентября 2019 г. к бевацизумабу добавлен олапариб 300 мг 2 раза в сутки.
По данным КТ от 2020 г. и сентября 2021 г., сохраняется полная ремиссия.
Из токсичности отмечалась анемия 2-й степени, проводилась симптоматическая терапия, не потребовавшая отмены препарата или редукции, повышение артериального давления до 150/100 мм рт.ст., что потребовало коррекции антигипертензивными препаратами без отмены или редукции доз и отмечена кровоточивость из носа 2-й степени, что привело к одному пропуску введения бевацизумаба.
Обсуждение
Первичное лечение РЯ III–IV стадий стандартно включает первичную циторедуктивную операцию либо при невозможности проведения операции на первом этапе пациентки получают три курса неоадъювантной ХТ с последующей операцией и проведение платиносодержащей ХТ (суммарно 6–8 курсов). Объем циторедуктивной операции является прогностическим фактором: увеличение остаточной опухоли коррелирует с более низкими показателями выживаемости [9, 10].
Бевацизумаб (ингибитор фактора роста эндотелия сосудов в сочетании с карбоплатином и паклитакселом) и дальнейшее его применение в поддерживающем режиме были одобрены во всем мире для лечения в первой линии терапии пациенток с III или IV стадией РЯ после первичного хирургического вмешательства. Утверждение основано на 6,2-месячном улучшении медианы выживаемости без прогрессирования – ВБП (отношение рисков [ОР]=0,62, 95% доверительный интервал [ДИ]: 0,52–0,75) при применении комбинации карбоплатина с паклитакселом и бевацизумабом с последующей поддерживающей терапией бевацизумабом по сравнению с одной ХТ в исследованиях GOG-218 и ICON7 [11, 12].
Несмотря на высокую эффективность стандартного первичного лечения РЯ, около 70% женщин рецидивируют в впервые 3 года [13].
Персонализированное поддерживающее лечение после первой линии терапии больных РЯ
До настоящего времени только поддерживающая терапия бевацизумабом при условии начала терапии совместно с ХТ и далее в поддерживающем режиме была рекомендована пациенткам с распространенным РЯ высокого риска прогрессирования.
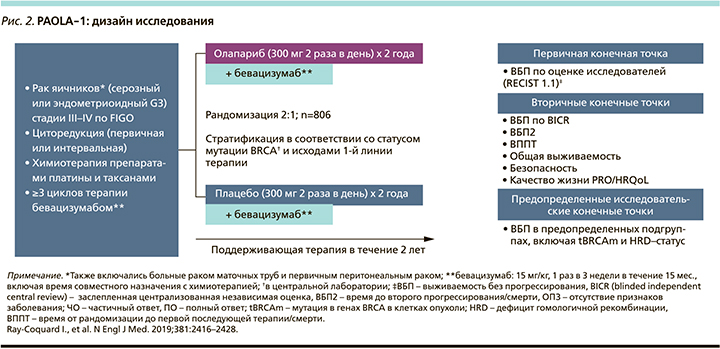
На сегодня известны результаты двух исследований роли поддерживающей терапии олапарибом (SOLO-1), олапарибом и бевацизумабом (PAOLA-1) для пациенток с распространенным РЯ high-grade серозной или эндометри-оидной аденокарциномы (рис. 1, 2).
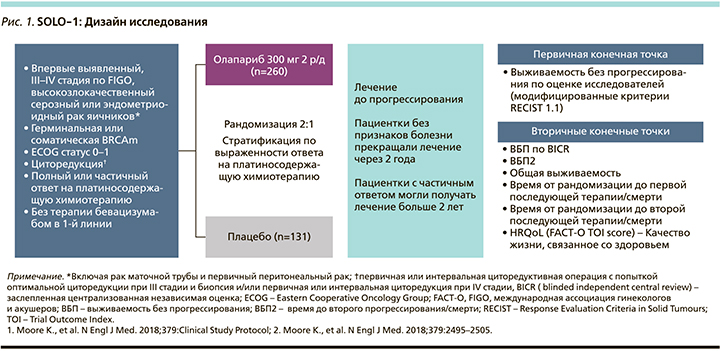
Каждое исследование III фазы – рандомизированное двойное слепое плацебо-контролируемое, первичной конечной точкой которого была демонстрация улучшения ВБП. Хотя эти исследования имели схожий дизайн: одинаковая популяция пациенток, схожее лечение, первичные и вторичные конечные точки эффективности, они также имели несколько различий [14]. В SOLO-1 сравнивали эффективность поддерживающей монотерапии олапарибом и плацебо пациенток с мутацией BRCA (BRCAm), больных распространенным РЯ, маточной трубы или первичным раком брюшины, которые ответили на лечение первой линии платиносодержащей ХТ. После завершения платиносодержащей ХТ (минимум 4 и максимум 9 циклов лечения, и пациентки не должны были получать бевацизумаб ни с ХТ, ни далее в поддерживающей терапии) пациентки были рандомизированы 2:1 в группу лечения олапарибом 300 мг перорально 2 раза в сутки (n=260) или плацебо (n=131) до 2 лет или до прогрессирования заболевания, или неприемлемой токсичности. Если у пациенток оставались признаки заболевания после 2 лет приема, по решению врача можно было продолжать лечение олапарибом более 2 лет.
Рандомизация была стратифицирована по ответу на первую линию ХТ (полный ответ [ПО] против частичного ответа [ЧО]). Пациентки, включенные в SOLО-1, были тестированы на носительство BRCA с помощью системы Myriad BRACAnalysis (Myriad). Первичной конечной точкой эффективности была ВБП, определенная как время от рандомизации в поддерживающее лечение до самой ранней даты объективного прогрессирования (согласно критериям RECIST) по оценке исследователя или смерти по любой причине (в отсутствие прогрессирования заболевания). Этот первичный анализ ВБП был подтвержден анализом ВБП, оцененным независимым центральным анализом сканированных изображений пациенток. Общая выживаемость (ОВ) была вторичной конечной точкой.
В PAOLA-1 сравнивалась эффективность олапариба и бевацизумаба (O+Б) по сравнению с плацебо и бевацизумабом (П+Б) в качестве поддерживающего лечения распространенного эпителиального РЯ, маточной трубы или первичного рака брюшины после ХТ на основе препаратов платины и бевацизумаба в первой линии лечения. Факторы стратификации при рандомизации были кроме ответа на лечение (ПО против ЧО) время проведения циторедуктивной операции (первичная против интервальной) и объем остаточной опухоли (полная против неполной циторедукции). В исследовании также был проведен анализ BRCA-статуса (определялись мутации в опухоли как герминальные, так и соматические tBRCAm), определяемый тестированием Myriad myChoice CDx.
У пациенток, как и в исследовании SOLO-1, должен быть либо ПО, либо ЧО на платиносодержащую ХТ первой линии с бевацизумабом или отсутствие признаков заболевания (NED) из-за полной циторедуктивной операции. Пациентки были рандомизированы (2:1) в группу приема олапариба 300 мг перорально 2 раза в суткуи в комбинации с бевацизумабом (n=537) 15 мг/кг каждые 3 недели или П+Б (n=269). Прием бевацизумаба продолжался в поддерживающем режиме, а олапариба начинался в интервале от 3 до 9 недель после завершения последнего введения ХТ. Лечение олапарибом продолжалось до 2 лет или до прогрессирования основного заболевания или непереносимой токсичности. Лечение также возможно было продлить более чем на 2 года, если врач решил, что пациентка получит дополнительную пользу от лечения. Бевацизумаб вводился вместе с ХТ и далее до 15 месяцев в качестве поддерживающей терапии.
Первичная конечная точка оценивалась только исследователем, согласно RECIST версии 1.1, и OВ была вторичной конечной точкой эффективности.
В данном исследовании проведено тестирование с использованием Myriad myChoice HRD Plus на определение статуса HRD. HRD-положительный тест включал мутации в генах BRCA1 и BRCA2 и/или положительную геномную нестабильность, рассчитанную как алгоритмическое измерение потери гетерозиготности, теломерного аллельного дисбаланса и крупных перестроек. HRD≥42 считался положительным, <42 – отрицательным, т.е. путь гомологичной рекомбинации не являлся дефектным.
Результаты лечения в исследованиях SOLO-1 и PAOLA-1
В SOLО-1 была рандомизирована 391 женщина из 15 стран. Большинство пациенток прошли 6 циклов платиносодержащей ХТ до рандомизации, комбинация карбоплатина и паклитаксела была наиболее часто применяемой. Демографические и исходные характеристики пациенток были сбалансированы в обеих группах.
У большинства пациенток в обеих группах был статус ECOG 0 (n=305) и не было признаков заболевания перед рандомизацией (n=290). Из всех пациенток у 82% был ответ на платиносодержащую ХТ. У большинства пациенток была герминальная мутация BRCA (n=389), и только у двух пациенток была соматическая мутация BRCA.
В исследование PAOLA-1 были рандомизированы 806 женщин из 11 стран. Демографические и исходные характеристики заболевания были сбалансированы и сопоставимыми между группами. Все пациентки получали первую линию терапии на основе препаратов платины и бевацизумаба. Результаты лечения первой линии терапии показали, что 32% пациенток обеих групп имели NED с полной макроскопической резекцией при первичной циторедукции, 31% пациенток обеих групп имели NED/ПО с полной макроскопической резекцией при интервальной циторедукции, 15% пациенток обеих групп имели NED/ПО с неполной циторедукцией (при первичной или интервальной циторедукции) или отсутствие хирургического вмешательства, и 22% пациенток в обеих группах имели ЧО. По объему циторедукции 65% пациенток выполнена полная первичная или интервальная циторедукция и 35% больных операция была выполнена с макроскопическими остаточными опухолями. Из 806 пациенток 48% (n=387) имели HRD-положительный статус, в т.ч. 29% (n=235) имели tBRCAm, 34% (n=277) были отрицательными по HRD и 18% (n=142) имели неизвестный статус HRD.
Результаты SOLO-1 и PAOLA-1 показали, что пациентки с BRCAm, получавшие монотерапию олапарибом, и HRD-положительные пациентки (в состав входили BRCAm пациентки), получавшие O+Б соответственно, имели клинически значимое улучшение ВБП (табл. 1).

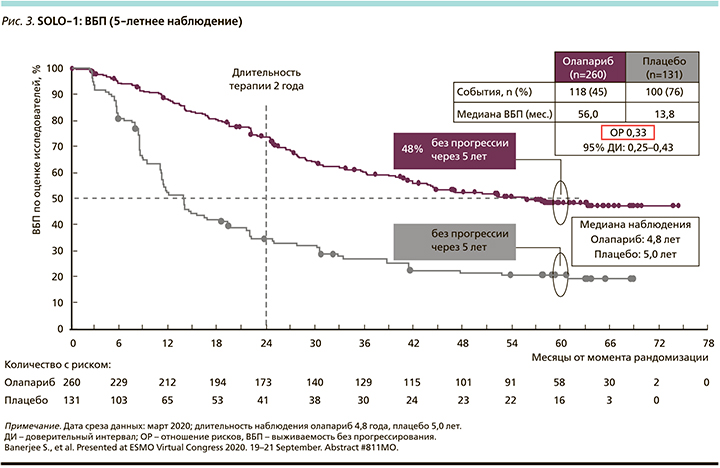
Для SOLО-1 ОР составило 0,30 (95% ДИ: 0,23–0,41; p<0,0001) с медианой выживаемости 56,0 месяцев у пациенток, рандомизированных в группу олапариба, и 13,8 месяца у пациенток, рандомизированных в группу плацебо (рис. 3). На время первичного анализа ВБП данные ОВ были незрелыми, примерно 21% пациенток умерли.
В исследование PAOLA-1 были включены 806 пациенток. Хотя в общей популяции продемонстрировано статистическое улучшение ВБП (ВБП в группе олапариба составила 22,1 месяца по сравнению с 16,6 в группе плацебо (ОР=0,59, 95% ДИ: 0,49–0,72; р<0,0001). Это улучшение в первую очередь наблюдалось в подгруппе пациенток с положительным тестом HRD (включая пациенток с tBRCAm). В подгруппе пациенток с положительным тестом HRD ОР для ВБП составило 0,33 (95% ДИ: 0,25–0,45) при медиане ВБП 37,2 месяца в группе O+Б по сравнению с 17,7 месяца в группе П+Б (рис. 4). Во время первичного анализа ВБП данные по ОВ были незрелыми примерно у 16% умерших.
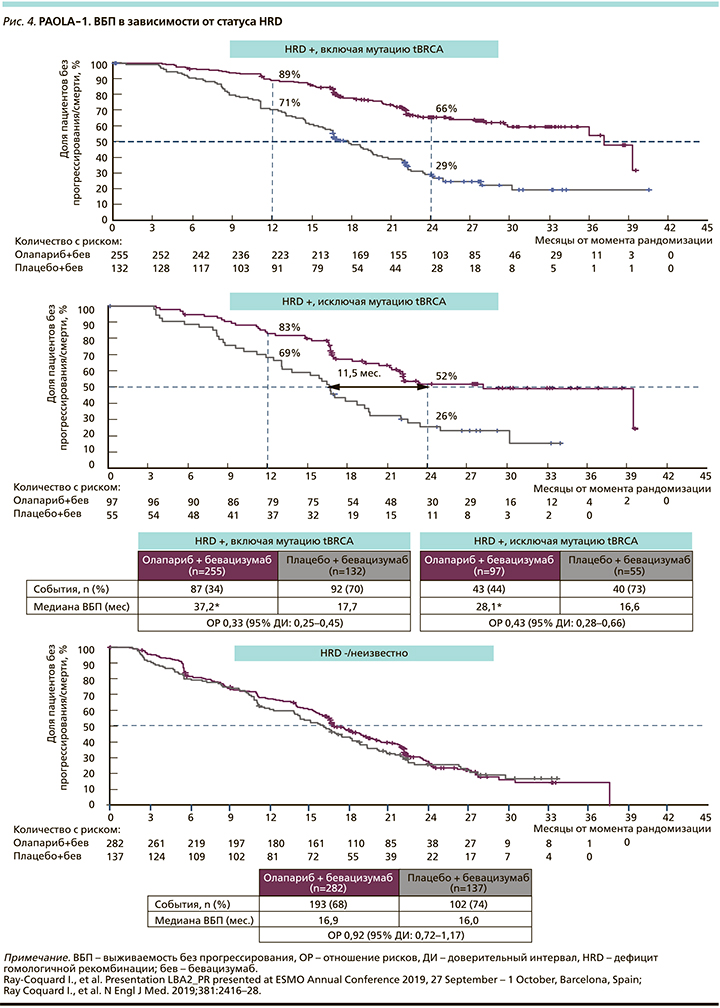
При этом и в группе пациенток с HRD+статусом и tBRCA дикого типа отмечено достоверное преимущество комбинации олапариба с бевацизумабом, что было определено у нашей пациентки: с ВБП 28,1 месяца по сравнению с 16,6 при лечении одним бевацизумабом (ОР=0,43, 95% ДИ: 0,28–0,66; рис. 4).
Очень примечательным фактом оказалось достоверное преимущество комбинации олапариба с бевацизумабом над бевацизумабом по выживаемости без второго прогрессирования (ВБП2), т.е. на поддерживающем комбинированном режиме отмечена отсрочка второго прогрессирования более чем на 20 месяцев (рис. 5).
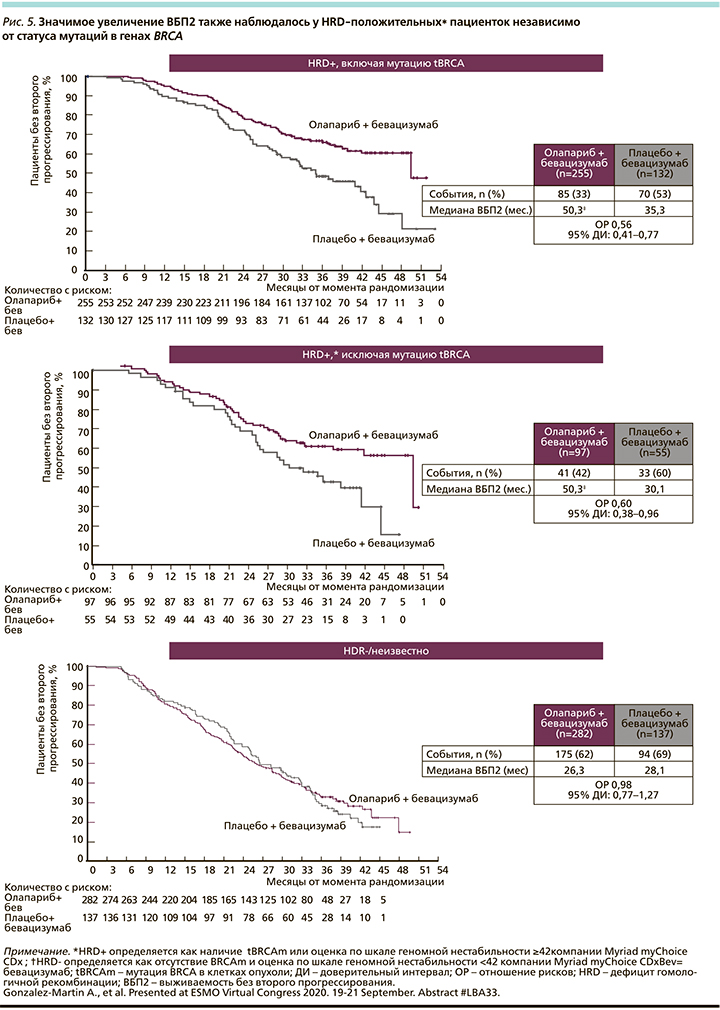
У пациенток с отрицательным HRD-статусом не наблюдалось никакой пользы по ВБП (18,9 месяца по сравнению с 16,0, ОР=0,71, 95% ДИ: 0,58–0,88).
Результаты безопасности
Первичная оценка безопасности для SOLО-1 была проведена всем пациенткам, получившим хотя бы одну дозу исследуемого препарата – олапариб или плацебо (олапариб, n=260; плацебо, n=130). Средняя общая продолжительность применения олапариба была примерно в 2 раза выше, чем плацебо (24,6 месяца против 13,9), что соответствует 2-летнему периоду лечения для пациенток, принимавших олапариб (табл. 2). Серьезные побочные эффекты наблюдались у 21% пациенток группы олапариба и 12% – группы плацебо. Прерывание лечения из-за побочных эффектов было зарегистрировано в 52% случаев, снижение дозы – у 29% пациенток, получавших олапариб, по сравнению с 17 и 3% пациенток, получавших плацебо, соответственно. Гематологические побочные эффекты были наиболее частыми.
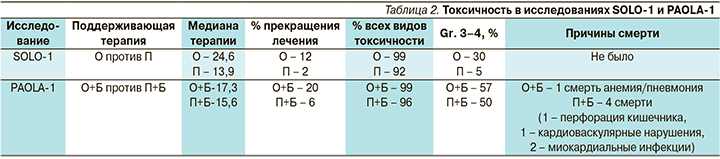
Прекращение лечения из-за побочных эффектов произошло в 12% случаев у пациенток, получавших олапариб, по сравнению с 2% пациенток на плацебо. Наиболее распространенные побочные эффекты, приведшие к прекращению лечения, – утомляемость, анемия, тошнота и рвота. Наиболее распространенные виды токсичности 3–4-й степеней у пациенток, получавших олапариб, – усталость, анемия и желудочно-кишечные расстройства.
В исследовании PAOLA-1 535 пациенток группы O+Б и 267 – группы П+Б получили хотя бы одну дозу исследуемого препарата (табл. 2).
Средняя общая продолжительность лечения O+Б составила 17,3 месяца и была дольше, чем продолжительность лечения в группе П+Б (15,6 месяца), со средней продолжительностью введения бевацизумаба 11,0 месяцев против 10,4 соответственно. Схожее число пациенток группы O+Б испытывали серьезные побочные эффекты по сравнению с таковыми группы П+Б (31% в обеих группах). Побочные эффекты, приведшие к прекращению лечения, возникли у 20% пациенток группы O+Б по сравнению с 6% в группе П+Б. В группе O+Б 54% пациенток потребовалось прерывание лечения из-за побочных эффектов по сравнению с 24% в группе П+Б, а снижение дозы составило 41,0 против 7,5% в каждой группе соответственно.
Артериальная гипертензия (АГ) была зарегистрирована в более низком процентном соотношении у пациенток группы O+Б (46%) по сравнению с пациентками группы П+Б (60%). Аналогичным образом АГ 3–4-й степеней встречалась реже в группе O+Б по сравнению с группой П+Б (19 против 30% соответственно).
Никаких последствий АГ, таких как инсульт или инфаркт миокарда, отмечено не было. Венозная тромбоэмболия чаще отмечалась у пациенток, получивших O+Б, по сравнению с теми, кто получал П+Б (5,0 против 1,9%). Миелодиспластический синдром (МДС), острый миелоидный лейкоз (ОМЛ) и пневмонит были определены как ключевые и представляющие интерес побочные эффекты при приеме олапариба [15]. МДС/ОМЛ и пневмонит, по данным клинических испытаний, включивших исследования по изучению монотерапии олапарибом, встречались в 1,2 и 0,9% соответственно.
В исследовании SOLO-1 частота МДС/ОМЛ составила 1,2%, т.е. у трех пациенток были выявлены новые случаи МДС/ОМЛ из уже пролеченных олапарибом пациенток (после прекращения терапии) и во всех случаях эти виды токсичности привели к летальному исходу.
В исследовании PAOLA-1 МДС/ОМЛ составили 0,7%: 2 случая ОМЛ закончились летальным исходом и 1 случай МДС выявлен в группе O+Б, что было немного меньше, чем в объединенном анализе по изучению монотерапии олапарибом (1,2%); однако в PAOLA-1 был более короткий период наблюдения по сравнению с данными исследований монотерапии. Пневмонит/интерстициальное заболевание легких (ИЗЛ) также является токсичностью, связанной с олапарибом, частота пневмонита составила 1,9% в исследовании SOLO-1. Частота пневмонита в исследовании PAOLA-1 составила 1,1% и несущественно отличалась от совокупной частоты встречаемости (в 0,9%), что сообщалось в исследованиях по изучению монотерапии олапарибом.
Заключение
Олапариб является первым ингибитором PARP, получившим одобрение FDA (Food and Drug Administration) для поддерживающего лечения в монотерапии или в сочетании с бевацизумабом для пациенток с впервые выявленным РЯ, и это событие за последние несколько десятков лет обусловило серьезный прорыв в стандарте лечения пациенток с РЯ.
Хотя исследование SOLO-1 было проведено для пациенток с герминальными BRCAm, ответ на олапариб у двух пациенток с соматическими мутациями BRCA лег в основу возможной чувствительности ингибиторов PARP для пациенток с другим дефицитом HRR [16, 17].
Исследование PAOLA-1 включило более широкую выборку пациенток без наличия знаний о статусе BRCA. Результаты исследования продемонстрировали клинически значимое улучшение ВБП при добавлении олапариба к бевацизумабу для всей группы пациенток с распространенным РЯ high-grade с серозной или эндометриоидной аденокарциномой, но преимущество было за счет группы больных HRD-положительными опухолями, включая все tBRCAm.
А среди подгруппы пациенток с HRD-отрицательным статусом преимуществ от добавления олапариба не было.
Преимущество ВБП, наблюдаемое при применении O+Б пациентками с опухолями tBRCAm в PAOLA-1, соответствует результатам, представленным в SOLO-1, что говорит о том, что пациенткам с мутацией BRCA независимо от происхождения (соматическая или герминальная) достаточно применения монотерапии олапарибом. А вот применение комбинации О+Б достоверно доказало преимущество для группы пациенток только с HRD-положительным статусом.
Профиль токсичности олапариба и бевацизумаба хорошо изучен и легко управляем. Важным фактом на сегодня является не только колоссальное увеличение ВБП при применении поддерживающего лечения для распространенного РЯ после первичной терапии, но и значительное увеличение времени до второго прогрессирования процесса, что приводит к более позднему применению ХТ второй и последующих линий.
С появления новой опции поддерживающего лечения наша пациентка находится на поддерживающей терапии бевацизумабом и олапарибом уже 2 года без признаков прогрессирования процесса с хорошей переносимостью лечения.



