Одним из наиболее частых и опасных побочных эффектов цитостатической терапии
является нейтропения. Цитостатики, действуя на быстроделящиеся клетки, затрагивают и систему кроветворения. Циркулирующие нейтрофилы живут в среднем 6–9 часов, и система гемопоэза постоянно вырабатывает около 50 млн этих клеток в 1 минуту для замещения выбывших. Снижение
продукции нейтрофилов после воздействия химиопрепаратов приводит к быстрому уменьшению содержания этих клеток в периферической крови, что повышает риск развития инфекционных осложнений.
Длительная нейтропения зачастую не позволяет проводить химиотерапию (ХТ) в запланированные сроки, заставляет редуцировать дозы цитостатиков, что в свою очередь снижает эффективность противоопухолевого лечения. Кроме того, инфекционные осложнения на фоне нейтропении в
отсутствие адекватной терапии характеризуются стремительным течением и высокой летальностью. В связи с этим существует необходимость тщательной оценки миелотоксического потенциала современных режимов химиотерапии и выявления групп больных с высоким риском развития нейтропении, которым требуется профилактическое назначение колониестимулирующих факторов (КСФ).
Повышенный риск развития инфекции на фоне нейтропении обусловил выделение симптомокомплекса
“фебрильная нейтропения” (ФН). Согласно руководству NCCN (National Comprehensive Cancer Network) [1], ФН характеризуется повышением температуры в ротовой полости выше 38,5 °С при однократном измерении или выше 38,0 °С при двух последовательных измерениях в течение 2 часов при абсолютном числе нейтрофилов (АЧН) в крови менее 0,5 × 109/л или ожидаемом снижении < 0,5 × 109/л.
Перед первым циклом ХТ пациента необходимо оценить риск развития ФН. При этом должны учитываться:
• режим ХТ (высокодозная, дозоинтенсивная, стандартная);
• тип опухоли;
• дополнительные факторы риска;
• цель проводимой ХТ (направленная на выздоровление, паллиативная).
Риск развития ФН напрямую связан с интенсивностью химиотерапевтического режима. Согласно рекомендациям NCCN [1], химиотерапевтические режимы, вызывающие ФН более чем в 20 % случаев, должны рассматриваться как режимы с “высоким риском” развития ФН. В подобных ситуациях
рекомендуется назначение гранулоцитарных КСФ (Г-КСФ) в качестве первичной профилактики. Аналогичные рекомендации дают Американское общество клинической онкологии (ASCO – American Society Clinical Oncology) [2] и Европейская организация по исследованию и лечению рака (EORTC – European Organization Research and Treatment of Cancer) [3].
При “промежуточном риске” вероятность развития ФН или нейтропенической инфекции составляет 10–20 %. Вне зависимости от цели проводимого лечения NCCN рекомендует в этой ситуации рассматривать вопрос о необходимости назначения КСФ в каждом индивидуальном случае. При
этом следует учитывать соотношение риска и пользы от применения КСФ, вероятность развития ФН, потенциальные последствия нейтропенической инфекции, а также отдаленные результаты лечения онкологических больных, получавших химиопрепараты в редуцированных дозах. Когда проводимое лечение не направлено на выздоровление и оно является симптоматическим, а риск определя-
ется режимом ХТ, рекомендуется рассматривать альтернативные способы профилактики ФН (использование менее миелосупрессивных режимов ХТ, редукцию доз химиопрепаратов). В данной ситуации применение КСФ нецелесообразно.
Пациентам с “низким риском” ФН (< 10 %) рутинное использование КСФ не рекомендуется. КСФ могут применяться только в тех случаях, когда больной получает адъювантную ХТ или существует высокий риск развития серьезных осложнений ФН, а редукция доз химиопрепаратов приводит к снижению эффективности противоопухолевого лечения.
Ниже приводятся химиотерапевтические режимы с высоким (табл. 1) и промежуточным (табл. 2) риском развития ФН.
Таблица 1. Режимы ХТ с высоким риском развития ФН.
Таблица 2. Режимы ХТ с промежуточным риском развития ФН.
Помимо вышеописанных основных факторов риска развития ФН существуют дополнительные, которые необходимо учитывать при определении общего риска ФН. Дополнительные факторы могут повышать общий риск до более высокой категории.
К дополнительным факторам относятся возраст пациента старше 65 лет (выше риск развития ФН, более высокие показатели частоты осложнений и смертности); проводимая ранее ХТ;наличие в анамнезе глубокой нейтропении (АЧН < 100/мкл), нейтропении протяженностью >10 дней или ФН
после ХТ; вовлечение в опухолевый процесс костного мозга; лучевая терапия в анамнезе; недавно перенесенное оперативное вмешательство; наличие раневого процесса; плохой соматический статус пациента; нарушение функции печени и почек; пневмония; присоединившаяся грибковая инфекция.
Риск развития инфекционных осложнений у больных нейтропенией обусловлен не только уменьшением АЧН, но и нарушением функциональных свойств нейтрофилов (ослабление хемотаксиса и фагоцитоза; нарушение экзогенной продукции ростовых факторов, таких как интерлейкин-1,
интерлейкин-3, гранулоцитарно-макрофагального КСФ, Г-КСФ; изменение активности ферментов; снижение образования активных форм кислорода).
Оценка риска развития ФН должна проводиться перед каждым курсом ХТ. Если пациент в течение предыдущего цикла ХТ перенес эпизод ФН или дозолимитирующей нейтропенической инфекции и проводимая ХТ направлена на выздоровление, проведение последующих курсов ХТ в прежних дозах влечет за собой “высокий риск” развития ФН. В таких случаях необходимо рассмотреть вопрос об использовании КСФ. Если пациент перенес эпизод ФН, несмотря на использование КСФ, NCCN рекомендует провести редукцию доз химиопрепаратов во время последующих циклов или изменить
режим ХТ.
Эти рекомендации основаны на результатах крупных рандомизированных исследований, показавших, что риск развития ФН может быть значи-тельно снижен благодаря проведению первичной профилактики с использованием КСФ.
Vogel и соавт. [4] в двойном слепом рандомизированном плацебо-контролируемом многоцентровом
исследовании установили, что при первом и всех последующих циклах ХТ профилактическое назначение КСФ (пегилированный филграстим) значительно снижает риск развития ФН при режимах ХТ, которые прежде ассоциировались с “высоким риском” этого осложнения. В исследование
были включены больные РМЖ, получавшие доцетаксел 100 мг/м2 каждые 3 недели. Пациентки были распределены в 2 группы: 1-я группа (465 жен-щин) получала инъекции плацебо; 2-я группа (463 женщины) – пегфилграстим подкожно (вводился через 24 часа после завершения цикла ХТ). В группе
плацебо частота развития ФН составила 17 %, в группе пегфилграстима – 1 %. Потребность в госпитализации уменьшилась с 14 до 1%, а в использовании внутривенной антибактериальной терапии (АБТ) – с 10 до 2 % (p < 0,001).
В исследовании Timmer–Bonte и соавт. [5] 175 больных МРЛ получали лечение комбинацией циклофосфан +доксорубицин + этопозид. В последующем все пациенты были рандомизированы в 2 группы: в 1-й группе проводилась профилактическая АБТ (ципрофлоксацин + рокситромицин); 2-я группа получала АБТ + Г-КСФ (в 4–13-й дни цикла). После первого цикла ХТ развитие ФН отмечено у 20 (24 %) пациентов группы, получавшей только антибиотики, по сравнению с 9 (10 %) больными, получавшими АБТ + Г-КСФ (p = 0,01).
Таким образом, у пациентов с “высоким риском” развития ФН первичная профилактика с помощью КСФ в сочетании с АБТ значительно снижает риск развития инфекционных осложнений [6, 7].
В некоторых исследованиях (Labro М.Т., 2000; Nelson S., 2001) было установлено, что Г-КСФ усиливают
действие АБТ за счет повышения внутриклеточной концентрации антибиотика в нейтрофилах, что в свою очередь оказывает модифицирующий эффект на функциональную активность нейтрофилов. Повышается их антителозависимая цитотоксичность по отношению к опухолевым клеткам; ускоряется фагоцитоз бактерий и грибов; происходит миграция нейтрофилов из периферической крови в очаги
инфекции и воспаления.
К применяемым в настоящее время Г-КСФ относятся филграстим, пегфилграстим и сарграмостим.
Филграстим рекомендуется использовать в ежедневной дозе 5 мкг/кг/сут подкожно через 24–72 часа после введения последней дозы противоопухолевых препаратов до достижения стабильного и достаточного АЧН. Пегфилграстим (используется только для профилактики ФН) вводится подкожно 1 раз в общей дозе 6 мг через 24–72 часа после введения последней дозы противоопухолевых препаратов. Применяют его при химиотерапевтических режимах, курс которых составляет 3 недели. Сарграмостим вводится по 250 мкг/м²/сут подкожно через 24–72 часа после введения последней
дозы противоопухолевых препаратов до достижения стабильного и достаточного АЧН. Следует обратить внимание, что условие введения Г-КСФ через 1–3 суток после последней дозы цитостатиков связано с чувствительностью активно пролиферирующих миелоидных клеток к миелосупрессивной ХТ.
Первым из препаратов Г-КСФ, доступным для клинического применения, стал филграстим, полученный
с использованием рекомбинантной технологии в культурах Escherichia coli. В настоящее время существует много препаратов филграстима, одним из которых является Граноген.
Этот Г-КСФ стимулирует пролиферацию колониеобразующих клеток – предшественников нейтрофильного ростка костного мозга, ускоряет их дифференцировку и выход зрелых нейтрофилов из костного мозга в периферическую кровь, усиливает эффекторные функции нейтрофилов (хемотак-
сис, фагоцитоз, окислительный метаболизм). Граноген вызывает быстрое, специфическое и дозозависимое увеличение числа нейтрофилов в периферической крови, что объясняется укорочением времени созревания с 5 до 1 дня, повышением количества клеточных делений и ускоренным выходом клеток в периферическую кровь. Граноген уменьшает частоту, тяжесть и продолжительность нейтропении и ФН у больных, получающих миелосупрессивную терапию, что позволяет снижать частоту инфекционных осложнений, уменьшать потребность в АБТ.
Побочные эффекты при применении Г-КСФ, в т. ч. Граногена, встречаются редко; они маловыраженны.
Для лечения нейтропении после курса цитотоксической терапии Граноген вводят в дозе 0,5 млн ЕД
(5 мкг) на 1 кг массы тела, 1 раз в сутки, ежедневно, подкожно или в виде коротких (в течение 30 минут) внутривенных инфузий. Граноген не совместим с 0,9 %-ным раствором натрия хлорида. Предпочтителен подкожный путь введения. Увеличение числа нейтрофилов обычно наблюдается через 1–2 дня после начала лечения. Для достижения стабильного терапевтического эффекта необходимо продолжать терапию до тех пор, пока количество нейтрофилов не перейдет через ожидаемый минимум (надир) и не вернется в диапазон нормальных значений. Не рекомендуется отменять препарат преждевременно. Лечение прекращают, если АЧН после надира достигло 1 ×
109/л. После ХТ, проведенной по поводу сóлидных опухолей, длительность лечения может составлять до 14 дней. При увеличении числа лейкоцитов > 50·× 109/л Граноген следует немедленно отменять.
Успех лечения ФН во многом зависит от раннего распознавания возможной инфекции и раннего начала терапии. Нейтропения значительно ослабляет иммунный ответ организма, что не позволяет развиваться характерным клиническим проявлениям инфекции, затрудняя ее клиническую диагностику у онкологических больных. Гипертермия у пациентов с нейтропенией часто бывает единственным
признаком инфекционного процесса.
Согласно клиническим рекомендациям ESMO, необходимо проводить тщательные первичный осмотр и
обследование на выявление возможных очагов инфекции [8]:
1. Наличие длительно стоящего центрального венозного катетера.
2. Симптомы и признаки наличия инфекции дыхательной системы, сердечно-сосудистой системы,
желудочно-кишечного тракта, кожных покровов, мочеполовой системы, центральной нервной системы.
3. Данные о предшествующих положительных результатах микробиологического анализа.
4. Рутинные лабораторные и инструментальные исследования:
• общий и биохимический анализы крови, коагулограмма, С-реактивный белок;
• посев крови (минимум 2 раза), включая посев из центрального венозного катетера; микроскопическое исследование и посев мочи;
• микроскопическое исследование мокроты и ее посев;
• микроскопическое исследование кала и его посев (при диарее);
• исследование очагов инфекции на коже (аспират, биопсия, мазок);
• рентгенография органов грудной клетки.
5. Дальнейшие исследования (при длительной и глубокой нейтропении): компьютерная томография органов грудной клетки (если лихорадка сохраняется, несмотря на адекватную АБТ, более 72 часов).
Немедленный подсчет формулы крови для установления числа нейтрофилов параллельно с другими исследованиями, представленными выше, имеют ключевое значение для определения необходимости начала ранней терапии ФН.
Международной ассоциацией поддерживающей терапии при раке (MASCC) разработан прогностический индекс [9, 10]. Он позволяет быстро оценивать риск осложнений – до того, как станет известно содержание нейтрофилов в крови пациента. Эффективность данного метода подтверждена во многих проспективных исследованиях.
Критерии индекса MASCC представлены в табл. 3.
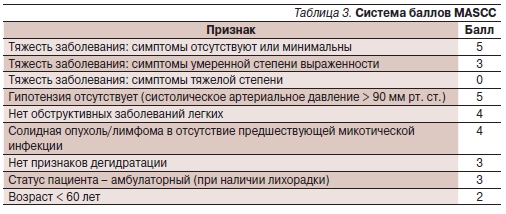
Показателем “низкого риска” осложнений является сумма баллов > 21. Частота серьезных осложнений при этом не превышает 6 %, а смертность – 1 %. При сумме баллов < 15 смертность достигает 36 %.
Стандартом лечения ФН является немедленное назначение эмпирической терапии антибиотиками широкого спектра действия. Такая терапия должна быть направлена против грамположительных и грамотрицательных микроорганизмов, обеспечивать быстрое бактерицидное действие и иметь низкую токсичность. При выборе способа введения антибиотиков необходимо руководствоваться
следующим принципом: пероральная АБТ может быть безопасно применена пациентами с ФН “низкого риска”. К данной категории больных относятся те, кто гемодинамически стабилен, у кого нет признаков органной недостаточности, длительно стоящего центрального венозного катетера или
тяжелой инфекции. Внутривенная АБТ должна проводиться пациентам с ФН “высокого риска”. После 48-часовой внутривенной АБТ больным, не имеющим лихорадки, могут быть назначены пероральные антибиотики [11].
По данным многочисленных исследований показано, что монотерапия фторхинолонами не менее эффективна, чем комбинированное применение фторхинолонов и амоксициллина/клавуланата. Однако данное утверждение не относится к пациентам с “высоким риском” ФН.
Обособленно от стандартной терапии антибиотиками широкого спектра действия стоит большое число клинических ситуаций, когда требуется применение специфических режимов лечения. Так, например, в случае пневмонии необходимо назначать антибактериальные препараты, которые перекрывали бы спектр ати-пичных микроорганизмов (Legionella, Mycoplasma), например макролиды и
β-лактамные антибиотики. Высокие дозы ко-тримоксазола – терапия выбора при подозрении на инфекцию, вызванную Pneumocystis jerovecii [12].
Во всех случаях катетерассоциированной инфекции (КАИ) при ФН требуется определиться с
выбором и путем введения антибиотиков, необходимостью удаления катетера. Если при подозрении на КАИ состояние пациента стабильное, катетер не следует удалять без микробиологического доказательства наличия инфекции. Рекомендовано назначение гликопептидов (ванкомицина) через
катетер. В этом случае перекрывается грамположительная флора [13]. При КАИ, вызванной коагулазонегативным стафилокококком, попытка сохранения катетера может быть оправданной
только при условии стабильного состояния пациента. Сохранение катетера в большинстве случаев не влияет на разрешение бактериемии, вызванной коагулазонегативным стафилокококком, но является значимым фактором риска рецидива инфекции [14]. Удаление катетера показано при наличии воспаления в месте стояния катетера или порта, персистирующей лихорадки и бактериемии, сохраняющихся на адекватную АБТ, при наличии атипичной микобактериальной инфекции и кандидемии. При КАИ, вызванной Staphylococcus aureus, рекомендуется удаление катетера [15].
При развитии диареи необходимо проводить исследование на Clostridium dеfficili, а при подозрении на клостридиальную инфекцию – начинать терапию метронидазолом. При вирусной инфекции показан ацикловир. Ганцикловир следует назначать только при высокой степени подозрения на инвазивную цитомегаловирусную инфекцию. В случае развития кандидоза препаратом первой линии явля-
ется флуконазол. Противогрибковую терапию следует продолжать до разрешения нейтропении, а больным с доказанной микотической инфекцией – в течение 14 дней.
Терапия при подозрении на инвазивный аспергиллез должна включать каспофунгин, либо липосомальный амфотерицин В, либо вариконазол. Последние два препарата можно комбинировать с эхинокандином в случае отсутствия ответа на терапию [16–18]. При подозрении на менингит показано выполнение люмбальной пункции. При бактериальном менингите следует назначать цефтазидим в сочетании с ампициллином (для прикрытия от Listeria monocytogenes) или меропенем [19].
Если имеются клинические или микробиологические доказательства интраабдоминального или тазового сепсиса, следует начинать терапию метронидазолом. Длительность лечения ФН может быть различной. Если число нейтрофилов повысилось до 0,5 × 109/л и более, в течение 48 часов отмечается нормальная температура тела, посев крови не выявляет возбудителя, АБТ можно прекратить. При количестве нейтрофилов < 0,5 × 109/л, отсутствии осложнений и лихорадки в течение 5–7 дней АБТ также можно завершить. Исключением являются ситуации, когда сохраняется “высокий риск” развития осложнений. В этом случае АБТ продолжается до 10 дней или до тех пор, пока количество нейтрофилов не составит 0,5 × 109/л и более. Больным с сохраняющейся лихорадкой при числе нейтрофилов 0,5 × 109/л и более целесообразно назначfть антимикотическую терапию.
Таким образом, несмотря на значительные успехи в профилактике и лечении ФН, она остается одним из наиболее грозных осложнений ХТ злокачественных опухолей и ведет к изменению сроков применения цитостатиков, редукции доз химиопрепаратов, что отрицательно сказывается на эффективности противоопухолевого лечения. Широкое внедрение в клиническую практику Г-КСФ позволяет значительно уменьшать степень выраженности и длительность нейтропении, снижать риск развития ФН при проведении миелосупрессивной ХТ. Все это позволяет сохранять запланированную дозовую интенсивность режима, а иногда и интенсифицировать режим за счет сокращения интервалов между курсами.



