Введение
Полиморфная желудочковая тахикардия, или тахикардии типа «пируэт» (Torsades de Pointes, TdP), являясь потенциально жизнеугрожающей тахиаритмией, способной приводить к развитию внезапной сердечной смерти (ВСС), тесно ассоциирована с удлинением интервала QT [1, 2]. Известны две большие этиологические группы, обусловливающие развитие удлинения интервала QT и TdР: врожденные и приобретенные [3]. Среди приобретенных причин наиболее часто встречается лекарственно-обусловленное развитие удлинения интервала QT и TdР [4].
Распространенность
К настоящему времени известно, что препараты, способствующие пролонгации интервала QT и развитию TdР, имеются практически во всех существующих группах лекарственных средств (ЛС), составляя от 2 до 3% от общего числа используемых препаратов [5]. При этом распространенность лекарственно-индуцированного удлинения интервала QT и TdР в общей популяции остается неизвестной и требует дальнейшего изучения. В литературе имеются лишь данные, касающиеся распространенности лекарственно-индуцированного удлинения интервала QT и развития TdР в отдельных странах. Так, исследование Управления по контролю над лекарственными средствами и продуктами медицинского назначения Швеции (Swedish Medical Products Agency, MPA; Swedish) [6] предприняло попытку определить общее число случаев развития лекарственно-индуцированных желудочковых аритмий, наблюдая в течение 28 дней за 4,2 млн пациентов в 32 лечебных учреждениях. Были зафиксированы все эпизоды желудочковых аритмий, обусловленных ЛС и выявленных при поступлении, а также при мониторировании ЭКГ в процессе лечения. Полученный показатель составил 3,3 случая на 1 млн пациентов в течение 28-дневного срока наблюдения, или 4 случая на 100 тыс. человек в год. Другое шведское исследование, выполненное С. Astrom-Lilja et al. [7], проанализировав данные системы сообщений о побочных эффектах ЛС с 1991 по 2006 г., выявило, что из 61788 зафиксированных случаев, 101 был лекарственно-индуцированной TdР. Исследование G. Sarganas et al. [8] показало, что в 2014 г. в Берлине регистрировалось 2,5 случая лекарственно-индуцированного удлинения QT/TdР на 1 млн мужского населения города и 4 на 1 млн женского. А в популяционном исследовании на юго-западе Франции показатель развития лекарственно-индуцированной TdР оценивался в 5–7% от всех случаев желудочковых тахиаритмий или ВСС [9].
Имеются данные о том, что удлинение интервала QT наиболее распространено среди госпитализированных больных, особенно среди пациентов отделений интенсивной терапии [10], составив от 28 до 52% [11, 12]. Случаи развития TdP среди госпитализированных пациентов изучены гораздо меньше. D. Pickhamm et al. [13], наблюдавшие пациентов отделений интенсивной терапии в течение 2 месяцев, сообщают об 1 случае на 154 пациента (0,6%), что составило 1 из 16 случаев остановки сердечной деятельности в этих отделениях.
Лекарственные средства, прием которых ассоциирован с развитием TdР
К наиболее известным и часто используемым как в амбулаторной, так и в стационарной практике группам ЛС, имеющим представителей, способствующих развитию удлинения интервала QT/TdР, относятся антиаритмики (IA-, IC- и III классов), антипсихотики, антидепрессанты, антибактериальные препараты (макролиды и фторхинолоны), антигистаминные средства, противоопухолевые, противогрибковые препараты, прокинетики, гиполипидемические средства, диуретики (кроме калий-сберегающих). Перечень ЛС, способствующих развитию TdP, постоянно обновляется, а усилия специалистов Аризонского университета (Arizona Center for Education and Research on Therapeutics, AzCERT), разработавших веб-сайт CredibleMeds.org, позволяют следить за актуальным списком препаратов, ассоциированных с развитием TdP. Все препараты, представленные на сайте, подразделены на группы в зависимости от того, ассоциированы ли они с известным, возможным или условным рисками развития удлинения QT/TdР. ЛС с известным риском – это ЛС, в отношении которых имеются существенные доказательства, подтверждающие их QT-удлиняющее действие и четкую связь с риском развития TdР, даже когда препараты принимаются четко в соответствии с инструкцией, указанной в официальной маркировке. Список ЛС с возможным риском включает ЛС, для которых имеются существенные доказательства, согласно которым они могут стать причиной удлинения интервала QT, но в настоящее время нет достаточных доказательств, что эти ЛС при использовании, согласно официальной маркировке, ассоциированы с риском возникновения TdР. Наконец, для ЛС с условным риском имеются существенные доказательства того, что их прием ассоциирован с риском TdР, но только при определенных условиях (например, передозировка ЛС, гипокалиемия, врожденное удлинение QT или в случае лекарственного взаимодействия). Перечни препаратов с известным, вероятным и возможным рисками развития TdР, а также число случаев развития TdP, ассоциированных с приемом того или иного препарата, представлены в табл. 1–3.
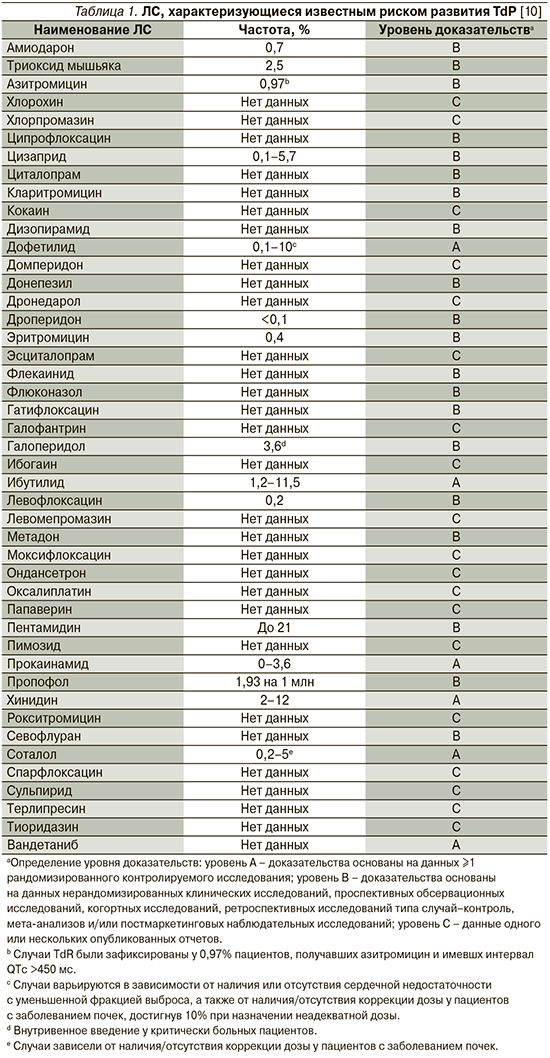
Известно, что использование отдельных антипсихотиков ассоциировано с повышенным риском ВСС в результате развития TdP [10]. Так, в популяционном исследовании типа случай–контроль S.M. Straus et al. [14] изучили 150 медицинских карт и обнаружили, что использование антипсихотических препаратов было ассоциировано со значительным увеличением риска ВСС (отношение шансов [ОШ] – 3,3; 95% доверительный интервал [ДИ] – 1,8–6,2), причем риск был наивысшим среди пациентов, получавших препараты бутирофенона (галоперидол).
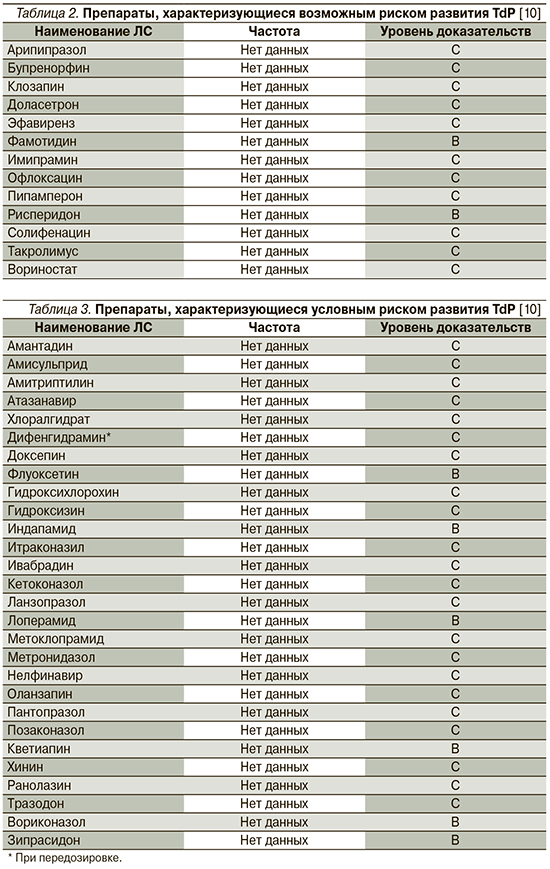
О повышенном риске ВСС сообщили W.A. Ray et al. [15] по данным ретроспективного когортного исследования, причем риск был ассоциирован с использованием как типичных, так и атипичных антипсихотических препаратов, аналогичные результаты были получены и в других исследованиях [16, 17], а C.S. Wu et al. [18] обнаружили, что прием антипсихотических препаратов с наибольшей способностью к ингибированию IKr ассоциирован с самым высоким риском желудочковых аритмий и/или ВСС. Мета-анализ F. Salvo et al. [19] показал, что разные антипсихотические средства были ассоциированы с различным уровнем риска развития ВВС и распределились следующим образом: тиоридазин>клозапин>риссперидон>галоперидол>оланзапин>кветиапин.
Прием макролидных антибиотиков также ассоциирован с повышенным риском ВСС. J.Y. Cheng et al. [20] провели мета-анализ 33 исследований, включивших почти 21 млн пациентов, оценивавших связь между приемом макролидных антибиотиков и сердечно-сосудистым риском. Было выявлено, что больные, принимавшие макролиды, имели повышенный риск ВВС или желудочковых тахиаритмий (2,42; 95% ДИ – 1,61–3,63), ВВС (2,52; 95% ДИ – 1,91–3,31) и сердечно-сосудистой смерти (1,31; 95% ДИ – 1,06–1,62) по сравнению с лицами, не принимавшими макролидные антибиотики.
В исследовании W.A. Ray et al. [21] было обнаружено, что в группе пациентов, получавших эритромицин, скорректированный показатель ВСС был в 2 раза выше, чем у лиц, не применявших данный препарат. Кроме того, скорректированная частота ВСС была в 5 раз выше среди пациентов, которые помимо эритромицина одновременно использовали и препараты, подавляющие активность ферментов системы цитохрома-P450. Аналогичное исследование пациентов, принимавших азитромицин, выявило у последних повышенный риск сердечно-сосудистой смерти (отношение рисков [ОР] – 2,88; 95% ДИ – 1,79–4,63; p<0,001) и смерти от всех причин (ОР – 1,85; 95% ДИ – 1,25–2,75; р<0,0021) по сравнению с пациентами, не принимавшими данный антибиотик [22]. Прием кларитромицина также ассоциирован с повышенным риском сердечно-сосудистых событий (госпитализация в связи с острым коронарным синдромом, декомпенсация сердечной недостаточности [СН], жизненно опасные нарушения ритма сердца или ВСС) [23].
Механизмы развития лекарственно-индуцированного TdP
Известно, что в основе механизма развития TdP лежит удлинение реполяризации желудочков, что приводит к увеличению продолжительности потенциала действия (ПД) и проявляется на ЭКГ удлинением интервала QTc [10]. Активация входящих деполяризующих токов и пролонгация ПД способствуют повышенной восприимчивости к ранней постдеполяризации, проявляющейся как деполяризационные колебания в напряжении мембраны во время фазы 2 или 3 ПД.
В свою очередь возникновение ранних постдеполяризаций способно приводить к генерации преждевременных ПД, которые могут инициировать развитие TdР через механизм reentry («повторный вход»).
В основе удлинения реполяризации желудочков и увеличения продолжительности ПД лежит уменьшение выходящего или увеличение входящего тока во время фазы плато или фазы замедленной реполяризации ПД (или обеих) [10]. ЛC индуцируют TdP посредством ингибирования выходящего тока через специфические калиевые каналы (прежде всего быстрого компонента калиевого тока задержанного выпрямления [IКr]), что приводит к пролонгации ПД [10]. Некоторые ЛС (например, ибутилид) продлевают ПД желудочков также благодаря активации медленного натриевого тока (INa) во время 2-й фазы ПД [10]. Считается, что ранняя постдеполяризация, запускающая TdP, может быть вызвана повышенным входящим током кальция через кальциевые каналы, которые становятся реактивированными в результате увеличения продолжительности ПД.
Хотя ингибирование IКr и/или активация INa, а также удлинение реполяризации желудочков обязательны для развития TdP, наличия одних этих факторов оказывается недостаточно для возникновения аритмии. У многих пациентов, принимающих препараты, ингибирующие IКr, развивается удлинение интервала QTc, но не TdP.
В настоящее время исследователи полагают, что основным фактором, увеличивающим вероятность развития TdP, служит гетерогенность реполяризации (дисперсия реполяризации или рефрактерности) [1]. Известно, что сердечная мышца характеризуется электрической гетерогенностью и длительность ПД варьируется по трем основным типам желудочковых клеток (эпикардиальных, миокардиальных, эндокардиальных), различающихся по реполяризационным характеристикам в фазах 1 и 3 ПД [10]. Считается, что риск лекарственно-индуцированного TdP повышается у пациентов с повышенной трансмуральной гетерогенностью желудочковой реполяризации [10]. Кроме того, риск TdP может зависеть от нестабильности потенциала действия (быстрые колебания длительности потенциала действия) и степени триангуляции потенциала действия (замедление реполяризации, при которой ПД приобретает треугольную форму) [10].
Еще одной важной концепцией в отношении лекарственно-индуцированного TdP является т.н. резерв реполяризации [24]. Известно, что в нормальных условиях существует множество избыточных механизмов, которые поддерживают нормальную реполяризацию желудочков: IКr и другие токи реполяризации (медленный компонент калиевого тока задержанного выпрямления, INa, ток аномального выпрямления, транзиторный выходящий ток). Ингибирование IКr ЛС в присутствии неизменного резерва реполяризации редко приводит к TdP, т.к. избыточность реполяризационных токов минимизирует влияние ингибирования IКr. Однако при наличии факторов, уменьшающих резерв реполяризации (факторы риска развития TdP), ингибирование IКr может иметь гораздо большее влияние на удлинение желудочковой реполяризации и способствует развитию TdP.
Клиническая картина, диагностика, дифференциальная диагностика лекарственно-индуцированного TdP
Клинические симптомы, обусловленные развитием TdP, аналогичны таковым других тахиаритмий и основаны на увеличении частоты сердечных сокращений (ЧСС) с последующим изменением показателей артериального давления и сердечного выброса, проявляясь в виде эпизодов головокружения, сердцебиения, одышки, обморочного состояния, эпизода боли в грудной клетке (у пациентов с атеросклерозом коронарных артерий), а также судорог, гипотонии, либо TdP вообще не имеет каких-либо клинических проявлений [10]. Преходящие эпизоды TdP длительностью более 10 секунд сопровождаются развитием синкопальных состояний, однако отсутствие восстановления сердечного ритма в течение 1–2 минут может перерасти в фибрилляцию желудочков и привести к летальному исходу – ВСС. В течение последние двух десятков лет по причине развития ВСС в результате TdP с фармакологического рынка США были отозваны некоторые лекарственные препараты, в т.ч. терфенадин, астемизол, грепафлоксацин, цизаприд, левометадил и мезоридазин.
Диагностика TdP основана на ЭКГ-картине, регистрирующей полиморфную желудочковую тахикардию с неправильным ритмом и широкими полиморфными желудочковыми комплексами с меняющейся амплитудой (как бы закручивающейся вокруг изоэлектрической линии) со скоростью 160–240 в минуту в условиях продленного интервала QTс [10]. Кроме того, развитию TdP часто предшествует чередование интервалов RR типа «короткий–длинный–короткий», возникающее в результате развития преждевременного сокращения желудочков с последующей компенсаторной паузой, за которой и следует первый «залп» TdP.
Определение интервала QT также имеет свои особенности. Необходимым считается определение не абсолютного показателя продолжительности интервала, а т.н. корригированного QT (QTc) [10]. Необходимость коррекции интервала QT обусловлена его обратной зависимостью от ЧСС: с увеличением ЧСС продолжительность интервала QT сокращается, и наоборот. С целью определения величины QTс наиболее часто используется формула Базетта (Bazett): QTc = QT√RR.
Дифференциальная диагностика лекарственно-индуцированной TdP подразумевает исключение других тахиаритмий (мерцательная аритмия, трепетание предсердий, предсердная тахикардия, рецидивирующая ариовентрикулярная узловая реципроктная тахикардия, не-TdR полиморфная желудочковая тахикардия, синусовая тахикардия, функциональная тахикардия, мономорфная желудочковая тахикардия, фибрилляция желудочков) и основана на анализе ЭКГ [10]. Так, наличие у пациента удлинения интервала QTc до или вскоре после эпизода полиморфной желудочковой тахикардии позволяет отличать TdP от не-TdP полиморфной желудочковой тахикардии.
Важным критерием, позволяющим заподозрить лекарственно-индуцированный характер TdP, служит изучение перечня ЛС, используемых пациентом, с целью определения наличия препарата, способного вызывать TdP или по крайней мере обладающего способностью индуцировать удлинение интервала QTc [10]. И здесь необходимо помнить о зависимости развития TdP, ассоциированной с использованием того или иного ЛС, от способа приема препарата. Так, при использовании внутривенной лекарственной терапии развитие TdP, как правило, совпадает с ожидаемым временем пиковой концентрации препарата в плазме крови [10]. Например, многие случаи TdP, вызванной внутривенным введением эритромицина, имели место во время инфузии или в течение 30 минут после ее завершения [10]. TdP, индуцированная внутривенным введением галоперидола, наступает через 15–220 минут после инфузии, а ибутилида – через 2–60 минут после введения препарата [10]. В свою очередь TdP, вызванная пероральными формами ЛС, может быть отсрочена. Так, анализ 144 опубликованных статей, в которых в общей сложности описываются 249 пациентов, у которых развилась TdP [25], показал, что использование ЛС некардиологического профиля было ассоциировано с развитием 18% случаев, произошедших в течение первых 72 часов после начала пероральной терапии, 42% случаев произошли между 3-м и 30-м днями, а 40% – более чем через 30 дней после начала пероральной терапии.
Не менее важным диагностическим моментом считается оценка наличия у пациента сопутствующих факторов риска развития TdP, которые значительно увеличивают вероятность возникновения жизнеугрожающей тахиаритмии.
Факторы риска развития TdP
Лекарственно-индуцированная TdP чрезвычайно редко встречается у пациентов без сопутствующих факторов риска. Так, D. Zeltser et al. [25], проанализировав случаи развития лекарственно-индуцированных TdP у 249 пациентов, показали, что почти у 100% из них был по крайней мере 1 фактор риска, у 71% – по крайней мере 3 фактора.
В настоящее время известны следующие факторы риска развития лекарственно-индуцированной TdP [26–29]: пожилой возраст, брадикардия, одновременное применение >1 ЛС, способствующих развитию удлинения интервала QTc/TdP, повышение концентрации в плазме крови QT-удлиняющих ЛС вследствие лекарственного взаимодействия или неадекватной коррекции дозы при дисфункции почек/печени, женский пол, СН со сниженной фракцией выброса (ФВ), лекарственно-индуцированная TdP в анамнезе, гипокальциемия, гипокалиемия, гипомагниемия, увеличение интервала QTc на >60 мс по сравнению с исходным показателем, интервал QTс >500 мс, быстрая внутривенная инфузия ЛС, удлиняющих QTc, сепсис, наконец, самоудлинение интервала QTc на ЭКГ также определяется как фактор риска развития TdP.
В литературе представлено множество исследований, доказывающих заметное влияние факторов риска на вероятность развития TdP. Так, риск TdP заметно возрастает, когда интервал QTc превышает 500 мс, а при продолжительности интервала QTc <500 мс TdP возникает достаточно редко [26–29]. Также риск развития TdP возрастает, когда интервал QTc на фоне терапии увеличивается на >60 мс по сравнению с исходным значением [28]. Возвращаясь к исследованию [25], можно обнаружить, что из 249 пациентов с развившейся TdP, индуцированной ЛС, более двух третей были женщины, 41% имели заболевания сердечно-сосудистой системы (инфаркт миокарда, СН, кардиомиопатия), 28% – гипокалиемию, 19% – передозировку ЛС или отсутствие коррекции дозы при дисфункции печени/почек, 18% – отягощенный семейный анамнез по синдрому удлиненного интервала QT, лекарственно-индуцированный TdP/удлинение интервала QT в анамнезе, 35% – лекарственные взаимодействия.
Причины повышенного риска лекарственно-индуцированной TdP у лиц с наличием тех или иных факторов риска продолжают изучаться. Предполагается, что у женщин повышенный риск развития TdP обусловлен проаритмогенным эффектом эстрогена, в то время как мужчины защищены антиаритмогенными эффектами тестостерона [30, 31]. Известно, что базовая продолжительность интервала OTc у женщин больше, чем у мужчин, что проявляется именно в период полового созревания [32, 33]. В исследовании R.R. Makkar et al. [34] из 332 пациентов с TdP, ассоциированной с приемом антиаритмических ЛС, 70% были женщинами. Другие исследования подтвердили предрасположенность женщин к развитию TdP, связанной с использованием азимилида, дофетилида, эритромицина, ибутилида, хинидина, соталола и терфенадина [35–38].
СН со сниженной ФВ является одним из основных факторов риска развития лекарственно-индуцированной TdP [10]. Механизмы, лежащие в основе повышенного риска развития TdP у этой группы пациентов, продолжают изучаться. Предполагается, что у лиц с СН со сниженной ФВ происходит подавление активности калиевых каналов, что способствует удлинению желудочковой реполяризации [10].
Важнейшим фактором риска является и повышение концентрации TdP-индуцирующих ЛС в плазме крови. Большинство случаев развития TdP, ассоциированных с использованием эритромицина или галоперидола, имели место после внутривенного введения препарата в результате более высоких пиковых концентраций в плазме крови [10]. Также развитию TdP способствовало отсутствие адекватной коррекции дозы ЛС при наличии заболевания почек в случаях терапии дофетилидом, левофлоксацином, прокаинамидом и соталолом [10]. Перечень препаратов, способствующих развитию TdP и требующих коррекции доз при использовании пациентами с заболеваниями почек/печени, представлен в табл. 4.
Лекарственные взаимодействия – важный фактор риска развития лекарственно-индуцированного TdP [10].
В литературе описаны многочисленные случаи TdP, развившегося в результате повышения концентрации в плазме ЛС, являвшегося субстратом для системы цитохрома-Р450, при использовании в комбинации с препаратом, ингибирующим ее активность. Так, база данных FDA США располагает сведениями о 25 случаях развития TdP, связанных с терфенадином, при этом 9 пациентов получали сопутствующую терапию кетоконазолом или итраконазолом, которые, как известно, ингибируют метаболизм терфенадина [38]. ЛС, связанные с риском развития TdP, являющиеся субстратом для системы цитохрома-P450, перечислены в табл. 4.
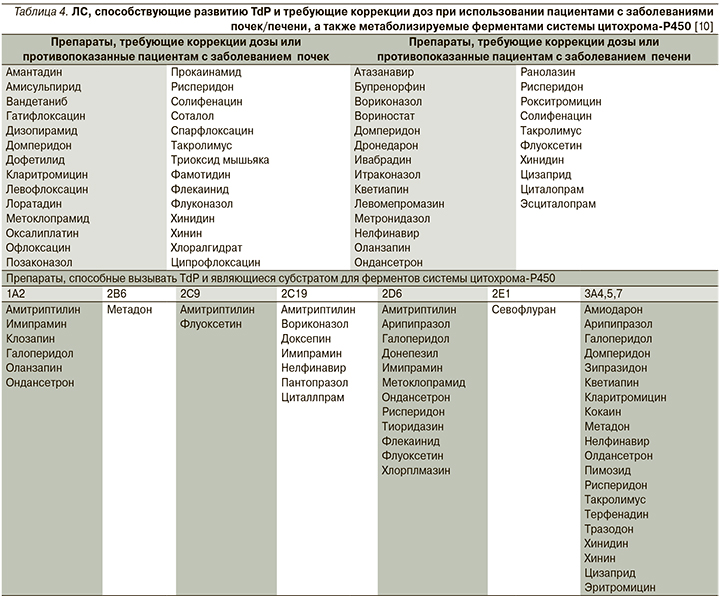
Считается, что использование комбинаций препаратов, пролонгирующих интервал QT, может увеличить риск развития TdP, хотя результаты исследований, посвященных данному вопросу, весьма противоречивы [39–42]. Известно, что одновременное применение нескольких препаратов, продлевающих интервал QТ, является относительно распространенным явлением. Так, ретроспективное когортное исследование L.H. Curtis et al. [39] показало, что из 1,1 млн пациентов с выписанным рецептом на QT-пролонгирующий препарат 9,4% получили рецепт на второй препарат, также продлевающий интервал QT или ухудшающий метаболизм QT-удлиняющего ЛС. А в исследовании K.Y. Tay et al. [40] обнаружено, что 15% рецептов, выписанных в отделении неотложной помощи, включили ЛС, удлиняющие интервал QTс, при этом около 10% из них включили ≥2 препаратов, увеличивающих продолжительность интервала QTс.
J.E. Tisdale et al. [29], проанализировав данные пациентов отделений интенсивной терапии, получавших ≥2 ЛС, удлиняющих интервал QTc, установили, что ОШ развития TdP у таких пациентов по сравнению с лицами, не получавшими терапии QT-удлиняющим ЛС, было равно 2,6 (95% ДИ – 1,9–5,6; р=0,02). Однако данных, свидетельствующих о том, что использование комбинации препаратов, удлиняющих интервал QTс или увеличивающих риск развития TdP, сопровождалось более высоким риском развития удлинения QTс/TdP по сравнению с монотерапией, получить не удалось [10]. В обзоре литературы [41] было показано, что назначение нескольких препаратов антипсихотического спектра не сопровождалось удлинением интервала QTc. В популяционном когортном исследовании M.N. Niemeijer et al. [42], в котором участвовали 13 тыс. пациентов, обнаружено, что добавление к первоначальной терапии второго или третьего препарата, продлевающего интервал QTc, оказало очень небольшое дополнительное удлиняющее влияние на него.
Опубликованные в литературе данные свидетельствуют о том, что у части пациентов с лекарственно-индуцированной TdP имелась генетическая предрасположенность [43, 44]. К настоящему времени выявлено 15 специфических генетических дефектов, лежащих в основе синдрома врожденного удлинения интервала QT [43]. Мутации генов, которые предрасполагают к развитию врожденного синдрома удлинения интервала QT, были обнаружены у 10–15% пациентов, перенесших TdP, индуцированную ЛС [44].
Профилактика лекарственно-обусловленных TdР
Риск развития лекарственно-обусловленной TdP может быть предупрежден путем выявления и минимизации влияния факторов риска, ассоциированных с развитием TdP [45]. При этом необходимо [10]:
- осуществлять коррекцию доз QT-удлиняющих препаратов, метаболизируемых почками/печенью у пациентов с заболеванием почек/печени;
- избегать одновременного назначения нескольких QT-удлиняющих ЛС;
- избегать одновременного назначения QT-удлиняющих препаратов с ЛС, замедляющими их метаболизм путем ингибирования ферментов системы цитохрома-Р450;
- избегать назначения QT-удлиняю-щих препаратов пациентам с врожденным синдромом удлинения интервала QT;
- избегать назначения QT-удлиняю-щих препаратов пациентам с TdP в анамнезе;
- избегать назначения QT-удлиняю-щих препаратов пациентам с исходной продолжительностью интервала QT >450 мс;
- отменить QT-удлиняющий препарат, если у пациента интервал QTc увеличился до величины >500 мс;
- мониторировать и поддерживать концентрацию кальция в сыворотке крови в пределах нормы;
- мониторировать и поддерживать сывороточную концентрацию магния ≥2 мг/дл;
- мониторировать и поддерживать сывороточную концентрацию калия ≥4 мг-экв/л;
- уменьшать дозу или прекращать использование QT-удлиняющего препарата при увеличении QTc > 60 мс от исходного значения;
- по возможности избегать использования QT-удлиняющих препаратов лицам с СН со сниженной ФВ, особенно пациентам с ФВ <20%.
Перед началом терапии препаратом, способствующим развитию TdP, пациенту следует выполнять ЭКГ в 12 отведениях с изучением продолжительности интервала QTc с последующим мониторированием ЭКГ, не допуская увеличения продолжительности интервала ≥500 мс [46]. Госпитализированным пациентам, получавшим препараты, способствующие развитию TdP, продолжительность интервала QTc следует контролировать ежедневно [46]. Пациентам, получавшим длительную пероральную терапию препаратами, способствующими развитию TdP, ЭКГ выполняется регулярно в сроки от 3 до 6 месяцев в зависимости от наличия или отсутствия других факторов риска [46].
Важную профилактическую роль играет осведомленность пациента, принимающего ЛС, способствующие развитию TdP, о таком их возможном побочном эффекте, как увеличение ЧСС, и необходимости получения консультации врача в случае увеличения ЧСС до 100–120 в минуту или появления эпизодов головокружения, беспокойства, усталости, слабости, одышки, боли в груди [10]. Пациентов, принимающих ЛС, способных вызывать TdP, следует предупреждать об опасности использования препаратов, отпускаемых без рецепта, без предварительной консультации с врачом.
Лечение лекарственно-обусловленных TdР
В случае развития TdР терапия препаратами, способствующими ее развитию, должна быть прекращена [47]. Гипокалиемия, гипомагниемия или гипокальциемия должны быть скорректированы с помощью внутривенного введения калия, магния или кальция соответственно. Гемодинамически нестабильным пациентам с TdP показана электроимпульсная терапия [47]. Пациентам с TdP и стабильной гемодинамикой показано внутривенное введение сульфата магния [10]. Для купирования TdP, развившейся на фоне брадикардии, эффективна временная кардиостимуляция, внутривенное введение изопреналина также может купировать TdP, увеличивая частоту сердечных сокращений и сокращая интервал QT [10].
Заключение
Развитие TdP представляет серьезную опасность для жизни пациентов, ассоциируясь с повышенным риском развития ВСС. Большинство из известных в настоящее время фармакологических групп имеет представителей, обладающих способностью вызывать TdP. Именно из-за TdP-индуцирующего эффекта и развития ВСС использование некоторых из них было ограничено и даже запрещено (терфенадин, астемизол, грепафлоксацин и др.), в отношении других исследования продолжаются. Огромное значение в увеличении риска развития полиморфной желудочковой тахикардии у лиц, принимающих препараты, обладающие TdP-индуцирующим эффектом, играет наличие факторов риска TdP, что необходимо учитывать, назначая подобные ЛС. Большинство из факторов риска поддаются коррекции и должны быть скорректированы, что имеет важнейшее профилактическое значение, способствуя предотвращению развития TdP. Кроме того, своевременное информирование пациентов, направленное на формирование настороженности относительно возможности развития, особенностей проявления и способов предотвращения развития лекарственно-индуцированных TdP, имеет не меньшее профилактическое значение, требует соответствующих знаний и настороженности от практикующих врачей.



