Актуальность
Хроническая болезнь почек (ХБП) входит в число десяти ведущих причин снижения качества и продолжительности жизни населения планеты [1, 2]. Современные подходы к адекватной компенсации утраченной функции почек пациентов с терминальной почечной недостаточностью (ТПН) чаще всего связаны с применением методов аппаратной экстракорпоральной мембранной детоксикации. Большинство пациентов с ТПН получают заместительную почечную терапию (ЗПТ) путем гемодиализа (ГД) и его модификаций [3]. При этом выбор оптимального метода ЗПТ требует учета факторов, связанных с характером не только течения основного заболевания, которое привело к развитию ХБП, но и социально-бытовых и фармако-экономических аспектов, индивидуальных предпочтений пациента, его комплаентности, наличия коморбидной патологии, доступности того или иного метода ЗПТ и некоторых других [4].
По данным Международного регистра ХБП, показатели смертности пациентов, получающих ЗПТ путем ГД, в течение последнего десятилетия снижаются [5, 6]. Тем не менее смертность в этой группе пациентов в 10 раз выше, чем в общей популяции [7]. Среди факторов риска (ФР), ответственных за более высокую смертность больных этой категории, наиболее прогностически неблагоприятными являются пожилой возраст, использование центральных венозных катетеров в качестве постоянного сосудистого доступа, гипоальбуминемия, гиперфосфатемия, онкологическая патология и хроническая сердечная недостаточность [8]. Существующие клинические рекомендации и экспертные мнения в качестве меры, способной влиять на прогноз пациентов с ТПН, чаще всего предлагают увеличение времени процедуры ГД [9].
В 19-месячном исследовании A.P. Sharma et al. выявили, что додиализный уровень сывороточного альбумина у пациентов, получающих лечение ГД, является лучшим прогностическим ФР смертности, чем уровень альбумина на старте диализной терапии [10]. Кроме того, степень снижения уровня альбумина коррелировала с 5-летним риском смерти пациентов, получавших ЗПТ. Важно отметить, что уровень сывороточного альбумина является ключевым показателем оценки характера и адекватности питания пациента с ТПН [11–16].
Гипоальбуминемия у пациентов, получавших ГД, в течение 6 месяцев была связана с повышением смертности от сердечно-сосудистых заболеваний (ССЗ) [15]. У пациентов с ТПН гипоальбуминемия ассоциирована с более низкими значениями уровня гемоглобина и показателем эффективности ЗПТ, чем у пациентов с нормальным или повышенным уровнем сывороточного альбумина [17]. Стоит отметить, что причинами развития гипоальбуминемии в этой группе больных оказались неадекватный ГД [18], перегрузка жидкостью, воспалительные и инфекционные заболевания [19, 20], сопутствующая патология [21] и дизгевзия [22]. Вместе с тем низкий нутритивный статус пациентов, получающих ГД-терапию, представляется многофакторным процессом, связанным с накоплением уремических токсинов, системным воспалительным процессом, оксидативным стрессом, психическими расстройствами, потерей глюкозы, аминокислот и других необходимых веществ в течение процедуры ГД [72].
В то же время хроническая потеря альбумина во время процедур ГД или его модификаций является ФР, ассоциированный с повышенной заболеваемостью и смертностью у пациентов, получающих ЗПТ [23].
По данным корейских исследователей, у пациентов, получающих ЗПТ путем ГД, уровни сывороточного альбумина, С-реактивного белка (СРБ) и число лейкоцитов периферической крови (WBC) служат независимыми ФР, ассоциированными с повышением общей смертности, в т.ч. от ССЗ и инфекционных осложнений. В своей работе исследователи выявили тенденцию увеличения смертности пациентов, получающих ГД, при включении значения уровня сывороточного альбумина в качестве потенцирующего ФР в уравнение прогнозирования исходов ЗПТ при любой комбинации обсуждаемых ФР. Так, сочетание альбумина с СРБ, или СРБ и WBC, или с СРБ, WBC и ферритином достоверно ухудшает прогноз ТПН, увеличивает риск развития ССЗ и частоту осложнений ГД-терапии. При этом каждый из рассматриваемых ФР может выступать в роли самостоятельного неблагоприятного предиктора формирования сердечно-сосудистой патологии или инфекционного процесса. Вместе с тем сочетание обозначенных факторов с учетом уровня сывороточного альбумина повышает информативность и прогностическую ценность модели оценки общей смертности пациентов, получающих ГД [24].
Таким образом, уровень сывороточного альбумина является самостоятельным ФР, ассоциированным не только с качеством жизни, но и с риском ранней смерти пациентов, получающих ЗПТ путем ГД от ССЗ и инфекционной патологии, а также со смертностью пациентов от любых причин. В свою очередь снижение качества ГД-помощи напрямую связано с развитием гипоальбуминемии и снижением уровня гемоглобина крови у пациентов с ТПН, что также увеличивает смертность среди больных этой категории.
Показателен тот факт, что одной из причин снижения эффективности ЗПТ путем ГД или перитонеального диализа (ПД) наряду с такими ФР, как снижение уровня гемоглобина крови, гипо- и гиперфосфатемия, повышение активности эндотелиального фактора роста, выступает гипоальбуминемия [25–32]. Рядом ученых было установлено, что повышенная экскреция альбумина при ПД влияла на увеличение частоты развития и прогрессирования ССЗ, что в свою очередь приводило к снижению эффективности лечения [33–35].
Концепция развития современных мембран гемодиализатора
Основным направлением научно-технической стратегии улучшения эффективности диализной помощи является обеспечение высокой проницаемости и биосовместимости (БС) мембраны гемодиализатора (ГМД). Существующие классификации ГМД строятся на их химическом строении, удельной проницаемости для веществ различной молекулярной массы (производительность), коэффициентах ультрафильтрации (УФ) и массопереноса, а также практическом применении в зависимости от модификации диализной помощи.
Обычно ГМД по удельной производительности делятся на два типа: низкопоточные (LF) и высокопоточные (HF).
В рекомендациях Рабочей группы Японского общества диализной терапии (JSDT, 2015) LF ГМД характеризуются скоростью УФ менее 15 мл/мм рт.ст/ч и скоростью элиминации β2-микроглобулина (β2М) менее 15 мл/мин, в свою очередь HF ГМД – скоростью УФ более 15 мл/мм рт.ст/ч и скоростью элиминации β2М более 15 мл/мин [36, 37].
В Японии до 2016 г. все ГМД классифицировались на 5 типов, согласно скорости элиминации β2M: I тип <10 мл/мин; II тип <30 мл/мин; III тип <50 мл/мин; IV тип <70 мл/мин и V тип >70 мл/мин. Эти параметры были рассчитаны для объемной скорости кровотока 200 мл/мин и объемной скорости потока диализата 500 мл/мин. Диализаторы I типа классифицировались как LF, а со II по V типы – как HF. Основная цель HF ГМД заключается в надежной элиминации уремических токсинов с молекулярной массой 10–30 кДа [38].
В связи с этим концепция выбора ГМД включает следующие принципы: высокую гидравлическую проницаемость (производительность), высокую проницаемость мембраны для растворенных веществ с молекулярной массой 15–45 кДа («средние» молекулы, например β2М) и высокую БС.
Руководящие принципы Национального почечного фонда (NKF) не рекомендуют к использованию ГМД с низкой БС [39]. Европейские рекомендации по оптимальной практике (EBPG) рекомендуют использовать HF ГМД, которые характеризуются высокой пористостью и увеличенным размером пор на единицу площади, высокой БС, т.к. эти параметры достоверно связаны с улучшением прогноза по заболеваемости и смертности пациентов, получающих ГД-терапию [40, 41].
Технологический прогресс и развитие области мембранных технологий для обеспечения эффективности ЗПТ привели к тому, что новые поколения ГМД не удовлетворяют критериям рассмотренных выше классификаций. Кроме того, увеличение производительности ГМД, появление новых полимерных материалов с уникальными свойствами, углубление научных знаний о механизмах развития ТПН, а также осложнений ЗПТ значительно расширили возможности оказания диализной помощи. И сегодня в условиях современных потребностей клиницистам необходимо индивидуализировать подход к выбору оптимальной стратегии долгосрочной диализной терапии. А мембрана ГМД должна обладать высоким профилем эффективности и безопасности при проведении ГД-терапии.
Ряд авторов предлагает новые критерии классификации ГМД, включающие такие параметры, как коэффициент УФ (КУФ); клиренс (Кл) и коэффициент просеивания (КП) для β2M; интрадиализная потеря альбумина (ИДПА) и КП для альбумина. Этот подход позволяет выделить пять типов МГД: LF, HF, мембрану со «средней» отсечкой (MCO), мембраны с «высокой» отсечкой (HCO) и «протеиновые» мембраны (Pl) (табл. 1) [42–46].
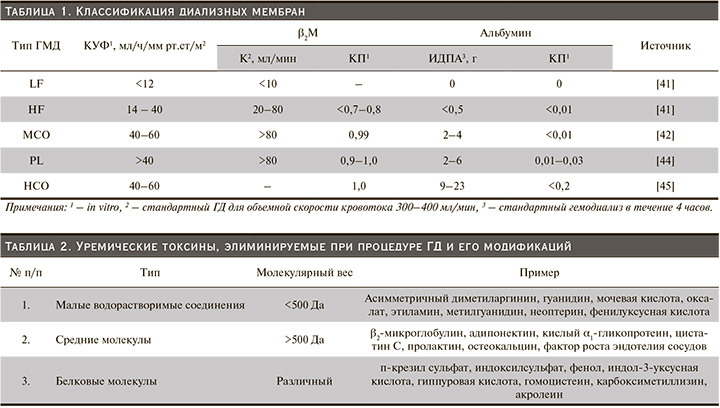
Современные технологические возможности производства высокоэффективных ГМД, модификация программ лечения и выбор соответствующей мембраны привели к более широкому применению HF ГМД, в частности ГМД с КП для молекул массой 10–20 кДа [47].
HCO ГМД с размером пор от 8 до 10 нм имеют достоверно более высокий клиренс для высокомолекулярных веществ [48]. Однако использование HCO ГМД приводит к значительной потере альбумина. Важно отметить, что существует более 20 «средних» молекул, удаление которых не соответствует критериям эффективной диализной помощи. Эти «средние» молекулы являются потенциальным триггером хронического воспаления, сердечно-сосудистых осложнений, вторичного иммунодефицита у пациентов, получающих ГД-терапию (табл. 2) [49, 50].
Панель соединений, объединенных понятием «средняя молекула», имеет широкие референтные значения молекулярной массы, которая варьируется в пределах от 0,5 до 65 кДа и больше. В своей работе A.H. Kirsch et al. классифицировали вещества, относящиеся к категории «средняя молекула», согласно их молекулярной массе, применив в качестве определения значений «обычная "средняя" молекула», например β2М, и «большие "средние" молекулы», включающие миоглобин, легкие цепи иммуноглобулинов типа κ и λ, фактор-D-комплемента, альфа1-микроглобулин и хрящевой гликопротеин YKL-40. В данной классификации альбумин с его молекулярной массой 67 кДа не относится к элиминируемым веществам и не удаляется во время процедуры ГД [43]. Поколение ГМД типа MCO продемонстрировало эффективное удаление веществ с молекулярной массой до 45кДа по сравнению с HF ГМД [51].
Адсорбционные свойства ГМД зависят от структуры, химического строения и гидрофобных свойств мембраны. Как правило, белки, адсорбированные на поверхности мембраны, повреждены и некоторые из них могут активировать иммунные реакции, коагуляцию и в конечном итоге – развитие каскада реакций бионесовместимости.
С другой стороны, адсорбция белка на мембране может быть полезной для удаления некоторых видов белок-связанных уремических токсинов.
Классификация ГМД по химическому строению материала включает мембраны из полиарилэфирсульфона (PAES), поливинилпирролидона (PVP), полиамида (PA), полиакрилонитрила (PAN), полисульфона (PS), полиэфирсульфона (PES), триацетатцеллюлозы (CTA), полифенилена (PF), сополимера этиленвинилового спирта (EVAL), полиметилметакрилата (PMMA), полиэфирного полимерного сплава (PEPA) и др. По архитектуре полимера включает трехслойные, гелевые и губчатые мембраны.
Недавно проведенный протеомный анализ белков, адсорбированных на ГМД, показал, что профили их различаются в зависимости от химического строения и архитектуры ГМД [52, 53]. Так, на мембранах на основе CTA была обнаружена более высокая адсорбция альбумина и аполипопротеина. На мембранах, произведенных с использованием PS, отмечена более высокая адсорбция фибриногена и других белков коагуляционного каскада [54]. Группа экспертов Инициативы по качеству для улучшения исходов заболеваний почек KDOQI не рекомендует к использованию целлюлозные мембраны вследствие их бионесовместимости, способности активировать каскад иммунных реакций и систему С3-комплемента. Вместе с тем A.M. MacLeod et al. в проведенном мета-анализе не смогли убедительно продемонстрировать превосходство синтетических полимерных мембран перед мембранами на основе CTA [55].
Гидрофобные ГМД, а именно PAN, PMMA, PS и PA, адсорбируют больше белков, чем CTA. Сообщалось, что PAN и PMMA связаны с улучшением клинических исходов при остром почечном повреждении именно благодаря повышенной адсорбции белков на своей поверхности и таким образом дополнительной адсорбции связанных с белками низко- и среднемолекулярных токсинов [56]. Благодаря адсорбции β2M применение этих мембран снижает частоту осложнений и выраженность проявлений β2-амилоидоза у больных, получающих постоянную ГД и ГДФ-терапию [57, 58]. Есть сообщения, что применение PMMA ГМД ассоциировано со снижением концентрации циркулирующего гомоцистеина в плазме перед процедурой ГД [59], легких цепей иммуноглобулинов типа κ и λ [60, 61] и белков острой фазы воспаления [62]. В своем исследовании M. Abe et al. сообщили, что PMMA имеет положительную связь с выживаемостью пациентов [63]. В работе T. Niwa et al. имеются данные, что при использовании PL ГМД эффективно удаляется альбумин-связанная фуранкарбоновая кислота [64].
Потери альбумина при использовании современных гемодиализных мембран
Потенциальная опасность белок-ассоциированных уремических комплексов, связанная с увеличением заболеваемости и смертности пациентов с ТПН, привела к более широкому применению высокопроницаемых ГМД [65–69]. Потеря белков крови во время ГД происходит не только путем диффузии и/или конвекции в диализат, но и посредством их адсорбции на поверхности ГМД. В момент контакта крови с поверхностью мембраны адсорбция белков плазмы происходит практически сразу, что обусловлено рядом факторов и зависит от характеристик мембраны, включая такие, как шероховатость, гидрофобность, химический состав и заряд мембраны [70]. Стоит отметить, что некоторые вредные белковые соединения могут быть удалены с помощью высокоадсорбирующих мембран [71]. Однако наряду с эффективным удалением уремических токсинов средней и большой молекулярной массы происходит и потеря связанных с ними белков, в частности альбумина, трансферрина и белка, связывающего витамин D3. Адсорбция белков на поверхности мембраны не является селективным процессом, который зависит от физико-химических свойств самой мембраны и молекулярной массы белковых фракций. Важно отметить, что адсорбция белков на поверхности, т.е. гелевая поляризация мембраны, способна снижать клиренс ГМД и значительно ухудшать эффективность ЗПТ [73–75].
I. Ishikawa et al. оценивали качественный и количественный состав белков и пептидов в сыворотке, диализате и десорбированной жидкости PS и PMMA мембран ГМД. Было выявлено значительное снижение уровня β2М в сыворотке крови после процедуры при применении обоих типов ГМД. В диализате при применении PMMA ГМД содержание β2М оказалось незначительным. Однако в десорбированной жидкости ГМД содержание β2М оказалось высоким, что свидетельствовало о высокой адсорбции данного типа ГМД. Это исследование продемонстрировало, что относительное участие механизмов, вовлеченных в удаление растворенного вещества во время ГД (фильтрация, адсорбция), может варьироваться в зависимости от физико-химических свойств самой ГМД [76]. В 2013 г. JSDT включили SCА и адсорбционные свойства ГМД в классификацию ГМД в качестве дополнительных критериев [77].
Белки плазмы, адсорбированные на поверхности ГМД, активируют каскады биологических реакций в организме пациента во время процедуры ГД. В связи с этим адсорбционные свойства ГМД определяют не только эффективность ЗПТ и оказывают влияние на прогноз пациента, но и создают потребность в поиске новых перспективных материалов повышенной БС [53]. Примечательно, что, по данным T. Kaiser et al., белки и пептиды были обнаружены в диализате только при использовании HF ГМД [78]. В то время как в другом исследовании H. Dihazi et al. высокомолекулярных белков в диализате при применении LF ГМД обнаружено не было [79].
Тем не менее единого мнения о вреде или пользе адсорбции белка на поверхности мембраны и/или его элиминации в диализат на сегодняшний день нет. Применение HF ГМД пациентами с ТПН было ассоциировано с лучшим прогнозом выживаемости, вероятно, ввиду лучшей адсорбции на ней белков, связанных с уремией [80]. Сопоставимость разных HF ГМД весьма условна, т.к. свойства, демонстрируемые ими, могут различаться. Так, в исследовании A. Ficheux et al., сравнивавшем PS HF ГМД трех компаний, выявлены различия в удалениях белков разной молекулярной массы, особенно в диапазонах 20–22,5, 23–30 и 60–80 кДа [81].
Таким образом, потеря белков во время процедуры ГД является неселективным процессом и характерна для всех типов мембран, кроме LF ГМД. Механизмы потери включают адсорбцию на мембране, конвективный перенос в диализат через всю толщину стенки капилляра ГМД. Величина потерь белков и белок-ассоциированных комплексов зависит от физико-химических свойств мембраны, ее пористости, в т.ч. размеров пор, и удельной производительности ГМД.
Результаты исследований, посвященных потере альбумина при ГД-терапии, противоречивы. Так, ряд авторов утверждают, что выбор ЗПТ в виде ГДФ вместо HF ГД приводит к снижению уровня сывороточного альбумина [81–83]. В работе E. Movilli et al. установили, что ГДФ вызывает длительное и значительное снижение преддиализного уровня β2M, а также концентраций белок-связанных уремических токсинов, однако не оказывает значительного влияния на уровень сывороточного альбумина [85]. E. Vilar et al. обнаружили, что уровень сывороточного альбумина после 5 лет ГД-терапии не отличался в группах больных, получавших ЗПТ методом HF ГД, от ЗПТ методом ГДФ [86]. Однако эти исследования не принимали во внимание возраст пациентов. C.H. Weng et al. показали, что ГДФ была в значительной степени связана с высокой частотой выявления гипоальбуминемии у пациентов среднего возраста (54,44±5,48 года). В других возрастных группах никакой существенной ассоциации отмечено не было. Кроме того, уровень альбумина, ассоциированный с ГДФ, в основном находился в диапазоне от 3,6 до 4,0 г/дл (4,08±3,14 г/дл). В связи с этим авторами был сделан вывод, cогласно которому при прогнозировании последствий применения ГДФ и риска развития гипоальбуминемии необходимо учитывать и возраст больных [87].
P. Bolasco et al. установили, что длительность ГДФ коррелирует со значением spKt/V и конвекционным объемом [88]. По данным C.H. Weng et al., в группе пациентов среднего возраста с ТПН, получавших ГДФ, обнаружена сильная корреляционная связь между значением spKt/V и уровнем сывороточного альбумина менее 4 г/дл. Обнаружено, что конвекционный объем при ГДФ был отрицательно связан с уровнем сывороточного альбумина [84, 87, 89, 90].
Таким образом, более низкий уровень сывороточного альбумина у пациентов 45–64 лет связан с более высокими значениями spKt/V и высоким конвекционным объемом: не менее 20 л/процедура.
По мнению экспертов JSDT, определенная потеря альбумина во время аппаратной ЗПТ является допустимой. В обзоре, представленном P. Susantitaphong et al., показано, что характер питания и выживаемость пациентов, получавших конвективные методы ЗПТ, были лучше, однако уровень сывороточного альбумина был ниже, чем в группе пациентов, получающих LF ГД-терапию [91]. K. Sakurai сообщил, что более агрессивное удаление белок-связанных уремических токсинов с потерей сывороточного альбумина в количестве 3–5 г/процедура улучшает течение тяжелого синдрома беспокойных ног у пациентов с ТПН [92]. K. Tsuchida et al. сходятся во мнении, что удаление крупных белок-связанных уремических токсинов не должно сопровождаться потерей сывороточного альбумина более чем 10 г/процедура [93]. Вместе с тем K. Nagai et al. сообщили, что пациенты, получавшие ГД-терапию, с потерей сывороточного альбумина более 3 г/процедура имели лучшие показатели выживаемости, чем те, у кого потеря альбумина была менее 3 г/процедура [94]. Кроме того, они сообщили, что применение PL ГМД ассоциировалось с лучшим поддержанием уровня сывороточного альбумина [95].
Однако проблема потери альбумина определяется множеством факторов, при которых развитие гипоальбуминемии и нарушение обмена липопротеидов могут ухудшать долгосрочные эффекты проводимой ГД-терапии, качество жизни пациента и прогноз заболевания. Модальность и тип ГД-терапии определяется физико-химическими свойствами ГМД, конвекционным объемом, возрастом пациента, качеством питания и множеством других факторов. Можно предсказать потерю альбумина, основываясь на зависимости между скоростью удаления α1-микроглобулина при разной модальности ГД-терапии [96]. В результате сравнения HF и LF ГМД в рандомизированном контролируемом исследовании F. Locatelli et al. выявлено, что у пациентов с ТПН (по причине диабетической нефропатии), уровнем сывороточного альбумина менее 4,0 г/дл и с использованием HF ГМД прогноз выживаемости был лучше [97].
Обсуждение
Современные подходы к ГД-терапии и ее модификациям строятся с учетом ряда факторов, среди которых клинические проявления основного заболевания, наличие коморбидной патологии, а также социально-экономические условия, индивидуальные предпочтения пациента, его комплаентность, расово-этнические особенности, культурные и поведенческие аспекты. При относительном однообразии программ лечения пациента с ТПН перед клиницистом остро стоит проблема подбора оптимального диализатора, отсутствия единой концепции в выборе не только параметров самой процедуры ГД, но ее модификации, типа ГМД, отвечающим требованиям БС, безопасности и эффективности, а также персонифицированного подхода к ведению конкретного пациента.
Потеря альбумина во время процедуры ГД является важной клинической проблемой, а ее значение и масштабы, по всей видимости, недооценены. Интересен тот факт, что в 2013 г. эксперты JSDT включили SCА и адсорбционные свойства ГМД для белков в качестве дополнительных критериев в классификации мембран [77]. Повышенная адсорбция и элиминация белков, связанных с уремией при применении HF ГМД, были ассоциированы с лучшим прогнозом для жизни пациента [80].
В сравнительном исследовании A. Ficheux et al. выявлены внутригрупповые особенности нескольких PS HF мембран ГМД, в частности, в аспекте удаления белков разной молекулярной массы, особенно в диапазонах 20–22,5, 23–30 и 60–80 кДа [81]. Ряд исследователей утверждают, что при изменении модификации ЗПТ, заключающейся в переходе от HF ГД к ГДФ, наблюдается снижение уровня сывороточного альбумина [83–85]. E. Movilli et al. установили, что ГДФ вызывает длительное и значительное снижение преддиализного уровня β2M, а также концентраций белок-связанных уремических токсинов, однако значительных изменений уровня сывороточного альбумина не наблюдалось [85]. E. Vilar et al. обнаружили, что уровень сывороточного альбумина после 5 лет ГД-терапии не различался в группах больных, получавших ЗПТ методами HF ГД или ГДФ [86]. Однако в этих исследованиях не учитывался возраст пациентов. Вместе с тем с повышением возраста пациента наблюдается снижение интенсивности основного и энергетического обменов, снижение белково-синтетической функции печени, нарушение процессов переваривания и всасывания в желудочно-кишечном тракте, преобладание катаболических процессов над синтезом белка. P. Bolasco et al. продемонстрировали, что длительность ГДФ коррелирует со значением spKt/V и конвекционным объемом [88]. Было установлено, что конвекционный объем при ГДФ отрицательно связан с уровнем сывороточного альбумина [84, 89, 90]. Несмотря на обновление клинических рекомендаций в части повышения эффективности процедур ГД, вопрос потери альбумина при применении высоко-конвекционных методов ЗПТ недостаточно изучен.
В случае сохранения или незначительного снижения основного обмена, а также нормального (достаточного) режима питания пациента, высококонвекционные методы ЗПТ (например, ГДФ) имеют преимущество перед низкообъемными в плане долгосрочных перспектив выживаемости пациентов. Так, K. Nagai et al. сообщили, что пациенты, у которых была потеря сывороточного альбумина более 3 г/процедура ГД, имели лучшие показатели выживаемости, чем те, у которых потеря альбумина составляла менее 3 г [94]. Сравнение HF и LF ГМД в рандомизированном контролируемом исследовании F. Locatelli et al. продемонстрировало лучший прогноз выживаемости пациентов с ТПН и уровнем сывороточного альбумина менее 4,0 г/дл при использовании HF ГМД [97]. Вместе с тем в этих исследованиях не проводилась рандомизация по возрасту, не оценивались белково-синтетическая функция печени, показатели основного и энергетического обменов, активность катаболизма и суточный прирост мочевины, ассоциированный с режимом и качеством питания пациентов, что представляет исследовательский интерес.
Физические и химические свойства ГМД и их влияние на адсорбцию и/или элиминацию альбумина при ГД-терапии нередко остаются за пределами внимания клинициста. Адсорбция белков на поверхности мембраны не является селективным процессом и зависит от физико-химических свойств самой мембраны, а также молекулярной массы белковых фракций. Неселективность процесса адсорбции белков на ГМД позволяет предположить, что данное явление характерно для всех имеющихся типов мембран. Недавно проведенные протеомные исследования адсорбированных на ГМД белков показали, что профили их различаются в зависимости от химического строения и архитектуры мембраны [52, 53]. Стоит отметить, что профиль белковых фракций, адсорбированных на мембране, может не только иметь значение для оценки потери альбумина, но и служить дополнительным фактором при диагностике системных патологических процессов, сопровождающихся нарушениями белкового обмена, при аутоиммунных заболеваниях, онкогематологической патологии, демиелинизирующих дегенеративных заболеваниях центральной нервной системы и др. Важно отметить, что адсорбция белков на поверхности, т.е. гелевая поляризация мембраны, способна снижать клиренс ГМД и значительно ухудшать эффективность процедур ЗПТ [73–75], что в долгосрочной перспективе приводит к гипоальбуминемии. В момент контакта крови с поверхностью мембраны адсорбция белков плазмы происходит практически сразу, что обусловлено рядом факторов и зависит от характеристик мембраны, включая такие, как шероховатость, гидрофобность, химический состав и заряд мембраны, а вместе с эффективным удалением уремических токсинов средней и большой молекулярной массы наблюдается потеря таких белков, как альбумин, трансферрин и белок, связывающий витамин D3 [70].
Заключение
Потеря альбумина при ЗПТ, включая перитонеальный диализ, является прогностически неблагоприятным модифицируемым ФР, влияющим на продолжительность жизни пациента с ТПН, получающего лечение программным ГД. Самостоятельное снижение уровня сывороточного альбумина является прогностически неблагоприятным фактором риска развития и прогрессирования сердечно-сосудистой патологии, в т.ч. хронической сердечной недостаточности и инфекционных осложнений у пациентов, получающих ГД-терапию. В то же время гипоальбуминемия наряду с повышением уровня СРБ, WBC или ферритина дополнительно повышают обозначенные риски и неблагоприятно влияют на выживаемость пациентов, получающих ГД-терапию в любой модификации. Подбор диализатора для проведения ГД-терапии определяется физико-химическими свойствами ГМД, уровнем сывороточного альбумина и скоростью катаболизма, возрастом пациента и наличием сопутствующей и/или коморбидной патологии и имеет важное прогностическое значение. Механизм потери альбумина при ГД-терапии обусловлен не только элиминацией и выделением альбумина в диализат, что наиболее характерно для высококонвекционных методов ЗПТ, но и неселективной адсорбцией белковых фракций на ГМД, характерной для всех типов мембран. Применение МСО ГМД и выбор в качестве способа ГД-терапии высокообъемного гемодиализа наиболее перспективны для лиц в возрасте 45–64 лет с преобладанием процессов катаболизма белков, снижением белково-синтетической функции печени и нарушениями питательного статуса. Кроме того, применение МСО ГМД, вероятно, предпочтительнее для пациентов с остаточной функцией почек и протеинурией. Выбор модальности ГД-терапии определяется не только анамнестическими и конституциональными особенностями пациента с ТПН, но и показателями белкового обмена, основным и энергетическим обменами, соотношением катаболизма/анаболизма белков, функциональным состоянием желудочно-кишечного тракта, печени, питательным статусом пациента и его рационом питания.



