Врач-дерматолог ежедневно сталкивается с проблемой диагностики и лечения новообразований кожи. Согласно отечественным публикациям, новообразования кожного покрова занимают до 24,9% в структуре первичной обращаемости к дерматологу [1]. Сведения о преобладающих нозологиях в условиях дерматоонкологического приема разнятся и, возможно, объясняются спецификой работы того или иного учреждения. Так, по мнению О.Г. Капустиной, наиболее часто (61,7%) встречаются опухоли эпителиального происхождения [1]. Наши данные о сплошной обращаемости на дерматоскопический осмотр [2] и обращаемости в рамках скрининговых кампаний по диагностике рака кожи [3, 4] свидетельствуют о преобладании в структуре обращаемости опухолей меланоцитарного происхождения – от 67,5 до 75%. Аналогичные результаты были получены С.В. Ключаревой – доля меланоцитарных образований составила 68,7% в структуре обращаемости в университетскую клинику за период с 2014 по 2016 г. [5].
Наибольший интерес среди меланоцитарных образований представляет меланома кожи (МК), ведь своевременная диагностика и лечение этой злокачественной опухоли на раннем этапе развития сопровождается хорошим долгосрочным прогнозом и не снижает качества жизни больных. Несмотря на успехи, достигнутые в идентификации групп риска по развитию меланомы, остается много проблем с выбором наилучшей стратегии скрининга населения – даже с акцентом на группы риска. При этом именно профилактический осмотр с выявлением МК на ранней стадии служит основным фактором, определяющим благоприятный прогноз при этом заболевании [6].
Профилактический осмотр может выполняться как самим пациентом или его родственниками, так и врачом (дерматологом, семейным врачом и другими специалистами). Практика самостоятельных осмотров развита недостаточно даже в группах риска, однако способствует т.н. активному выявлению меланомы [7, 8]. В исследовании M. Xavier и соавт. 68,7% всех случаев МК были выявлены непосредственно пациентами или членами их семей, при этом 11,1% пациентов ждали от 6 до 12 месяцев, 25,2% – более года, прежде чем обратиться к специалисту. Напротив, случайное обнаружение меланомы специалистом обычно не сопровождалось отсрочкой в постановке диагноза [9].
Ранее мы показали, что сегодня МК встречается на приеме у дерматолога в 4,5–6,6% случаев у лиц, обратившихся для осмотра новообразований кожи [2–4]. Разнообразие клинических форм МК, отсутствие диагностических критериев ранней стадии развития заболевания, сложности при проведении дифференциальной диагностики с другими опухолями кожи обусловливают ошибки в диагностике меланомы и отрицательно сказываются на выживаемости больных. С другой стороны, гипердиагностика рака кожи, в т.ч. МК, может достигать 75% по результатам повторных консультаций пациентов, направленных к онкологу после проведения скрининговых осмотров [10]. Существенную помощь в правильной оценке новообразований кожи оказывают различные неинвазивные методы осмотра, из которых наиболее доступна дерматоскопия (эпилюминесцентная микроскопия), ныне входящая в стандарт оснащения дерматологических кабинетов и отделений [11, 12]. С целью определения клинико-эпидемиологических характеристик МК в условиях современного дерматологического приема нами проведен ретроспективный анализ случаев МК из личной практики.
Под нашим наблюдением в 2015–2017 гг. находились 36 пациентов, которым по результатам осмотра был поставлен диагноз меланомы кожи. Во время приема проведены полный осмотр кожных покровов, видеодерматоскопия, а также фотодокументирование клинической и дерматоскопической картины подозрительных образований. В соответствии с «Порядком оказания помощи населению при онкологических заболеваниях» [13] все пациенты были направлены в онкологическое отделение по месту жительства для проведения лечения. Были получены результаты гистологического исследования удаленных образований. В случае расхождения клинического и морфологического диагнозов проведен пересмотр гистологических препаратов.
Средний возраст пациентов на момент обращения составил 49,6±16,2 года. Опухоль в 2 раза чаще диагностировалась у женщин, чем у мужчин (24 и 12 соответственно). Большинство (19; 52,7%) образований располагалось на коже туловища, 11 (30,5%) – на коже ног, по 3 (8,4%) – на коже рук и в области головы и шеи. При клиническом осмотре 21 (58,3%) образование имело двухцветное окрашивание, 8 (22,2%) – трех- и 7 (19,5%) – четырехцветное. Большинство образований характеризовалось типичной для МК неравномерной окраской и неправильной формой, однако 9 (25%) образований были окрашены равномерно, 10 (27,7%) – имели правильную форму. Границы 9 (25%) образований были размыты и плавно переходили в окружающую здоровую кожу. Размер 14 (38,9%) образований не превышал 6 мм, 8 (22,2%) образований имели диаметр от 7 до 10 мм и 14 (38,9%) – более 1 см. Средний диаметр образований составил 10,3±8 мм.
Дерматоскопические структуры в большинстве образований были распределены неравномерно хотя бы по одной оси симметрии (88,9%), только 4 (11,1%) образования были симметричными. В 22 (61,1%) образованиях, по результатам дерматоскопического осмотра, обнаружен хотя бы один дополнительный цвет по сравнению с клиническим осмотром. Дерматоскопическая картина 18 (50%) образований характеризовалась типичной для МК многокомпонентной моделью строения, 9 (25%) образований имели ретикулярную модель строения, 6 (16,7%) – неспецифическую, 2 (5,6%) – «спитцоидную» и 1 (2,7%) образование – глобулярную. По результатам расчета дерматоскопического правила ABCD [14], 12 (33,3%) образований были расценены как доброкачественные, 4 (11,1%) – как подозрительные и 20 (55,6%) как МК. Среднее значение общего дерматоскопического индекса составило 5,28±1,51 балла. Использование 7-балльного алгоритма Argenziano [15] позволило диагностировать меланому в 27 (75%) случаях, среднее значение составило 3,4±1,73 балла.
Диагноз МК во всех случаях верифицировался при помощи гистологического исследования. Часть морфологических заключений не содержала сведений о толщине опухоли по Breslow, уровне митотической активности, степени выраженности лимфогистиоцитарного инфильтрата. Единственной характеристикой, присутствовавшей во всех заключениях, был уровень инвазии по Кларку. Девять (25%) образований были внутриэпидермальными (in situ), 7 (19,4%) – микроинвазивными (II уровень инвазии), 20 (55,6%) – инвазивными (III–V уровни инвазии).
В связи с расхождением клинического и морфологического диагноза в 19 (52,7%) случаях потребовался пересмотр гистологических препаратов. Основанием для пересмотра в 13 (68,4%) случаях послужил положительный результат хотя бы одного из использованных дерматоскопических алгоритмов диагностики МК, в 4 (21%) – несоответствие морфологического диагноза «диспластический невус» дерматоскопической модели строения образования, в 1 (5,3%) случае – выраженная динамика со стороны образования в период 3-месячного наблюдения и еще в 1 (5,3%) – подозрение на МК по результатам клинического осмотра (единичное образование на коже голени у женщины 57 лет). В качестве критериев диагностики МК мы опирались на признаки, выделенные A.B. Ackerman [16] и определяемые в любых гистологических разновидностях МК, в т.ч. на ранних стадиях развития опухоли. Первоначально 17 из 19 меланом были описаны как диспластический невус разной степени тяжести, 2 образования – как смешанный невус. Лишь в 1 случае из 19 потребовалась дорезка парафиновых блоков в связи с неправильной подготовкой гистологического препарата (срез из периферической части).
В 26 (72,3%) случаях образование послужило поводом для обращения на осмотр, 10 (27,7%) образований были выявлены активно при полноценном осмотре кожных покровов. Сравнительные характеристики МК в разных клинических группах приведены в табл. 1 и 2.
Диаметр образования более 6 мм достоверно ассоциировался с вертикальной (инвазивной) стадией роста меланомы методом Хи-квадрат (p<0,05).
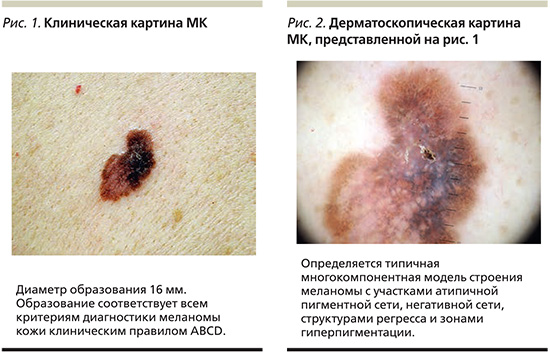
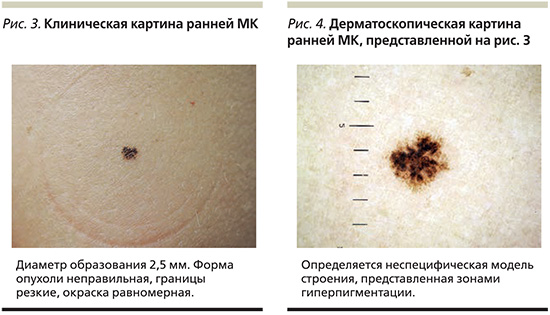
Полученные клинико-эпидемиологические данные об образованиях, выявляемых непосредственно пациентами или превышающих по диаметру 6 мм, полностью соответствуют привычному для врачей представлению об МК (рис. 1, 2). К сожалению, даже в клинически очевидных ситуациях врач сталкивается с ложноотрицательным результатом гистологического исследования в трети случаев. Преобладание в этих клинических группах инвазивных меланом подразумевает обследование пациентов на предмет возможного развития метастатического процесса [17]. Известно, что у людей, перенесших МК, повышен риск развития повторной меланомы и других злокачественных опухолей [18, 19]. Таким образом, отсутствие лечения и последующего наблюдения за пациентами с ложноотрицательным результатом гистологического исследования может существенно влиять на прогноз жизни пациента.
Мелкие МК (диаметром не более 6 мм) характеризуются стертой клинико-дерматоскопической картиной (рис. 3, 4). Так, образования окрашены лишь в 2 цвета, а каждое третье из них может дополнительно характеризоваться равномерным распределением цвета, правильной формой или плавным переходом в окружающую здоровую кожу. То есть подобные МК при общем осмотре не обращают на себя внимания и для их обнаружения требуется очень тщательный осмотр всех кожных покровов. Дерматоскопические проявления мелких МК в целом характеризуются меньшим полиморфизмом структур. Одним из настораживающих признаков можно считать больший цветовой полиморфизм при дерматоскопическом осмотре по сравнению с клинической картиной – данный симптом выявлялся в 71,4% мелких меланом. Необходимо отметить, что использование дерматоскопических алгоритмов диагностики МК в большинстве случаев не подходит для диагностики ранних форм заболевания. Так, дерматоскопическое правило ABCD правильно диагностировало меланому только в 14,2%, а 7-балльный алгоритм Argenziano (при пороговом значении 3 балла) – в 50%.
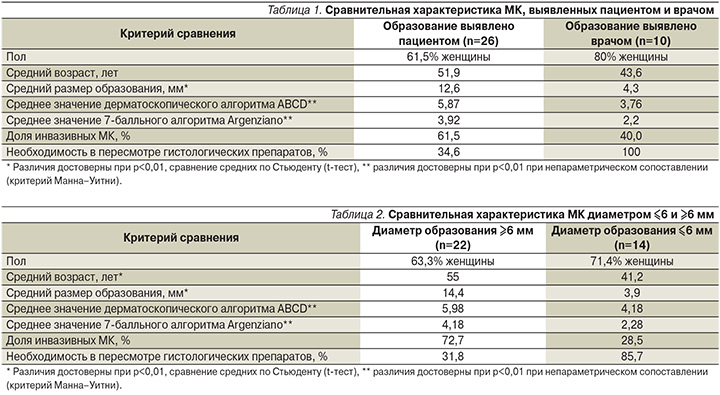
Гистологическая диагностика ранней МК сегодня, как и раньше, считается областью экспертной оценки в патоморфологии меланоцитарных новообразований кожи. Этим можно объяснить столь высокий процент диагностических ошибок, выявленный в исследовании. Однако «цена» диагностической ошибки в группе мелких МК менее высока – большинство образований находилось в стадии радиального роста (I–II уровни инвазии по Кларку). Наиболее частыми гистологическими признаками ранних МК стали полиморфизм ядер меланоцитов разной степени выраженности, асимметрия гистологического препарата, различные по величине и форме гнезда меланоцитов в пределах эпидермиса и/или дермы, их слияние между собой и наличие педжетоидного роста.
Важным эпидемиологическим фактором, выявленным в нашем исследовании, оказался более ранний возраст пациентов с мелкими МК (41,2 года по сравнению с 55 в группе меланом большего диаметра). Очевидно, что эти образования со временем будут меняться по форме, размеру и окрашиванию пока не приобретут «классические» внешние проявления. Клинические и дерматоскопические исследования свидетельствуют, что меняющееся меланоцитарное образование у пациента в возрасте 40–50 лет в большинстве случаев является МК [20, 21]! Таким образом, анамнестические или задокументированные врачом сведения об изменении пигментного образования у пациента старше 40 лет должны расцениваться клиницистом в первую очередь как дополнительный клинический симптом МК.
Литературные данные о связи МК с полом пациента неоднозначны.
В странах с низким уровнем солнечной активности женщины более подвержены меланоме [22], в то время как в более южных регионах заболеваемость среди женщин такая же или чуть выше по сравнению с мужчинами [23]. С другой стороны, заболеваемость среди женщин выше только до 40-летнего возраста, а к 75-летнему возрасту отмечается трехкратное увеличение заболеваемости среди мужчин [24]. Преобладание МК у женщин, по результатам нашего исследования, с одной стороны, можно объяснить возрастом пациентов, в т.ч. с ранней меланомой, с другой – более частой обращаемостью женщин на осмотр новообразований кожи [2–4].
Актуальным остается вопрос о роли меланоцитарных невусов в развитии МК. Врач часто слышит, что на месте диагностированной злокачественной опухоли ранее длительное время (иногда, со слов пациентов, даже с рождения) существовала «родинка» или случайная травма привела к «перерождению родинки». Литературные данные и практический опыт в большинстве случаев опровергают факт злокачественной трансформации меланоцитарных невусов. По результатам гистологического исследования 990 случаев поверхностно-распространяющейся МК только 254 (25,7%) опухоли развились на фоне существовавшего ранее меланоцитарного невуса, а из 111 случаев узловой меланомы – 3 (2,7%) [25]. Согласно другим источникам, развитие МК на фоне невуса встречается в 8–21,6% случаев, причем большинство авторов выделяют мелкие врожденные меланоцитарные невусы как фоновые образования для развития МК [26–28]. Исключение составляет семейный синдром множественных диспластических невусов и МК (FAMMM-синдром), при котором частота развития МК на фоне невуса может достигать 54,2% [29], однако такие пациенты встречаются в клинической практике крайне редко. Наш опыт диагностики ранних меланом показывает, что начальные проявления МК по внешним проявлениям могут быть не отличимыми от обычных приобретенных или диспластических невусов. Описываемые в литературе «вероятные» и «достоверные» клинические признаки трансформации доброкачественных меланоцитарных образований в меланому (постепенное изменение формы, размера, консистенции образования и др.) [30] являются, на наш взгляд, естественным развитием меланомы. Можно предположить, что в большинстве случаев описываемый пациентами факт «перерождения родинки» – не что иное, как переход опухоли из стадии горизонтального роста в стадию вертикального роста.
Таким образом, размер меланоцитарного образования не может являться дифференциально-диагностическим признаком для определения доброкачественной природы образования. Однако осматривая все образования на коже, в т.ч. диаметром менее 6 мм, врач достоверно чаще выявляет начальные формы опухоли. Внешние проявления ранней МК отличаются меньшим полиморфизмом клинической и дерматоскопической картины, что затрудняет постановку диагноза при первичном осмотре пациента. Задачи дерматолога в диагностике злокачественных новообразований кожи включают проведение скрининговых осмотров, формирование групп повышенного риска по развитию рака кожи, проведение за ними динамического наблюдения, направление пациентов при наличии показаний в онкологическое отделение для проведения лечения и сопоставление клинического диагноза и результатов гистологического исследования.



