Введение
Нормальная беременность связана со строго регулируемой воспалительной реакцией и балансом между про- и противовоспалительными цитокинами, необходимыми для процесса плацентации – от нидации до момента спонтанного развития срочных родов [1, 2]. Эффективное регулирование воспаления – важная составляющая физиологического течения беременности. Любые заболевания или патологические состояния, повышающие уровень воспаления, индуцированного беременностью, приводят к развитию гестационных осложнений, неблагоприятному перинатальному исходу и развитию послеродовой инфекции.
Ожирение является хорошо известным фактором риска множественных осложнений со стороны матери и плода. Считается, что ожирение во время беременности влияет на метаболические, нейроэндокринные, микробиомные и иммунные пути [3].
Материнское ожирение и/или нарушения углеводного обмена (НУО) патогенетически связаны с состоянием хронического слабовыраженного метаболически индуцированного воспаления, отличимого от острой воспалительной реакции [4, 5]. Указанная воспалительная среда – фон, который может быть одним из механизмов, с помощью которого в послеродовом периоде реализуется риск развития инфекционно-воспалительных осложнений за счет снижения материнского системного воспалительного ответа и формирования предрасположенности к колонизации инфекционным агентом [6, 7], что подтвердилось в период пандемии новой коронавирусной инфекции [8]. Метаболическое воспаление у матери, связанное с гестационным сахарным диабетом (ГСД), более выраженно, чем у беременных с ожирением без ГСД [6]. Эта ассоциация может быть еще больше усугублена у матерей с существующими хроническими воспалительными заболеваниями [9].
Воспаление, вызванное обменно-эндокринными заболеваниями, отличается от классической воспалительной реакции по следующим признакам [4, 6]:
- индуцируется метаболическими процессами;
- хроническое системное, субклиническое течение с преимущественной локализацией в метаболически активных тканях (жировой ткани, мышцах, печени, кишечнике, поджелудочной железе);
- изменяя профиль иммунокомпетентных клеток и повышая секрецию противовоспалительных цитокинов, благоприятствует развитию истинного воспаления в тканях.
По этим причинам для описания торпидного воспаления, связанного с иммунным и метаболическим гомеостазом, введен термин «метавоспаление», или «метавоспалительная реакция» (G.S. Hotamisligil, 2006) [10]. Метавоспаление, ассоциированное с ожирением, может снижать функциональную активность иммунных клеток, вызывать дисбаланс микробиома/вирома кишечника, изменять профиль воспалительных цитокинов, повышать устойчивость к противовирусным, противомикробным препаратам и антикоагулянтам, что способствует развитию инфекции и неблагоприятно влияет на прогноз [8]. Недавно проведенное исследование показало, что гипервоспалительное состояние матки при синдроме поликистозных яичников на фоне ожирения и инсулинорезистентности может быть причиной серьезных осложнений беременности начиная от выкидыша и заканчивая плацентарной недостаточностью [11].
В настоящее время хорошо изучена связь воспалительного дисбаланса и нарушений градиента цитокинов с осложнениями беременности (преэклампсия, эклампсия, выкидыши, преждевременные роды) [2, 7], но по-прежнему остается мало освещенным вопрос связи метавоспаления при обменно-эндокринной патологии и последующего риска послеродовых инфекционно-воспалительных осложнений.
В национальных клинических рекомендациях к наиболее значимым факторам риска послеродовых септических осложнений относят возраст <20 и ≥40 лет, бесплатную медицинскую помощь, кесарево сечение (КС), большой паритет родов и мертворождение [12]. Отягощенному соматическому фону, в частности обменно-эндокринным заболеваниям, не уделено должного внимания. Признается актуальным поиск наиболее информативных предикторов риска развития послеродовой инфекции на фоне хронической соматической патологии, выявление которых на этапе беременности следует относить к вопросам предиктивной диагностики. Имеются единичные работы, подчеркивающие ассоциацию послеродовых инфекционно-воспалительных осложнений с метаболическими нарушениями, которые, несомненно, вносят вклад в риск реализации послеродовой инфекции и тяжесть ее течения [13, 14]. Настоящее исследование направлено на изучение возникновения послеродовой (послеоперационной) инфекции путем анализа информативности ее предикторов у пациенток с отягощенным соматическим анамнезом для последующего формирования рекомендаций по клинической диагностике, лечению и профилактике.
Цель исследования: оценить распространенность и структуру обменно-эндокринных заболеваний у родильниц с эндометритом после КС, определить их прогностическое значение как независимого предиктора развития послеоперационных инфекционно-воспалительных осложнений.
Методы
Проведено ретроспективное исследование историй болезни и данных первичной медицинской документации 648 родильниц, родоразрешенных путем операции КС, из них 406 с диагнозом «эндометрит после КС» (основная группа) и 242 – с физиологическим течением послеоперационного периода (контрольная группа).
Критерии включения в исследование: стандартное эпидемиологическое определение случая – эндометрит после КС [12]. Критерии невключения в исследование: дефицит массы тела, состояние после родов через естественные родовые пути, отсутствие возможности дополнительной экспертизы первичной медицинской документации (копий, выписок), историй болезни, амбулаторной и обменной карт. Все пациентки, включенные в исследование, при выявлении НУО были обследованы совместно с эндокринологом.
Индекс массы тела (ИМТ) и наличие ожирения оценивали на основе массы тела до беременности согласно общепринятой международной классификации [15]: нормальная масса тела (ИМТ=18,50–24,99 кг/м2), избыточная масса тела (ИМТ=25,00–29,99 кг/м2), ожирение I степени (ИМТ=30,00–34,99 кг/м2), ожирение II степени (ИМТ=35,00–39,99 кг/м2) и ожирение III степени (ИМТ=40,00 кг/м2 или выше).
Обследование на наличие НУО во время беременности проведено в соответствии с клиническими рекомендациями «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение» (2013).
В сроки от 6/7 до 24 недель гестации определяли уровень глюкозы венозной плазмы натощак с 24-й по 28-ю неделю беременности всем беременным, у которых до этого не было выявлено НУО, проводился пероральный глюкозотолерантный тест с 75 г глюкозы. ГСД устанавливали в случае выявления уровня глюкозы венозной плазмы натощак ≥5,1 ммоль/л, но менее 7,0 ммоль/л, через час после нагрузки глюкозой ≥10,0, через 2 часа после нагрузки глюкозой ≥8,5 ммоль/л, но менее 11,1 ммоль/л.
В связи с отсутствием диагностических критериев метаболического синдрома (МС) в период гестации к достоверным его признакам отнесли критерии, предложенные Российским кардиологическим обществом по артериальной гипертонии (2013): наличие центрального типа ожирения и двух любых дополнительных симптомов (дислипидемия, артериальная гипертензия, НУО).
В ряде случаев при наличии показаний к оценке компенсации сопутствующей экстрагенитальной патологии применяли дополнительные клинико-лабораторные и инструментальные методы исследования (оценка расчетной скорости клубочковой фильтрации, расширенный биохимический анализ крови, анализ мочи по Нечипоренко, регистрация электрокардиограммы, консультации офтальмолога и кардиолога). Информацию о коморбидном статусе получали путем ретроспективного анализа данных из различных форм первичной медицинской документации, выписных эпикризов, изучения результатов клинико-лабораторного обследования и консультаций профильных специалистов.
Статистическую обработку полученных данных выполняли с помощью пакета программ Statistica for Windows, 10,0. Методы описательной статистики включали расчет частот наблюдаемых признаков в группах пациенток, анализ межгрупповых различий по этим показателям проводили с использованием χ2-критерия.
Также был проведен многофакторный логистический регрессионный анализ с расчетом отношения шансов (ОШ) развития эндометрита у пациенток, включенных в исследование в соответствующих группах (с наличием и в отсутствие проверяемого признака) с 95% доверительным интервалом (ДИ). Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты
При оценке соматического статуса пациенток, включенных в исследование, обращает на себя внимание наличие у родильниц с эндометритом высокой частоты выявленных первичных и вторичных экстрагенитальных заболеваний (52,7%, 214/406 и 54,9%, 223/406 соответственно). Число здоровых родильниц (без отягощенного преморбидного фона) в основной группе достоверно меньше, чем в группе контроля (18,7%, 76/406 и 62,4%, 151/242 соответственно; р<0,05).
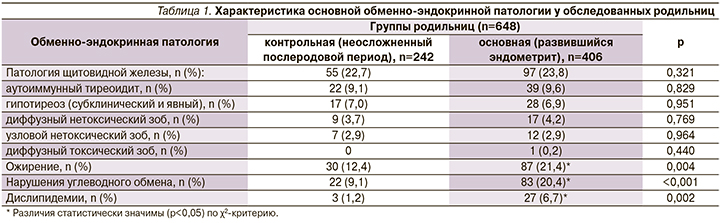
В структуре экстрагенитальных заболеваний у родильниц с эндометритом обменно-эндокринная патология занимает 2-е место (рис. 1), что достоверно чаще, чем у родильниц контрольной группы (58,4%, 237/406 и 37,6% 91/242 соответственно, χ2=26,2; p<0,001). Лидирующую позицию в сопутствующей эндокринной патологии у родильниц с эндометритом занимали заболевания щитовидной железы: аутоиммунный тиреоидит – 40,2% (39/97), субклинический гипотиреоз – 28,9% (28/97), йоддефицитные заболевания (диффузный нетоксический зоб – 17,5% [17/97], узловой нетоксический зоб – 12,4% [12/97]) и редко диффузный токсический зоб – 1,0% (1/97), однако при этом статистически значимых межгрупповых различий выявлено не было (табл. 1).
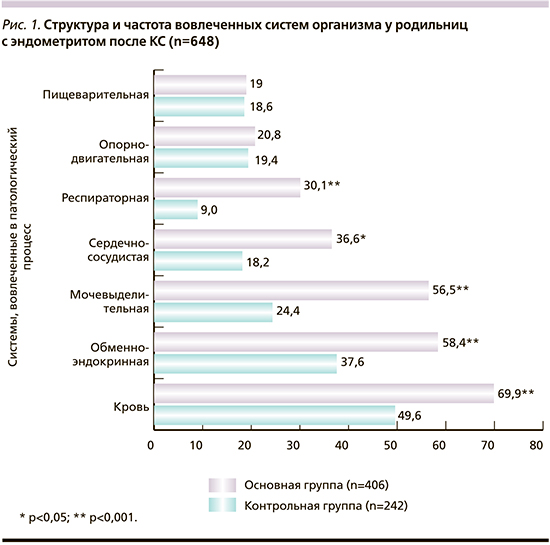
Из всей выборки пациентки, начавшие беременность с ИМТ в диапазоне ожирения 18,1% (117/648), имели средний ИМТ при беременности 36,1±5,46 кг/м2 с диапазоном 36,1–44,5 кг/м2, в то время как пациентки, не страдавшие ожирением, – 81,9% (531/648), имели средний ИМТ при беременности 25,1±3,4 кг/м2 с диапазоном 18,9–29,5 кг/м2. Почти вдвое чаще ожирение зарегистрировано у повторнородящих.
Частота диагностики ожирения при беременности в основной группе достоверно больше, чем в группе контроля (21,4%, 87/406 и 12,4% 30/242 соответственно, χ2=8,396; p=0,004). Средний ИМТ до беременности в основной группе был выше, чем в контрольной (27,5±12,6 кг/м2 и 23,9±6,5 кг/м2 соответственно). Степени ожирения при беременности в исследуемых группах были различны (рис. 2).
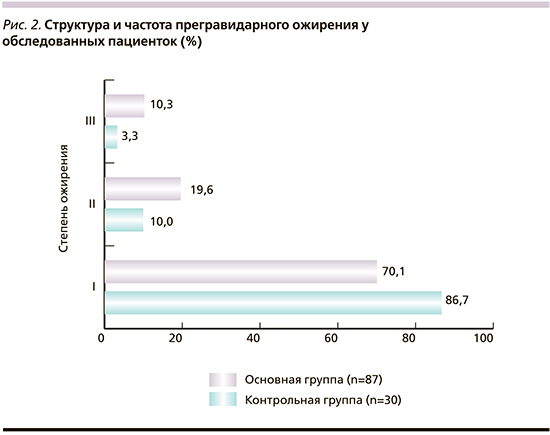
При сравнительном анализе степени ожирения между группами выявлен ряд различий. У родильниц с эндометритом беременность возникла на фоне ожирения II степени в 19,6% (17/87) случаев, в контрольной группе – в 10,0% (3/30, χ2=1,433; p=0,232). В основной группе ожирение III степени диагностировано в 3 раза чаще, чем в контрольной: 10,3% (9/87) против 3,3% (1/30; χ2=1,403; p=0,237).
У каждой третьей (31,0%, 27/87) пациентки основной группы выявлен МС. В контрольной группе ассоциация метаболических нарушений диагностирована только в 6,6% (2/30) случаев. У всех родильниц с эндометритом после КС сахарный диабет 2 типа (СД2) сочетался с ожирением разной степени тяжести. Гипертензионные расстройства (артериальное давление ≥140/90 мм рт.ст.) особенно в сочетании с прегестационным СД во время беременности создают предпосылки к формированию таких осложнений, как ретино- и ангиопатия сетчатки. Вторичные изменения на глазном дне зарегистрированы у всех пациенток с МС.
Частота НУО при беременности в основной группе достоверно больше, чем в группе контроля (20,4%, 83/406 и 9,1% 22/242 соответственно, χ2=14,391; p<0,001), и сопоставима с распространенностью ожирения. Структура выявленных нарушений в исследуемых группах была различной (рис. 3).

Из всех НУО наиболее часто диагностирован ГСД по гипергликемии, определенной натощак: в первой половине беременности – у 68,2%, по результатам 75-граммового перорального глюкозотолерантного теста – у 30,6%, манифестный СД диагностирован в 1,2%. К диагностическим дефектам, выявленным менее чем у 5% обследованных пациенток, отнесли назначение нагрузочного теста беременным с гипергликемией, определенной натощак, и продолжение тестирования при высоких показателях «нулевой точки».
При сравнительном анализе структуры НУО между группами выявлен ряд различий. У родильниц, больных эндометритом, беременность возникла на фоне прегестационного сахарного диабета в 21,7%, 18/83 случаев, в контрольной группе в 9,1%, 2/22 (χ2=1,789; p=0,182). В основной группе СД2 диагностирован в 2 раза чаще, чем в контрольной (18,1%, 15/83 против 9,1%, 2/22; χ2=1,034; p=0,310). Только в одном случае у родильницы с эндометритом, страдавшей ожирением, при беременности диагностирован манифест СД во время рутинного гестационного скрининга НУО (в первом биохимическом анализе крови I триместра обнаружен уровень глюкозы плазмы натощак >7,0 ммоль/л). В дальнейшем диагноз подтвержден определением уровня HbA1c (≥6,5%) венозной крови.
Отклонения результатов теста на толерантность к глюкозе (кластер в Международной классификации болезней Х пересмотра – R73.0) или преддиабет диагностированы у 7,2% (6/83) пациенток основной группы по результатам стандартного нагрузочного теста, проведенного до беременности. Данная промежуточная стадия НУО характеризуется возможностью последующей конверсии в клинически выраженный СД2.
Во время беременности обмен-ассоциированные заболевания у каждой второй пациентки основной группы сочетались с анемией воспаления/хронического заболевания: при ожирении у 54,0% (47/87), при НУО у 51,8% (43/83), при диагностике МС у 100% (27/27) пациенток.
У каждой третьей пациентки с эндометритом наличие ожирения (34,5%, 30/87) или НУО (30,1%, 25/83) ассоциировано с инфекцией мочевыводящих путей, что достоверно чаще, чем у пациенток контрольной группы (10,0%, 3/30 и 13,6%, 3/22 соответственно, р<0,05). При этом 73,3% (11/15) больных СД2, 16,9% (11/65) больных ГСД и все пациентки с СД1 страдали симптомной или бессимптомной инфекцией мочевыводящих путей. У всех пациенток с ИМТ 35,00 кг/м2 и выше при беременности диагностирована мочевая инфекция, а при ИМТ 30,00–34,99 кг/м2 – только у 6,6% (4/61). Дизурия, учащенное мочеиспускание и боль над лоном были самыми частыми клиническими признаками мочевых инфекций при беременности в исследованных группах.
Анализ различий в соматическом статусе между исследуемыми группами позволил оценить их значимость в развитии эндометрита после КС. Результаты многофакторного логистического регрессионного анализа представлены в табл. 2.

Как видно, к наиболее значимым предикторам развития эндометрита может быть отнесена анемия воспаления. Значение отношения шансов (ОШ) для этого фактора составило 4,12 (ДИ 1,28–6,19; p<0,001). Исследование также показало, что значимыми факторами развития эндометрита после КС являются ожирение (ОШ=3,45, 95% ДИ: 1,14–5,11; p=0,005), бессимптомная бактериурия (ОШ=3,68, 95% ДИ: 1,31–4,94; p<0,001), нарушения углеводного обмена (ОШ=2,84, 95% ДИ: 1,54–3,52; p=0,012) и артериальная гипертензия (ОШ=2,14, 95% ДИ: 1,12–4,04; p=0,032).
Обсуждение
По результатам проведенного когортного исследования, у родильниц с эндометритом после КС обменно-эндокринные заболевания занимают лидирующую позицию в структуре коморбидной патологии, уступая только анемическому синдрому различного генеза.
Наиболее часто при беременности диагностирована патология щитовидной железы, не имеющая достоверных различий с таковой в группе родильниц с неосложненным течением послеоперационного периода. У каждой пятой пациентки с эндометритом после КС статистически чаще диагностированы ожирение (21,4%) и НУО (20,4%) по сравнению с пациентками контрольной группы (12,4 и 9,1% соответственно; р<0,05). МС в подавляющем большинстве случаев (93,1%) зарегистрирован у пациенток основной группы, его частота и выраженность симптомов увеличиваются пропорционально степени ожирения.
Результаты проведенного многомерного регрессионного анализа подтвердили прогностическую значимость ожирения и НУО в предикции развития эндометрита после КС. Остается открытым вопрос о коморбидности этих заболеваний и об их возможной патогенетической связи с эндометритом (неуточненная коморбидность).
В настоящее время активно изучаются триггеры, нарушения в медиаторном звене воспаления, инициирующие метавоспалительную реакцию, и ее взаимосвязь с метаболическими заболеваниями. Огромное число исследований содержат подробное описание механизмов регуляции жирового обмена и гомеостаза глюкозы воспалительными путями за счет иммунной системы, однако их триггеры долгое время оставались невыявленными.
На сегодняшний день установлено, что микробиом играет решающую роль в метаболизме человека, частично действуя как иммуномодулятор [16]. Микробиом участвует в пищеварении, производстве метаболитов, способных изменять гомеостаз человека, и развитии иммунной системы. Кишечная микробиота и продуцируемые ею метаболиты могут способствовать развитию резистентности к инсулину при ожирении с последующим прогрессированием до СД2 за счет изменений в иммунитете и инициации метавоспаления [16]. Персистенция метавоспалительной реакции становится причиной МС, а впоследствии и появления различных сочетаний хронических заболеваний в первую очередь неинфекционной природы (сосудистая дисфункция, кардиальная патология, нарушения пуринового обмена и свертываемости крови). В дальнейшем ухудшающийся профиль цитокинов оказывает негативное влияние на иммунитет и метаболизм всех периферических тканей [17]. Например, пациенты с резистентностью к инсулину и нарушением толерантности к углеводам имели более высокий воспалительный статус, иммунную дисфункцию (отрицательно влияя на хемотаксис нейтрофилов, активность макрофагов и фагоцитов) и измененную реакцию на респираторные и мочевые инфекции по сравнению с пациентами, чувствительными к инсулину [18].
Как показало наше исследование, метаболическая патология при беременности служит фоном для развития ряда инфекционно-воспалительных заболеваний: анемии воспаления, симптомной или бессимптомной инфекции мочевыводящих путей.
Анемия воспаления/хронического заболевания наряду с ожирением сопряжена с послеоперационными инфекционно-воспалительными осложнениями и патогенетически связана с провоспалительной индукцией цитокинов и экспрессией гепсидина [19]. У небеременных женщин с ожирением уровень гепсидина повышается [20]. Во время нормально протекающей беременности содержание гепсидина снижается, что позволяет увеличивать поступление железа к плоду [21]. Метавоспалительная реакция во время беременности может приводить к избытку гепсидина, развитию анемии воспаления и снижению неонатального запаса железа [3, 21].
Существует двунаправленная связь между метаболическими заболеваниями и бактериальными инфекциями. В то время как ожирение и диабет увеличивают восприимчивость к бактериальным инфекциям и их осложнениям, ряд хронических инфекций, таких как инфекции мочевыводящих путей, связаны с повышенным уровнем провоспалительных цитокинов, которые могут усугублять резистентность к инсулину и ухудшать гликемический профиль [14].
Заключение
Распространенность прегравидарного ожирения у родильниц с эндометритом составила 21,4% (каждая пятая пациентка с ИМТ≥30,00 кг/м2). Примерно с той же частотой (20,4%) диагностированы различные НУО, в их структуре превалировал ГСД (78,3%).
Как показали результаты проведенного исследования и данные литературы, метаболические заболевания (ожирение и НУО) связаны с ухудшением имеющегося провоспалительного статуса и сопряжены с развитием при беременности анемии воспаления и инфекций мочевыводящих путей.
Ожирение осложняет течение беременности в 1,7 раза чаще у родильниц с эндометритом после КС по сравнению с родильницами с неосложненным течением послеоперационного периода (21,4% против 12,4%; χ2=8,36; p=0,004), а нарушения углеводного обмена в 2,2 раза (20,4 против 9,1%; χ2=14,391; p<0,001), что позволяет отнести их к значимым предикторам развития послеоперационных инфекционно-воспалительных осложнений в акушерстве.
Благодарности. Авторы выражают признательность Центру «Сахарный диабет и беременность» ФГБНУ «НИИ АГиР им. Д.О. Отта», врачам-эндокринологам А.В. Тиселько и Ю.С. Ловковой за помощь в сборе материала и критические замечания в отношении финальной версии рукописи.



