Введение
На сегодняшний день неалкогольная жировая болезнь печени (НАЖБП) является самой распространенной патологией в структуре хронических заболеваний печени (ХЗП). По данным ряда эпидемиологических исследований, ее распространенность увеличилась за последние 20 лет почти вдвое, что стало предметом многочисленных исследований среди врачей различных специальностей [1, 16].
Совершенно точно, что распространенность НАЖБП связана с эпидемией ожирения и с рядом метаболических нарушений, возникающих у таких пациентов. Так, у лиц, страдающих ожирением, НАЖБП выявляется значительно чаще, нежели чем в общей популяции, а при морбидном ожирении возрастает более чем на 95%. Также независимо от массы тела у больных НАЖБП увеличивается синтез холестерина, а его всасывание в кишечнике снижается в результате нарушения микробиоценоза кишечника, который в свою очередь встречается практически среди всех больных ХЗП в разной степени тяжести [16, 17, 19, 20, 28].
Известно, что единственным органом, в котором осуществляется синтез желчных кислот, является печень.
В ней функционируют две ферментные системы: 3-гидрокси-3-метилглутарил-коэнзим А-редуктаза (ГМГ-КоА-редуктаза), ответственная за синтез холестерина, и 7α-гидроксилаза, способствующая «переводу» холестерина в желчные кислоты. Эти системы находятся в определенном соотношении. Повышение активности ГМГ-КоА-редуктазы или снижение активности 7α-гидроксилазы способствуют перенасыщению крови и желчи холестерином. При повышении активности ГМГ-КоА-редуктазы активность 7α-гидроксилазы закономерно снижается. Кроме того, ядерные рецепторы гепатоцитов (PPARs и LXRs) выступают участниками всех важнейших функций печени и выполняют важную роль в обмене холестерина. LXRs активируются метаболитами холестерина и по механизму обратной связи обеспечивают его регуляцию в клетке. Так, ХЗП, СД 2 типа, нарушение диеты, ожирение и повышение массы тела на 1 кг могут увеличить объем экскретируемого холестерина в желчь на 20 мг/сут. В результате перенасыщения желчи холестерином она сгущается и кристаллизуется, что способствует развитию билиарной недостаточности, которая реализуется в виде функциональных расстройств желчного пузыря, хронического холецистита и желчнокаменной болезни (ЖКБ). Подобные атерогенные нарушения липидного обмена у больных ЖКБ встречаются от 27 до 81%, а у больных НАЖБП – от 20 до 81% случаев, что демонстрирует общие этиопатогенетические механизмы развития этих заболеваний [13, 17, 25].
По различным данным, частота встречаемости ЖКБ среди взрослого населения России и Европы составляет не более 20%. Это одно из наиболее распространенных заболеваний человека, которое занимает третье место в структуре заболеваемости после сердечнососудистой патологии и СД. В одном исследовании показано, что риск развития ЖКБ увеличивается в 1,5 раза у пациентов с НАЖБП. В другом исследовании, проведенном с целью оценки взаимосвязи НАЖБП и других заболеваний ЖКТ, было установлено, что НАЖБП в 3,5 раза чаще была ассоциирована с ЖКБ, нежели чем другие заболевания ЖКТ. Так, у больных НАЖБП ЖКБ на стадии калькулезного холецистита и с холецистэктомией в анамнезе встречается у 20%, а на стадии билиарного сладжа – более чем у половины пациентов [2, 13, 17].
Значимая связь между НАЖБП и ЖКБ недавно была подтверждена в систематическом обзоре и мета-анализе, включившем 12 исследований [33]. Важно отметить при этом, что связь ЖКБ и НАЖБП обусловлена не только наличием общих факторов риска и патогенетических механизмов. Показано, что холелитиаз может иметь серьезные метаболические последствия, предрасполагающие к развитию НАЖБП, а желчные кислоты рассматриваются сегодня не столько как «сурфактанты/детергенты», облегчающие усвоение жирных пищевых продуктов, как это считалось ранее, сколько как сигнальные молекулы, координирующие регуляцию метаболизма и воспаления, причем не только в ЖКТ, но и в других органах и системах [34].
В работах отечественных авторов отмечено, что у пациентов на стадии стеатоза в сочетании с ожирением ЖКБ выявлено в 100% случаев, а на стадии неалкогольного стеатогепатита ЖКБ зарегистрировано у 42% пациентов. Интересен тот факт, что распространенность ЖКБ увеличивается соответственно нарастанию тяжести фиброза и активности воспаления в печени. А также, что в течение 1 года после ХЭ НАЖБП развивается у 36,6% больных, а в течение 4 лет – у 42,5% пациентов [9, 22, 29, 32].
Высокая распространенность и темпы прогрессирования НАЖБП и ЖКБ зависят от совокупности факторов риска этих заболеваний, которые в большинстве своем являются общими [17, 25, 26]. На сегодняшний день четко определены факторы, существенно снижающие толерантность печени в отношении развития НАЖБП и ЖКБ. Среди них выделяют первичные: малоподвижный образ жизни, сниженная физическая активность, метаболический синдром (МС), СД, висцеральное ожирение, дислипидемия, и вторичные: применение лекарственных препаратов (глюкокортикоиды, амиодарон, эстрогены, тамоксифен, тетрациклин, ацетилсалициловая кислота, индометацин, бруфен, антибиотики), нарушение питания (голодание, резкое сокращение или увеличение калорийности пищи, чрезмерное потребление углеводов, парентеральное питание, недостаток белков, витаминов и микроэлементов), нарушение процессов пищеварения и всасывания (хронические заболевания органов ЖКТ), болезни обмена (Вильсона–Коновалова, Вебера–Крисчена, подагра), гипотиреоз, беременность, кислородная недостаточность (на фоне анемии, хронической сердечной и дыхательной недостаточности), нарушение микробиоценоза кишечника [17, 19, 20].
Таким образом, нет сомнений в наличии тесной связи между НАЖБП и ЖКБ. При этом до конца остается не ясным, что же развивается первично или эти заболевания формируются параллельно, но совершенно точно доказано наличие негативного влияния этих состояний друг на друга. Так, на фоне НАЖБП инсулинорезистентность (ИР) способствует развитию гиперсимпатикотонии, которая в свою очередь нарушает двигательную функцию желчного пузыря, а инсулин подавляет его базальную и стимулированную холецистокинином моторику, способствуя развитию застоя желчи. Кроме того, симпатический отдел ВНС оказывает тормозящее влияние на сократительную способность пузыря, что также замедляет его опорожнение и вызывает спазм сфинктера Одди. В свою очередь нарушение экскреции холестерина с желчью через основной путь его выведения, способствует отложению липидов в печени. Вследствие этого на фоне НАЖБП желчный пузырь включается в патологический процесс, результатом которого служит формирование сладжа, а при прогрессировании заболевания – формирование камней. Также ИР оказывает влияние на метаболизм липидов в печени, увеличивая синтез холестерина и триглицеридов в гепатоцитах, накопление в них липопротеидов низкой плотности и липопротеидов очень низкой плотности, что способствует активации окислительного стресса в эндотелиоцитах и развитию эндотелиальной дисфункции. Кроме того, при ИР формируется центральная симпатикотония вследствие гипергликемии и повышения поглощения и метаболизма глюкозы в инсулинчувствительных клетках вентромедиального отдела гипоталамуса, что приводит к увеличению содержания инсулина в крови. Повышение тонуса симпатической нервной системы стимулирует в жировой ткани процессы липолиза, способствует повышению концентрации жирных кислот и в целом усугубляет проявления ИР. Далее порочный круг замыкается, поскольку на фоне НАЖБП накопление липидов в печени способствует прогрессированию стеатоза и ухудшению физико-химических свойств желчи с увеличением риска развития ЖКБ. Подобный механизм развития ЖКБ и НАЖБП на фоне ИР и дислипидемии реализуется и у больных МС [5–7, 21, 31].
Таким образом, с учетом универсальности патогенетических механизмов формирования НАЖБП и ЖКБ важнейшим направлением терапии будет воздействие на общие факторы риска развития этих заболеваний [4, 13, 16, 17].
Терапия жирового гепатоза на сегодняшний день заключается прежде всего в снижении массы тела и физических нагрузках. Так, доказано, что похудение на 5% приводит к уменьшению степени стеатоза, на 10% вызывает уменьшение некрозов и воспаления в печеночной ткани. Физические упражнения, особенно в аэробных условиях, у взрослых пациентов с НАЖБП также уменьшают степень жирового гепатоза, т.к. способствуют утилизации свободных жирных кислот мышцами [3, 16].
При развитии ЖКБ на фоне НАЖБП для коррекции нарушений структуры и функции печени в настоящее время предложено множество лекарственных препаратов, большинство из которых объединены в группу т.н. гепатопротекторов. В качестве базисной терапии используются препараты желчных кислот, в частности урсодеоксихолевая кислота (УДХК) (Урсофальк, Dr. Falk Pharma GmbH, Германия) в дозе 10–15 мг/кг массы тела однократно на ночь длительно, поскольку важной мерой профилактики развития и прогрессирования НАЖБП и ЖКБ является восстановление нормальной энтерогепатической циркуляции желчных кислот [3, 14, 15, 18, 27]. УДХК оказывает профилактическое действие в отношении развития холедохолитиаза, в т.ч. и на пациентов, перенесших холецистэктомию. Помимо УДХК, улучшающей реологические свойства желчи, в качестве адъювантной терапии при ЖКБ применяются препараты, нормализующие функцию билиарного тракта, тонус желчного пузыря и сфинктеров, моторику тонкой кишки – Хофитол (ООО «Майоли Спиндлер», Франция), приготовленный из очищенного экстракта сока свежих листьев артишока. Основными действующими веществами экстракта артишока являются каффеоловая и хинная кислоты, биофлавоноиды, секвитерпенлактон, инулин, ферменты цинараз. Доказано, что препарат оказывает протективный эффект на печеночную клетку, усиливает синтез белка, детоксикационную функцию печени, нормализует обмен холестерина и повышает сократительную способность ЖП. Для купирования болевого синдрома используются релаксанты гладкой мускулатуры (М1-, М2- и М3-холиноблокаторы), миотропные спазмолитики (метеоспазмил) и холинолитики (атропин, платифиллин). Также в комплексной терапии применяют средства, восстанавливающие нормальный состав кишечной микрофлоры: пробиотики (пробиолог), пребиотики и препараты, улучшающие процессы пищеварения, – ферменты [4, 7, 10, 14, 15, 18, 23].
Что же касается коррекции дислипидемии у больных НАЖБП и ЖКБ, то необходимо учитывать гепатотоксичность липидснижающих препаратов, а также тот факт, что большинство из них противопоказаны при ХЗП. В связи с этим необходимо отметить гипохолестеринемический эффект УДХК и Хофитола. Гипохолестеринемический эффект УДХК реализуется за счет активации фарнезоид Х-ассоциированного рецептора и рецептора TGR-5, а также снижения секреции холестерина в желчь, а Хофитола – за счет уменьшения образования de novo молекул холестерина путем ингибирования ГМГ-КоА-редуктазы, а также за счет увеличения выведения холестерина вместе с желчью [14, 18, 24, 30]. Реализация гипохолестеринемического действия по различным путям делает комбинированную терапию более выигрышной, поскольку усиливается терапевтический эффект. Помимо прочего, эти препараты служат важным средством «терапии сопровождения» для больных, получающих статины [8].
Показанием к проведению консервативной терапии ЖКБ у пациентов с отсутствующей клинической симптоматикой служит стойкое выявление сладжа при УЗИ на протяжении 3 месяцев или наличие холестериновых камней. Медикаментозная терапия ЖКБ предусматривает использование УДХК в качестве базисного литолитического средства при наличии как билиарного сладжа, так и холестериновых конкрементов. Хофитол рекомендован пациентам при наличии билиарного сладжа [11, 12, 17, 18].
На сегодняшний день определены четкие критерии для проведения перорального литолиза, среди них [4]:
- желчные камни должны быть чисто холестериновыми (рентгенопрозрачными при обзорной рентгенографии или при КТ: плотность<100 HU);
- максимальный диаметр камня не должен превышать, как правило, 15–20 мм (возможно растворение камней большего диаметра – до 25–30 мм, но при условии, что их плотность не превышает 75 HU);
- желчный пузырь должен нормально функционировать;
- просвет желчного пузыря должен быть наполнен камнями, как правило не более чем наполовину (максимум – до 2/3 объема);
- пузырный проток должен быть проходимым;
- отсутствие осложнений ЖКБ.
При наличии оптимальных условий пероральное применение УДХК (Dr. Falk Pharma GmbH, Германия) в течение 6–12 месяцев приводит к полному растворению небольших холестериновых камней у 70–80% пациентов. Терапевтический эффект зависит от приверженности пациентов к лечению, поскольку УДХК должна приниматься регулярно и с учетом веса пациента. После достижения желаемого результата необходимо плавное снижение дозы УДХК по 1 капсуле в течение месяца и до полной отмены. Параллельно с отменой УДХК показано назначение Хофитола, обладающего холеретическим и холекенетическим эффектами, для достижения более быстрого терапевтического эффекта. Подобные профилактические курсы с использованием УДХК и Хофитола необходимо проводить дважды в год, в т.ч. и в отношении пациентов, перенесших холецистэктомию [4, 18].
Клинический пример
Для иллюстрации приведенного литературного обзора демонстрируем собственное клиническое наблюдение. Пациентка Д. 24 лет обратилась 21.04.2009 через 1,5 месяца после первых родов с жалобами на боли ноющего характера в эпигастральной области и чувство тяжести в правом подреберье, возникающее после приема пищи.
При обследовании: состояние удовлетворительное. Кожные покровы без особенностей. Избыток массы тела, ИМТ – 28. Язык влажный, обложен незначительным желтоватым налетом у корня. Живот мягкий, не вздут, незначительно болезнен в эпигастрии. Печень по краю реберной дуги, размеры по Курлову – 10×9×8 см. Пузырные симптомы Мюсси, Курвуазье, Кера отрицательные. Симптом Ортнера сомнительный. Селезенка не паль-пируется. Перитониальные симптомы отрицательные.
Из анамнеза: до обращения – жалоб не имела, по поводу заболеваний ЖКТ не наблюдалась. За период беременности прибавка массы тела на 24 кг. Во втором и третьем триместрах беременности впервые стала отмечать появление периодических болей в эпигастрии после еды. За медицинской помощью не обращалась, самостоятельно принимала Ренни. После родов за 1,5 месяца было три приступа интенсивных болей в эпигастральной области, которые купировала самостоятельно приемом но-шпы 80 мг. Вызвала бригаду скорой помощи, от госпитализации отказалась в связи с периодом грудного вскармливания и улучшения самочувствия после инъекции спазмолитика. По рекомендации врача скорой помощи 12.04.2009 обратилась для выполнения УЗИ органов брюшной полости, где впервые выявлены множественные мелкие конкременты желчного пузыря до 4 мм. На фоне соблюдения диеты № 5 самочувствие несколько улучшилось, интенсивность болей снизилась. Была консультирована хирургом, предложена холецистэктомия, от проведения которой пациентка отказалась. В связи с чем обратилась за консультацией к гастроэнтерологу для решения вопроса о возможности проведения терапевтического лечения ЖКБ.
Для уточнения диагноза и состояния пациентки были выполнены следующие лабораторно-инструментальные методы исследования:
- Клинический анализ крови – без отклонений от референтных значений.
- Биохимический анализ крови – незначительно выраженный синдром цитолиза: АЛТ – 61 ЕД/л, АСТ –35 ЕД/л (при норме до 31); синдром холестаза: ГГТП 50 ЕД/л (норма до 32), ЩФ 139 ЕД/л (норма до 120); изменений пигментного обмена не выявлено: общий билирубин – 9 мкмоль/л, в липидограмме отмечено незначительное повышение общего холестерина до 6,0 ммоль/л (при норме до 5,2); триглицериды – 1,8; ЛПВП – 1,53; ЛПОНП – 0,5; ЛНПН – 3,97; амилаза – 41 ммоль/л; сахар – 5,0; общий белок – 70 г/л.
- Маркеры гепатитов В и С – отри-цательные.
- Посев кала на дисбактериоз – снижение показателей нормальной микрофлоры (бифидо- и лакто-) на два порядка.
- С учетом анамнестических данных наличия болевого синдрома в эпигастральной области пациентке выполнено ФГДС. Заключение: гастропатия в фазе ремиссии, быстрый уреазный тест – НР (-).
- УЗИ ОБП – печень в размерах не увеличена, эхогенность незначительно повышена, эхоструктура однородная, мелкозернистая. Дистальное затухание звука не выражено. Воротная вена – 10 мм. Желчный пузырь правильной формы, 17 мл объем, стенки не утолщены, 2 мм. В полости визуализируются множественные мелкие подвижные конкременты до 3,5 мм с акустической тенью, занимающие по длине всю нижнюю стенку. Холедох – 3 мм (рис. 1–2).
- Для решения вопроса о возможности проведения литолитической терапии пациентке выполнено КТ желчного пузыря для оценки плотности камней по шкале Хаунсфилда. Заключение: Rg-контрастных конкрементов не выявлено (единичные мелкие включения до 2 мм до +89HU). Средняя плотность содержимого желчного пузыря +12HU. Рентгеноплотность печени +48-50HU, незначительно понижена (рис. 3).

Таким образом, у пациентки выявлены ЖКБ, хронический калькулезный холецистит вне обострения. НАЖБП, стеатогепатит умеренной степени активности (с синдромом цитолиза и холестаза). Жировой гепатоз 1-й степени. Хронический гастрит, НР-неассоциированный, ремиссия. Дисбактериоз кишечника 1-й степени.
По желанию пациентки и в связи с низкой рентгеноплотностью мелких конкрементов, что является показанием к терапевтическому литолизу, принято решение о проведении литолитической терапии ЖКБ. Грудное вскармливание прекращено в связи с минимальной лактацией. Пациентке назначена УДХК (Урсофальк, Dr. Falk Pharma GmbH, Германия) 750 мг на ночь ежедневно с целью проведения литолиза и гепатопротективной поддержки с учетом наличия НАСГ; Псилиум по 1 пакетику 3 раза в день в качестве пребиотика для коррекции липидного профиля и массы тела.
На фоне терапии при повторном исследовании через 2 месяца нормализовались показатели цитолиза и холестаза (АЛТ и АСТ снизились до 23, ГГТП до 13, ЩФ до 113, общий холестерин – 4,4), в посеве кала на дисбактериоз отклонений от нормы не выявлено. При контрольном УЗИ желчного пузыря отмечаются единичные мелкие хлопья густой желчи. Объем желчного пузыря увеличился до 32 мл (рис. 4–5). Ультразвуковые показатели печени остались без изменений. Принято решение о постепенном снижении дозы УДХК, отмене по 1 капсуле в месяц и назначении холеретика и холекенетика Хофитол для нормализации объема и улучшения оттока желчи по 2 таблетки 3 раза. Через 5 месяцев терапии ЖКБ не выявлено: густая желчь не визуализировалась, объем желчного пузыря нормализовался. Сонографических изменений паренхимы печени не выявлено. ИМТ снизился до 27,1. Далее пациентке были рекомендованы профилактические курсы Хофитола в течение 3–4 недель, 2 раза в год с динамическим УЗИ-контролем желчного пузыря с целью исключения рецидива ЖКБ. До 11.2015 жалоб не предъявляла, рецидива ЖКБ не было.
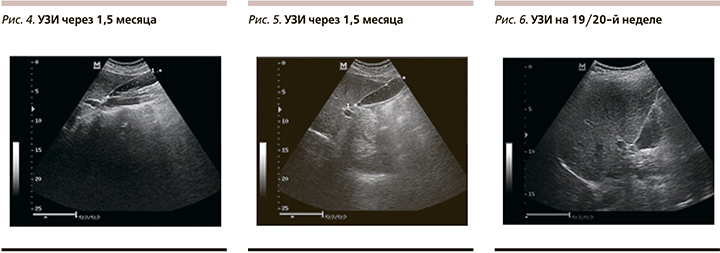
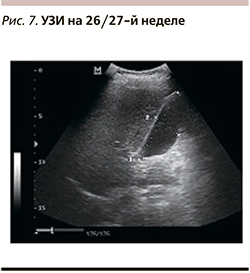
В 2015 г. для профилактического осмотра и консультации пациентка обратилась вновь. На момент осмотра определяется прогрессирующая 2-я беременность сроком 19/20 недель. При УЗИ выявлен рецидив ЖКБ: объем пузыря – 22 мл, единичные хлопья густой желчи (рис. 5). Жалоб нет. Стул 1 раз в сутки. На 26/27-й неделе: объем пузыря – 49 мл (рис. 7). Биохимические показатели печени в пределах нормы. Во время беременности литолиз препаратами УДХК не показан, в связи с чем назначен Хофитол по 2 таблетки 3 раза 1,5 месяца. При контрольном осмотре отмечается уменьшение объема пузыря до 35 мл, в полости пузыря сладж не визуализируется.
 С учетом наследственного фактора ЖКБ для профилактического осмотра обратилась мать пациентки. В анамнезе холецистэктомия в 2013 г. Жалобы на периодическое чувство горечи во рту, тяжесть в правом подреберье, вздутие живота преимущественно к вечеру, стул 1 раз в 2 дня самостоятельный, за последний год поправилась на 4 кг.
С учетом наследственного фактора ЖКБ для профилактического осмотра обратилась мать пациентки. В анамнезе холецистэктомия в 2013 г. Жалобы на периодическое чувство горечи во рту, тяжесть в правом подреберье, вздутие живота преимущественно к вечеру, стул 1 раз в 2 дня самостоятельный, за последний год поправилась на 4 кг.
При осмотре состояние удовлетворительное. Кожные покровы без особенностей. ИМТ – 27,8. Живот незначительно увеличен в объеме за счет подкожно-жировой клетчатки, распределение по мужскому типу, складка у пупка – 5 см. Язык обложен желтым налетом. Живот мягкий, умеренно болезненный во всех отделах. Печень выступает из-под края реберной дуги на 2 см, размеры по Курлову – 12×9×9 см. Селезенка не пальпируется. Перитонеальные симптомы отрицательные. В клиническом анализе крови патологии не выявлено, биохимический анализ крови: АЛТ – 57; АСТ – 68; ГГТП – 55; ЩФ – 128; холестерин общий – 7,1; триглицериды – 1,9; ЛПНП – 4,3; ЛПВП – 1,4; ЛНОНП – 0,6; амилаза – 63; СРБ – 4; КФК – 80; общий белок – 67; креатинин – 80; глюкоза – 5,7 ммоль/л.
В копрограмме: нейтральный жир – 1+, жирные кислоты – 2+, мыла – 1+, мышечные волокна без исчерченности – 1+, крахмал внутриклеточный – 1+, йодофильная флора – 1+. Эластаза в кале – 450. При УЗИ выявлены умеренная гепатомегалия, структура печени неоднородная, диффузно изменена, незначительное повышение эхогенности; отмечены дистальное затухание звука, воротная вена – 11 мм, желчный пузырь удален, холедох – 8 мм, визуализируемый участок без дополнительных эхопозитивных включений, диффузные изменения поджелудочной железы. МРХПГ – данных за наличие холедохолитиаза не получено. Диагноз: ПХЭС. ЖКБ, ХЭ в 2011 г. СИБР. Хроническая билиарная недостаточность легкой степени. НАЖБП. НАСГ умеренной активности. Жировой гепатоз 2-й степени. Гиперхолестеринемия.
Данный клинический пример иллюстрирует клинические особенности течения ЖКБ: образование сладжа и конкрементов в период беременности за счет ухудшения моторно-эвакуаторных механизмов желчного пузыря в связи с ростом плода, в комплексе с влиянием наследственной предрасположенности к ЖКБ, выраженной прибавки массы тела и гиперхолестеринемией, а также положительный эффект литолитической терапии на фоне адекватной дозы УДХК (Dr. Falk Pharma GmbH, Германия) и низкой плотности микролитов (особые формы билиарного сладжа), что является показанием к терапевтическому лечению по европейским рекомендациям EASL 05.2016, рекомендациям Американской ассоциации гастроэнтерологов 04.2016 и РГА 04.2012. Длительный период отсутствия адекватного лечения ЖКБ привел мать к холецистэктомии, а отсутствие терапии на всех этапах течения болезни способствовало развитию постхолецистэктомного синдрома, развитию и прогрессированию неалкогольной жировой болезни печени до НАСГ. Выявленные подобные изменения требуют длительного симптоматического лечения с использованием схем, предложенных в нашей статье.
Заключение
Подводя итог, необходимо отметить значимый рост заболеваемости НАЖБП, которая может протекать в сочетании с другими актуальными заболеваниями органов ЖКТ, способствуя их развитию и/или прогрессированию. Учитывая многофакторность этого заболевания, необходимо дальнейшее изучение этиопатогенетических механизмов взаимо-связи НАЖБП и ЖКБ, а также поиск универсальных методов диагностики и способов лечения. Одним из примеров удачной комбинации терапии является совместное применение УДХК, улучшающей реологические свойства желчи, и растительного препарата Хофитол, который выполняет роль «терапии сопровождения», нормализуя функцию билиарного тракта, тонус желчного пузыря и моторику тонкой кишки.



