Неалкогольная жировая болезнь печени (НАЖБП) включает стеатоз, неалкогольный стеатогепатит (НАСГ) и цирроз печени. Диагноз НАЖБП означает накопление липидов в печени ≥5%, по данным методов визуализации, в отсутствие других установленных причин жировой дегенерации печени, таких как прием алкоголя, вирусы, лекарственные препараты и аутоиммунные заболевания. В последнее время НАЖБП занимает лидирующее положение среди заболеваний печени. Она наблюдается у трети взрослого населения как в странах Западной Европы и США, так и в Российской Федерации. У большинства больных НАЖБП ассоциирована с метаболическим синдромом (МС) и может рассматриваться как один из его компонентов. У этих пациентов также имеются факторы риска развития сердечно-сосудистых заболеваний (ССЗ) [1–3]. НАЖБП рассматривают также как полисистемное заболевание, затрагивающее различные органы, в т.ч. и сердечно-сосудистую систему [3]. В настоящее время широко обсуждается роль НАЖБП как независимого фактора риска развития ССЗ и повышения смертности от ССЗ.
НАЖБП повышает показатель общей смертности на 57%, главным образом в связи с ССЗ или патологией печени [4].
Всесторонний мета-анализ 27 перекрестных исследований позволил выявить сильную связь между НАЖБП и некоторыми маркерами субклинического течения атеросклероза, такими как увеличение толщины комплекса интима-медиа сонных артерий (16 исследований), увеличение кальцификации коронарных артерий (7 исследований), нарушение вазодилатации (7 исследований) и жесткость артерий (6 исследований). Причем эта связь не зависела от классических факторов риска ССЗ и признаков МС у пациентов [5].
Исследование, проведенное в США и охватившее более 11 тыс. взрослых, показало, что НАЖБП связана с повышенной распространенностью ССЗ независимо от многочисленных факторов риска ССЗ [6]. В то же время авторами сделан вывод, согласно которому НАЖБП не является прогностическим фактором риска общей смертности и смертности от различных заболеваний, по данным 14-летнего периода наблюдения, что могло быть связано с включением в контрольную группу лиц с незначительно выраженным стеатозом. Анализ этой базы данных, проведенный позднее, выявил, что выраженный фиброз при НАЖБП независимо связан с увеличением общей смертности на 69% в основном за счет смертности от ССЗ [7].
При сахарном диабете 2 типа (СД2) заболевания коронарных и церебральных артерий чаще встречаются при наличии НАЖБП независимо от традиционных факторов риска ССЗ и применения лекарственных препаратов. При анализе данных пациентов, направленных на проведение коронарографии, оказалось, что НАЖБП независимо связана с более тяжелым течением ишемической болезни сердца – ИБС [8].
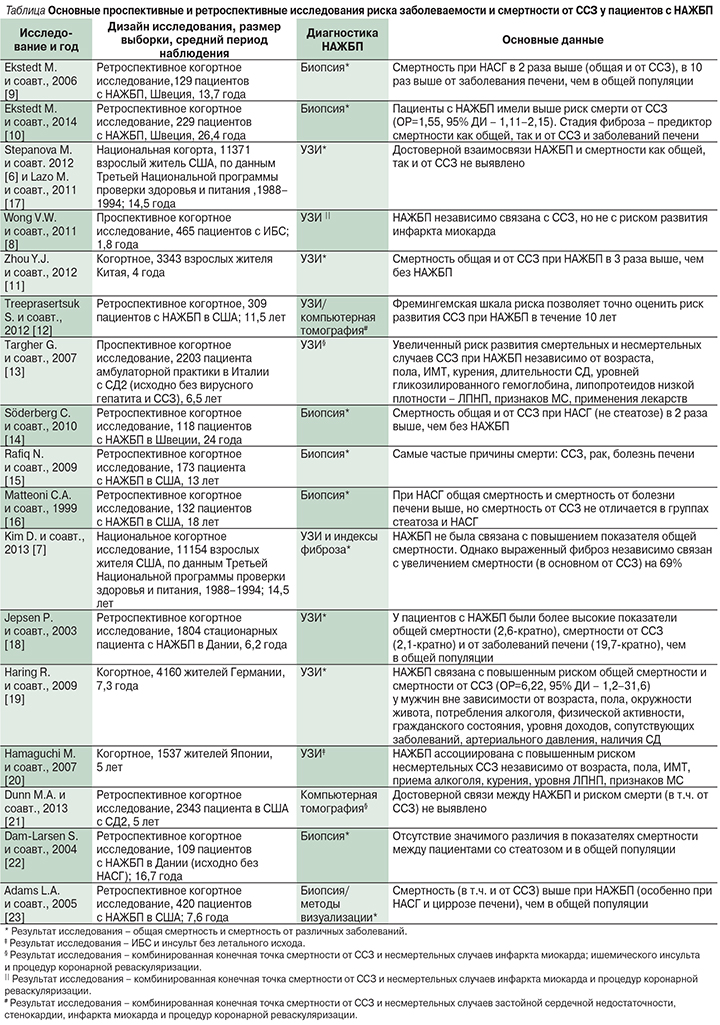
Данные ретроспективных и проспективных исследований, оценивавших связь между НАЖБП и риском развития ССЗ [6, 8–23], приведенные в таблице, в большинстве своем подтверждают, что ССЗ представляют собой серьезную угрозу для пациентов с НАЖБП.
Исследования, в которых диагноз НАЖБП ставился на основании повышения уровня печеночных проб, т.е. суррогатных маркеров заболевания, показали, что умеренное повышение уровня печеночных проб служит независимым предиктором развития ССЗ как у мужчин, так и у женщин [3, 24].
Ретроспективные исследования, в которых НАЖБП диагностировали по данным биопсии печени, свидетельствуют о том, что общая смертность, смертность от ССЗ и заболевания печени были значительно выше у пациентов с НАЖБП, чем в контрольной группе. Оказалось, что наличие и степень тяжести фиброза печени служат основным фактором, определяющим смертность этих больных. Кроме того, очень часто причиной их смерти выступали ССЗ. Именно пациенты с НАСГ, а не с простым стеатозом имеют повышенный по сравнению с референсной группой риск смерти как общей, так и от ССЗ [9, 14].
Исследования, в которых диагноз НАЖБП устанавливался на основании данных методов визуализации, показали, что НАЖБП связана с повышенным риском развития ССЗ вне зависимости от установленных факторов риска ССЗ и наличия СД2.
Мета-анализ, опубликованный в 2011 г., показал, что у пациентов с НАЖБП риск развития ССЗ в два раза выше, чем в контрольной группе (относительный риск [ОР]=2,05, 95% доверительный интервал [ДИ] – 1,81–2,31), однако смертность от ССЗ не определяется выраженностью гистологических изменений в печени [4].
Данные ряда исследований подтверждают, что НАЖБП связана с изменениями метаболизма миокарда. Так, по данным магнитно-резонансной томографии (МРТ), у молодых людей с НАЖБП без ожирения, СД, с нормальными показателями артериального давления имело место нарушение метаболизма энергии в миокарде и избыточное отложение жира в эпикарде по сравнению с контрольной группой. Что любопытно: эти изменения не сопровождались структурными аномалиями миокарда левого желудочка (ЛЖ) и изменениями систолы или диастолы [25]. Оказалось, что у пациентов с СД2 с более высоким содержанием липидов в печени, по данным магнитно-резонансной спектроскопии, инсулинорезистентность миокарда выше, а перфузия ниже по сравнению с пациентами с меньшим содержанием жира в печени [26]. Более значимое накопление липидов в миокарде (стеатоз сердца) отмечен у пациентов с более выраженным накоплением липидов в печени. Стеатоз сердца оказался предиктором диастолической дисфункции ЛЖ [26].
Масса публикаций посвящена связи НАЖБП и структурных и функциональных аномалий сердца как при наличии признаков МС, так и без таковых [24]. Описаны значительные изменения структуры сердца и признаки ранней диастолической дисфункции ЛЖ при НАЖБП по сравнению с контрольной группой в отсутствие изменений метаболизма миокарда или явного заболевания сердца [27]. У пациентов с СД2 и НАЖБП без ССЗ обнаружены ранние признаки диастолической дисфункции ЛЖ при нормальной структуре сердца и систолической функции ЛЖ [28]. Выраженность диастолической дисфункции коррелировала со степенью тяжести НАЖБП, по данным ультразвукового исследования (УЗИ), независимо от наличия артериальной гипертензии, уровня контроля гликемии и других сопутствующих факторов риска ССЗ [28]. По данным корейских авторов, НАЖБП связана с диастолической дисфункцией ЛЖ независимо от признаков МС и других установленных факторов риска ССЗ [29].
Изменения со стороны миокарда возникают задолго до развития цирроза и портальной гипертензии у больных НАЖБП, следовательно, изменения со стороны сердца могут и не быть следствием изменений внутрипеченочной гемодинамики. У пациентов с НАЖБП отмечаются ранние изменения субстратного метаболизма миокарда (нарушение метаболизма высокоэнергетических фосфатов, инсулинорезистентность), что вызывает функциональные и структурные изменения сердца (дисфункцию и гипертрофию ЛЖ), потенциально с повышенным риском застойной сердечной недостаточности у этих больных. Как было показано S.G. Wannamethee, сердечная недостаточность чаще возникает при наличии НАЖБП [30].
Фрамингемское исследование продемонстрировало, что незначительное повышение уровня печеночных трансаминаз независимо связано с повышенной частотой развития такого грозного осложнения, как фибрилляции предсердий (ФП) [31]. Аналогичная связь между повышенными уровнями ферментов в сыворотке и риском ФП была отмечена в большом проспективном исследовании, включившем более 9000 человек, которые находились под наблюдением в среднем в течение 12 лет [32]. В исследовании случай/контроль обнаружено, что НАЖБП связана с повышенной распространенностью ФП у пациентов с СД2 и эта связь не зависела от клинических факторов риска ФП [33]. В проспективном исследовании обнаружено, что у пациентов с СД2 и НАЖБП в течение 10-летнего периода наблюдения чаще развивается ФП, чем у пациентов без НАЖБП. Риск развития ФП при НАЖБП был повышен в 5 раз независимо от наличия признаков МС и других факторов риска ФП [34].
НАЖБП также независимо связана с удлинением интервала QT, значимого прогностического фактора желудочковых аритмий и внезапной сердечной смерти, что также может отчасти объяснять повышенную смертность от ССЗ при НАЖБП [35].
Последний мета-анализ G. Targher и соавт., опубликованный в 2016 г., обобщил данные 16 проспективных и ретроспективных исследований с общим числом участников более 34 тыс. человек (36,3% с НАЖБП, медиана наблюдения – 6,9 года) [36]. Авторы пришли к выводу, что НАЖБП связана с увеличением числа ССЗ как со смертельным исходом, так и без такового. Риск развития ССЗ увеличивался по мере прогрессирования заболевания печени. Наблюдательный дизайн проанализированных исследований не позволил получить доказательств того, что жировая болезнь печени служит причиной развития ССЗ.
Таким образом, приведенные в обзоре данные свидетельствуют о тесной взаимосвязи НАЖБП, ССЗ и смертности от ССЗ. НАЖБП выступает независимым фактором, вносящим свой вклад в развитие и прогрессирование ССЗ, в т.ч. и в формирование структурно-функциональных нарушений сердца (дисфункции и гипертрофии ЛЖ, ФП и пр.). Клиницистам целесообразно не только сосредоточивать усилия на заболевании печени у пациентов с НАЖБП, но и проводить раннюю оценку факторов риска ССЗ с целью их возможной модификации. Также важно и, наоборот, занимаясь пациентом с ССЗ, не забывать о возможности наличия у него НАЖБП, которая отягощает течение кардиоваскулярной патологии. Поэтому с клинической точки зрения, диагностировав НАЖБП у такого пациента, необходимо назначить соответствующую терапию и для печени. Не зря подобный «перекрестный» скрининг (у пациентов с НАЖБП на МС и ССЗ, а у пациентов с МС и/или ССЗ на НАЖБП) входит в современные международные рекомендации по диагностике и лечению НАЖБП [37]. В дальнейшем для точной оценки причинно-следственных взаимосвязей НАЖБП и ССЗ и рассмотрения механизмов развития этих связей нужны дополнительные контролируемые проспективные исследования.



