Введение
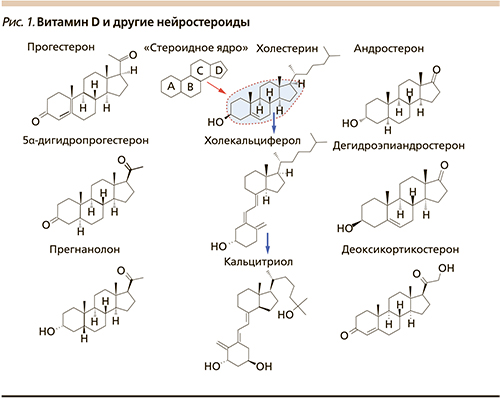
Нейростероиды – стероидные гормоны, активность которых принципиально необходима для развития мозга ребенка по оптимальной программе и затем для функционирования нервной системы в течение жизни. Известные нейростероиды включают производные прогестерона, андростерона и кортикостероиодов (рис. 1).
Каждый из этих стероидных гормонов активирует специфический внутриядерный рецептор и контролирует транскрипцию многих генов, необходимых для развития и функционирования мозга [1].
Полученные за последние 10 лет данные фундаментальных и клинических исследований неопровержимо показывают, что витамин D является нейростероидом. Начиная с внутриутробного периода витамин D – важный модулятор развития мозга. Хронически недостаточное потребление витамина D, в особенности на фоне низкой инсоляции, нарушает программу развития центральной нервной системы (ЦНС) и повышает риск формирования психоневрологических расстройств. Как нейростероид витамин D необходим для деления, роста и дифференциации нейронов, а также проявляет нейропротективный и нейротрофический эффекты.
Поэтому обеспеченность витамином D влияет на развитие и функционирование мозга. Активные формы витамина D участвуют в передаче Са2+-зависимых сигналов между нейронами и регулируют синаптическую пластичность, экспрессию нейротрофических факторов [2], противовоспалительных цитокинов, синтез нейромедиаторов, антиоксидантную активность клеток [3]. Наиболее известные молекулярные и клеточные эффекты витамина D как нейростероида суммированы в табл. 1.
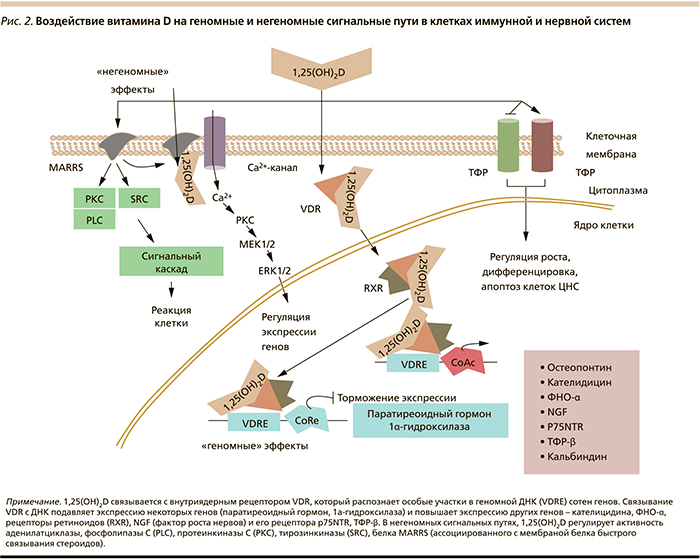
На молекулярном уровне нейростероидные эффекты воздействия витамина D на нейроны подразделяются на геномные (т.е. осуществляемые посредством рецептора витамина D) и на негеномные (осуществляемые посредством модуляции внутриклеточных сигнальных путей) [2] (рис. 2).
Дефицит витамина D ассоциирован со снижением темпов нервно-психического развития детей [5] с широким диапазоном неврологических и нейродегенеративных заболеваний [6]. Неврологические расстройства, связанные с дефицитом витамина D, включают нарушения мозгового кровотока [7], снижение памяти и когнитивные нарушения [8], склонность к атеросклерозу и судорогам [9], а нейродегенеративные – рассеянный склероз (в т.ч. более высокую частоту рецидивов и большее число поражений, устанавливаемых с помощью магнитно-резонансной томографии), болезнь Альцгеймера, болезнь Паркинсона [10].
Поиск по базе данных научных публикаций PubMed указал на наличие более 65 тыс. статей, посвященных витамину D, причем более 2100 работ непосредственно связаны с исследованием нейростероидной роли витамина. Для выделения релевантных публикаций в таком достаточно большом массиве данных были использованы математические методы распознавания, разрабатываемые в научной школе академика Ю.И. Журавлева [11]. Были оценены степени ассоциированности ключевых слов «vitamin D», «calcitriol», «alfacalcidol», «hydroxyvitamin D», «dihydroxyvitamin», «elocalcitol», «cholecalciferol» со всеми остальными терминами на основе анализа совместного вхождения терминов в предложения текстов исследуемого массива публикаций.
Результаты и обсуждение
В базе данных PubMed было найдено 65 585 публикаций по витамину D и 1 188 746 – по нейростероидам. Нейростероидные эффекты витамина D были затронуты в 1984 статьях.
В результате анализа был получен список из наиболее информативных терминов, ассоциированных с описанием нейростероидных ролей витамина D (табл. 2). С использованием ключевых слов, установленных при проведении компьютерного анализа текстов этих публикаций было отобрано 223 репрезентативные публикации по нейростероидным ролям витамина D.
В соответствии с кластерным анализом информативных ключевых слов пренатальный дефицит витамина D оказывает негативное действие на развитие головного мозга. Нейростероидные роли витамина подразумевают, что активные формы витамина D (кальцитриол, дигидроксивитамин) образуются в головном мозге из холекальциферола. Как нейростероид витамин D регулирует активность других нейростероидов, вовлечен в осуществление эффектов ретиноидов, нейропротекцию (в т.ч. за счет регуляции иммунных реакций) и важен для синтеза нейротрансмиттеров. Витамин D регулирует секрецию слюны из околоушной железы, что, отметим, весьма важно для усвоения микронутриентов у детей.

Витамин D как нейростероид: основные направления исследований
Проведенный анализ публикаций показал, что у детей на фоне длительного дефицита витамина D формируются неблагоприятные психоневрологические фенотипы. В эксперименте дефицит витамина D приводил к снижению уровней нейротрофических факторов в мозге новорожденных (мРНК NGF, его рецептора p75NTR и GDNF); нарушениям метаболизма дофамина (снижение биотрансформации дофамина в гомованилиновую кислоту, снижение экспрессии COMT – Catechol-O-methyl transferase); ухудшению исследовательской активности, замедлению выполнения тестов в 5-дневном тесте; повышению чувствительности ЦНС к амфетамину (опорно-двигательные нарушения) [1].
Отнесение витамина D к нейростероидам не только основано на структуре молекулы (включающей стероидное ядро, рис. 1) но и подтверждается комплексом следующих научных фактов:
- биосинтез активной формы витамина D в головном мозге;
- экспрессия рецепторов VDR в мозге;
- воздействие активированных VDR-рецепторов на биосинтез дофамина;
- регуляция нейротрофических факторов;
- нейропротекция;
- ассоциации дефицита витамина D с рядом нейропатологий и когнитивных нарушений.

Во-первых, активные формы витамина синтезируются в головном мозге в значительных количествах. В мозге кальцитриол (1,25-дигидроксивитамин D3) синтезируется из холекальциферола в два этапа: сначала осуществляется гидроксилирование холекальциферола посредством 25-гидроксилазы (Cyp2R1), затем посредством 25-гидроксивитамин D3 1α-гидроксилазы (Cyp27B1). Гены CYP2R1 и CYP27B1 экспрессируются в клетках головного мозга (перициты). Уровень экспрессии этих важнейших генов метаболизма витамина D повышается при воздействии ФНО-α и интерферона γ – факт, указывающий на существование аутокринной/паракринной витамин-D-зависимой системы гормональной регуляции в ЦНС. Таким образом, в мозге существуют ферментные системы, локально изменяющие уровень и доступность активной формы витамина D [12].
Во-вторых, VDR-рецепторы 1,25(OH)2D3 экспрессируются во всех отделах головного мозга [13]. В частности, наиболее высокие уровни экспрессии VDR отмечены в больших нейронах черной субстанции, одной из самых больших групп дофаминергических нейронов, контролирующих тонкую моторику ребенка.
В-третьих, активация рецепторов VDR непосредственно стимулирует биосинтез дофамина в мозге. Активная форма витамина (1,25(OH)2D3) увеличивает экспрессию тирозингидроксилазы в медуллярных клетках надпочечников [14] – фермента, от которого зависит скорость синтеза дофамина в ткани мозга.
В-четвертых, 1,25(OH)2D3 регулирует нейротрофические каскады, важные для выживания и миграции развивающихся нейронов в головном мозге и обеспечивающие построение сложной цитоархитектоники коры [15]. Эта регуляция осуществляется, в частности, путем регулирования экспрессии GDNF, NGF и рецептора NGF. GDNF также является важным модулятором развития дофаминергических нейронов [16].
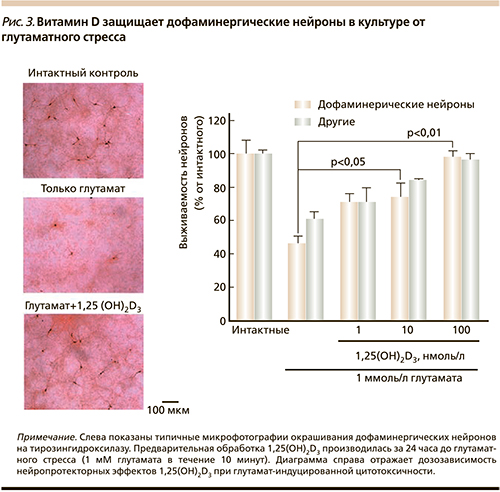
В-пятых, 1,25(OH)2D3 проявляет выраженное нейропротекторное действие (в частности, за счет иммунорегуляторных свойств – подавления провоспалительных цитокинов, индукции противовоспалительного прогестерона и т.д.) [17]. Например, предварительная обработка нейронов 1,25(OH)2D3 уменьшает глутамат-опосредованную гибель нейронов в культуре [18].
В-шестых, дефицит витамина D связан с рядом неблагоприятных неврологических состояний, включая депрессию, снижение когнитивных способностей (обусловленных, в частности, влиянием витамина D на метаболизм нейромедиатора дофамина), в то время как лечение препаратами витамина D служит эффективным средством профилактики этих состояний [12]. Так, низкие уровни витамина D у матери представляют собой фактор риска развития шизофрении у детей, склонность к суициду. Новорожденные с низким уровнем 25(OH)D характеризуются в 2 раза более высоким риском развития шизофрении в дальнейшей жизни [19]. Риск развития шизофрении снижается при получении адекватных доз витамина D хотя бы в течение первого года жизни [20]. Лечение витамином D также способствует снижению проявлений депрессии при сезонных аффективных расстройствах [21].
Далее последовательно рассматриваются нейростероидные влияния витамина D на метаболизм дофамина и других нейротрансмиттеров, нейротрофические факторы, на торможение нейродегенерации и синергизм с другими нейростероидами.

Нейростероидные влияния витамина D на метаболизм дофамина и других нейротрансмиттеров
Нейромедиатор дофамин вырабатывается в головном мозге и принципиально важен для обеспечения когнитивной деятельности. При недостаточном биосинтезе дофамина у детей отмечается замедленность когнитивных процессов (брадифрения), повышенная инертность, нарушается процесс переключения внимания с одного этапа когнитивной деятельности на другой, нарушается тонкая моторика (в частности, навыки письма). В результате снижается способность ребенка к обучению. В подростковом возрасте нормальный метаболизм дофамина существенно повышает устойчивость к формированию зависимостей (алкогольной, наркотической, никотиновой и др.).
 Воздействие витамина D на метаболизм дофамина является одним из наиболее изученных нейростероидных эффектов витамина D. Эти эффекты связаны с воздействием активной формы витамина, кальцитриола, на экспрессию гена основного фермента биосинтеза дофамина – тирозингидроксилазы (ген ТГ). Максимальное увеличение экспрессии гена ТГ (в 2–3 раза) отмечено при концентрации 1,25(OH)2D около 10– 8 M.
Воздействие витамина D на метаболизм дофамина является одним из наиболее изученных нейростероидных эффектов витамина D. Эти эффекты связаны с воздействием активной формы витамина, кальцитриола, на экспрессию гена основного фермента биосинтеза дофамина – тирозингидроксилазы (ген ТГ). Максимальное увеличение экспрессии гена ТГ (в 2–3 раза) отмечено при концентрации 1,25(OH)2D около 10– 8 M.
Комбинированное воздействие 1,25(OH)2D3 и 20 мкМ никотина не имело аддитивного эффекта на экспрессию гена ТГ, что указывает на взаимосвязь механизма активации экспрессии этого гена с никотиновыми рецепторами ацетилхолина [21].
Предварительная обработка нейронов в культуре посредством 1,25(OH)2D3 дозозависимо защищает дофаминергические нейроны от нейротоксического действия глутамата и других дофаминергических токсинов (в частности, при снижении окислительного стресса) [22] (рис. 3).
1,25(ОН)2D проявляет антиоксидантный эффект и снижает токсическое действие прооксидантных молекул L-бутионин сульфоксимина (BSO) и 1-метил-4-фенилпиридина (MPP) на дофаминергические нейроны среднего мозга [23].
Активная форма витамина D защищает мозг от нейротоксических доз метамфитамина, который, как известно, приводит к снижению уровней дофамина и серотонина. У животных, получавших метамфитамин и плацебо, были отмечены значительные снижения уровней дофамина и серотонина в стриатуме и accumbens. У животных, получавших метамфитамин и кальцитриол, это снижение существенно сократилось [24]. Таким образом, дефицит витамина D создает условия для быстрого формирования зависимости и развития нейротоксических эффектов метамфитамина.
Кроме дофамина и серотонина витамин D играет определенную роль в регулировании уровней и других моноаминовых нейротрансмиттеров. Например, экспериментальный дефицит витамина D был ассоциирован со значительным уменьшением уровней эндогенного норадреналина, причем нарушение синтеза/секреции норадреналина связано с нарушениями регуляции уровней кальция в нейронах [25]. Сниженные уровни эндогенного норадреналина ассоциированы с падением когнитивного потенциала, алекситемией, обедненными эмоциональным фоном.
Нейростероидные воздействия витамина D на нейротрофические факторы и нейропротекцию
Внутриутробный период развития мозга и период раннего детства отличаются огромным потенциалом нейропластичности, требующей достаточного синтеза нейротрофических факторов. Спектр действия нейротрофических факторов чрезвычайно широк (рис. 4). Например, описанные выше эффекты воздействия витамина D на метаболизм дофамина неразрывно связаны с повышением экспрессии GDNF, который имеет существенное влияние на синтез дофамина в полосатом теле. В эксперименте дозы кальцитриола в 1,0 и 3,0 мкг/кг/сут в течение 8 дней приводили к увеличению экспрессии GDNF в стриатуме и улучшению секреции дофамина (при стимуляции секреции посредством калия) [26].
Стимулируемая кальцитриолом защита мозга от потерь дофамина происходит на фоне нормализации уровней нейротрофических факторов GDNF и BDNF – brain-derived neurotrophic factor (рис. 5), особенно при длительном применении кальцитриола до создания модели поражения дофаминергических нейронов [27].
Нейропротекторное действие витамина D включает не только нейротрофический эффект (стимулирование синтеза/секреции нейротрофинов), но и регуляцию уровней ионов Са2+ (вовлеченных, как известно, в процессы апоптоза), антиоксидантные и нейроиммуномодуляторные эффекты [28]. Такое комплексное нейропротекторное действие витамина D особенно важно для детей, страдающих детским церебральным параличом, синдромом дефицита внимания с гиперактивностью и для компенсации последствий черепно-мозговой травмы. При этих заболеваниях у детей отмечаются хронически повышенный оксидативный стресс в нейронах ЦНС, нарушения иммуномодуляции, недостаточная регенеративная способность мозга.
Нейростероид витамин D способствует выживанию сетей нейронов при стрессовом воздействии. Развитые нейрональные сети являются необходимым условием для формирования ассоциативного мышления, беглости речи, успешного обучения. Нейроны гиппокампа в культуре, обработанные в течение нескольких дней 1,25(ОН)2D в концентрациях 1–100 нмоль/л, характеризовались на 30–40% более высокой выживаемостью по сравнению с плацебо [29].
Антиоксидантный эффект витамина D в нейропротекции. При 4-часовой выдержке гомогенатов мозга при 37°С увеличивается образование производных малонового альдегида, известного индикатора перекисного окисления липидов. Инкубация с витамином D3 дозозависимо подавляла этот процесс, причем антиоксидантная активность уменьшалась в ряду витамин D3>тролокс (водорастворимый аналог витамина Е)>β-эстрадиол>мелатонин [30].

Противовоспалительный эффект витамина D в нейропротекции. В экспериментальной модели стеатогепатоза холекальциферол снижает воспаление, улучшает когнитивную дисфункцию на фоне снижения уровней ФНО-α в мозге [31]. Установлена ассоциация между статусом витамина D и маркерами сосудистого здоровья у пациентов с синдромом хронической усталости и миалгическим энцефаломиелитом [32]. В экспериментальном аллергическом энцефаломиелите витамин D снижает уровни сфингозин-1-фосфата в сыворотке и спинномозговой жидкости [33], т.е. проявляет противовоспалительные свойства.
Интересно отметить, что нейростероидные роли витамина D синергидны с витамином В8 (миоинозитолом). Так, показано участие миоинозитол-зависимой фосфатидилинозитол-3-киназы (PI3-K) в нейропротективных эффектах активных форм витамина D [34].
Описанное выше комплексное нейропротекторное воздействие витамина D позволяет предположить, что включение витамина D в комплексную программу терапии пациентов с менингитом, энцефаломиелитом и другими неврологическими заболеваниями с ярко выраженными воспалительным и оксидативным компонентами может быть весьма перспективным.
 Синергизм витамина D с другими нейростероидами
Синергизм витамина D с другими нейростероидами
Другой важной ролью витамина D как нейростероида является синергизм с другими нейростероидами. Например, терапевтический эффект нейростероида прогестерона при лечении черепно-мозговой травмы [35] наблюдается только при достаточной обеспеченности витамином D [36].
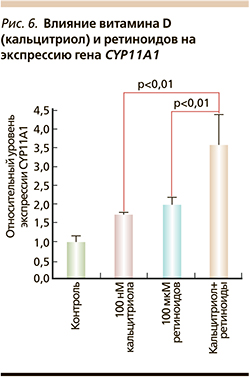
Витамин D также стимулирует ретиноид-зависимый биосинтез нейростероидов. В глиальных клетках витамин D повышает уровни экспрессии генов биосинтеза прогестерона, активируемых ретинолом, – митохондриального цитохрома P450scc (CYP11A1) и 3β-гидроксистероиддегидрогеназы (HSD3B1). В процессе биосинтеза прогестерона CYP11A1 расщепляет холестерин и катализирует синтез прегненолона, а HSD3B1 преобразует прегненолон в прогестерон [37]. Таким образом, синергизм между прогестероном, ретиноидами и витамином D очевиден. Например, 2-кратное увеличение экспрессии гена CYP11A1 при добавлении 10 мМ ретиноевой кислоты увеличивается еще в 1,8 раза при добавлении 100 нМ кальцитриола (рис. 6).
Сочетанное применение нейростероидов прогестерона и витамина D способствует улучшению состояния пациентов с черепно-мозговой травмой. В рандомизированном исследовании пациентов с тяжелой черепно-мозговой травмой (исходный балл по шкале комы Глазго<8, n=60), оценка по шкале комы через 3 месяца после лечения увеличивалась на +5,3±3,2 балла при совместном применении, на +3,9±2,1 балла при применении только прогестерона и только на +2,8±2,0 балла в группе плацебо (р=0,001) [38].
В эксперименте и в клинике комбинированная терапия прогестероном и витамином D более эффективна, чем монотерапия прогестероном, для предотвращения последствий ишемии. Сочетанное применение этих стероидных гормонов стимулирует активность нейротрофического фактора мозга (BDNF) за счет активации тирозин-киназного рецептора BDNF (trkB) и путей выживания нейронов ERK1/2 [39]. Синергизм между прогестероном и витамином D дозозависим: оптимально сочетание 20 мкмоль/л прогестерона и 20 нмоль/л витамина D (рис. 7).
Другие нейростероидные эффекты витамина D
Следует отметить, что сухость во рту отмечается при субфебрильной температуре, сахарном диабете, менингите и других нейроинфекциях. Важно иметь в виду, что сахарный диабет и нейроинфекции – состояния, ассоциированные с хроническим дефицитом витамина D [40].
Секреция слюны по объему и концентрации амилазы регулируется парасимпатической и симпатической ветвями вегетативной нервной системы. Парасимпатическая иннервация (черепно-мозговые нервы) стимулирует секрецию ацетилхолина и вещества Р, активирующие сигнальные молекулы инозитолмонофосфатов в слюнных железах. Симпатическая иннервация (преганглионарные вегетативные волокна) связана с секрецией норадреналина, которая воспринимается β-адренергическими рецепторами на слюнных железах. Достаточная обеспеченность витамином D необходима для поддержания этих механизмов регуляции слюноотделения.
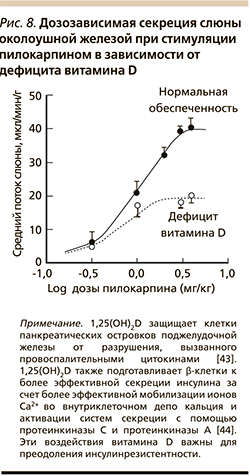
В эксперименте дефицит витамина D приводит к уменьшению секреции слюны околоушными железами. Пилокарпин-стимулируемый поток слюны был снижен на 57% на фоне дефицита витамина D (рис. 8), хотя секреция амилазы не изменилась. Было установлено, что нарушение секреции возникало не вследствие вторичных причин (гипокальциемия, гиперпаратиреоз), а стало прямым следствием дефицита витамина D. Дотации витамина D3 нормализовали уровни секреции слюны [41, 42]. Нормализация слюноотделения витамином D имеет большое значение для всасывания многих микронутриентов (в частности, кальция и самого витамина D, цинка, магния, витамина С и др.) начиная с ротовой полости.
1,25(ОН)2D защищает клетки панкреатических островков поджелудочной железы от разрушения, вызванного провоспалительными цитокинами [43]. 1,25(OH)2D также подготавливает β-клетки к более эффективной секреции инсулина за счет более эффективной мобилизации ионов Ca2+ во внутриклеточном депо кальция и активации систем секреции с помощью протеинкиназы C и протеинкиназы А [44]. Эти воздействия витамина D важны для преодоления инсулинрезистентности.
О препаратах витамина D для нейропедиатрических применений
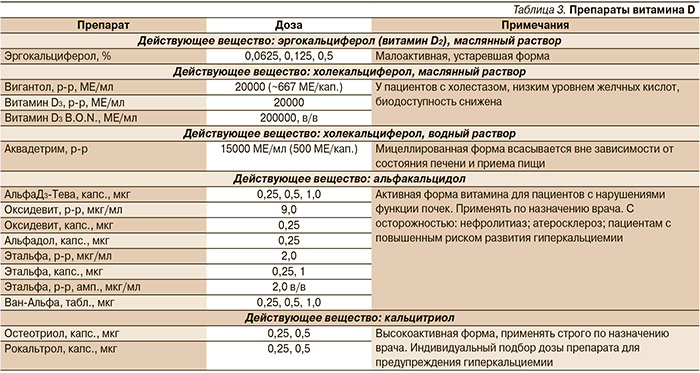
В педиатрии и в терапии гораздо более востребованы препараты витамина D3 (холекальциферол), который, являясь провитамином (пролекарством), конвертируется в активную форму гормона (кальцитриол) в необходимых организму количествах. Препараты на основе холекальциферола делятся на две группы: витамин D3 в масляном растворе и водный раствор мицеллированного витамина D3 (табл. 3).
Мицеллированная форма витамина D3 важна потому, что физиологическое усвоение витамина D3 в кишечнике происходит только при участии желчных кислот (что подразумевает образование мицелл). У пожилых, пациентов с муковисцидозом, холестазом и с другими нарушениями печени (стеатогепатитом и др.) или при соблюдении определенных диет, секреция желчных кислот снижается. Это затрудняет мицеллообразование и, следовательно, резко снижает усвоение витамина D (в т.ч. из маслянных растворов) и других жирорастворимых витаминов.
Мицеллированные («водорастворимые») растворы витамина D (Аквадетрим) обеспечивают хорошую степень всасывания практически во всех возрастных группах пациентов (дети, взрослые, пожилые) с минимальной зависимостью от состава диеты, приема препаратов, состояния печени и биосинтеза желчных кислот.
Заключение
В настоящей работе показано, что витамин D является полноценным нейростероидом, т.к. активные формы витамина D синтезируются в ЦНС, рецепторы витамина D повсеместно встречаются в ЦНС, активированные рецепторы витамина D принципиально важны для биосинтеза дофамина, витамин D осуществляет регуляцию нейротрофических факторов и проявляет нейропротекторные эффекты. Наличие у витамина D нейростероидных ролей обозначает новые, не используемые ранее направления клинического применения препаратов витамина D.
Очевидно, что в настоящее время лечение гипоксических состояний мозга, детского церебрального паралича, детских инсультов, черепно-мозговой травмы, нейроинфекций, как правило, не включает целевого включения препаратов витамина D в программу лечения. Вследствие комплексного воздействия витамина D как нейростероида, применение препаратов витамина D этим группам пациентов является неиспользуемым резервом нейропротекции, нейрореабилитации и иммунотерапии. Кроме того, достаточная обеспеченность витамином D во внутриутробном периоде и в раннем детстве принципиально важна для развития способности к обучению, ассоциативного мышления, формирования тонкой моторики. Контроль витамином D качества и количества слюнообразования имеет принципиальное значение для более полного всасывания микронутриентов.
Неврологическое применение витамина D подразумевает долговременный прием препаратов (не менее 6–12 месяцев). Проведенный нами ранее анализ данных результативных клинических исследований позволил сформулировать следующую ступенеобразную схему назначения витамина D: дети до 4 месяцев нуждаются в ежедневном приеме 500 МЕ/сут витамина D (для недоношенных – 800–1000 МЕ/сут); дети от 4 месяцев до 4 лет – 1000 МЕ/сут; от 4 до 10 лет – 1500 МЕ/сут, а старше 10 лет – 2000 МЕ/сут в течение всего года без перерыва на летние месяцы. При использовании такого рода режимов приема препарата (длительность курса, суточная доза) не наблюдается побочных эффектов.
Напомним, что уровни витамина D в плазме крови менее 10 нг/мл соответствуют глубокому дефициту и авитаминозу, уровни 10–20 нг/мл соответствуют дефициту витамина D, уровни 20–30 нг/мл – недостаточности витамина D, а уровни более 30 нг/мл – нормальному содержанию витамина D. По данным крупномасштабных скринингов, проведенных российскими исследователями, нормальное содержание витамина D в крови наблюдается менее чем у 10% детей [45–47].



