Введение
Депрессия – одно из наиболее часто встречающихся расстройств сознания у пациентов, оказывает существенное негативное влияние на качество жизни, течение соматических заболеваний и когнитивные функции [1, 2]. Патофизиология депрессии многообразна и включает изменения в моноаминергической передаче мозга, нарушения работы нейротрансмиттерных рецепторов, снижение содержания нейротрофических факторов, повышение содержания провоспалительных цитокинов, оксида азота, а также нарастание окислительного стресса [3, 4]. Многие из упомянутых выше процессов напрямую связаны с состоянием метаболизма и уровнем окислительного фосфорилирования в митохондриях нейронов. Поэтому представляется обоснованным рассматривать повреждение данных органелл как одно из определяющих в формировании и развитии нейродегенеративных изменений мозга.
В многочисленных клинических и биомедицинских исследованиях показано, что нарушения функций митохондрий представляют собой важную составляющую патогенетических процессов на молекулярном уровне при таких психических заболеваниях, как депрессия, биполярные расстройства, шизофрения, психозы, тревожные и пограничные состояния [4, 5].
Медикаментозное лечение пациентов, страдающих вышеупомянутыми заболеваниями, должно приводить к улучшению состояния митохондриального окислительного фосфорилирования. Данный подход уже рассматривается как возможное направление создания новых психотропных лекарственных средств [7]. Необходимо отметить, что применение трициклических антидепрессантов в модельных системах in vitro приводит к разобщению митохондрий и ингибированию первого ферментного комплекса дыхательной цепи [8, 9]. В то же время длительный прием препаратов in vivo может сопровождаться улучшением биоэнергетических параметров выделенных образцов митохондрий [10], а также проявлением антиоксидантного эффекта [11], что звучит парадоксально, если учитывать специфическое усиление производства активных форм кислорода и усиление окислительного стресса именно при ингибировании митохондриального комплекса I [12, 13].
В данной работе была поставлена цель получить возможные объяснения данного противоречия, используя подходы математического моделирования.
Материал и методы
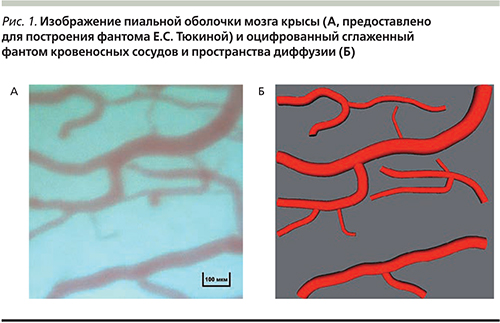
В качестве биологического объекта для построения виртуального фантома использовались изображения пиальных оболочек мозга крысы, полученные с помощью фотографии прижизненных образцов оперированного животного. Данный метод получения изображения описан ранее [14]. Его оцифровка и формирование области источника (область сосудов) и области диффузии имипрамина позволяют создавать трехмерный компьютерный фантом, изображенный на рис. 1. Сосуды представлялись в виде объединения некоторого количества элементарных сферических источников.
Методика построения фантома для последующих расчетов диффузии метаболитов подробно описана ранее [15, 16]. Пространственно-временные распределения концентрации трициклического антидепрессанта ([I](r,t)) получали с помощью суперпозиций аналитических решений второй краевой задачи для трехмерного уравнения диффузии от сферически симметричного источника:

Коэффициент диффузии имипрамина в среде рассчитывался в соответствии с уравнением Стокса–Эйнштейна:

где вязкость среды принималась равной 1 мПа·с, а оценки радиуса молекулы имипрамина в гидратной оболочке выполнены в группе Г.Г. Чилова (для метода см. [17]). Окончательно DI = 1,34×10-4 см2 с-1. Значение k вычислялось из среднего времени полужизни данного химического соединения в мозге крысы [18] и составляло k=2,61×10-4 c-1. Поток на границе любого элементарного источника рассчитывался исходя из значения JI = 1 мкМ / с.
Результаты и обсуждение
Пространственно-временные распределения концентрации имипрамина для различных срезов фантома представлены на рис. 2. Их характерной особенностью служит сильное падение содержания данного антидепрессанта при удалении от поверхности кровеносных сосудов.

Данный эффект обусловлен относительно высоким поглощением имипрамина средой при данном коэффициенте диффузии и входящем потоке. Увеличение вязкости среды приведет к еще большему проявлению наблюдаемого падения градиента концентрации. В то же время возрастание метаболического потока JI при сохранении других параметров неизменными линейно увеличит содержание рассматриваемого антидепрессанта. Таким образом, главной особенностью нестационарных градиентов имипрамина являются локальные относительно высокие значения его концентрации вблизи кровеносных сосудов. В этих областях будут находиться нейроны, митохондрии которых в наибольшей степени подвержены разобщающему и ингибирующему действиям, упомянутым выше. Необходимо отметить, что и уровень естественных метаболитов в силу близости кровотока будет там также достаточно высок. Если в подобных условиях клетки центральной нервной системы смогут сохранить сукцинат-зависимое дыхание и наряду с этим поддерживать уровень гликолиза, то проявление негативного действия имипрамина на уровне окислительного фосфорилирования будет незначительным. Данный компенсаторный эффект может рассматриваться в качестве объяснения парадоксального антиоксидантного и стимулирующего действий имипрамина на уровне митохондрий при его длительном введении in vivo. В то же время следует обратить внимание на то обстоятельство, что негативный эффект от побочного действия трициклических антидепрессантов приводит к повреждению печени пациентов [19]. Таким образом, значительное увеличение дозы вводимого препарата, выражающееся в терминах используемой в работе модели в возрастании JI, может обусловливать расширение области нарушения митохондриального окислительного фосфорилирования и как следствие – инициировать формирование нейродегенеративного процесса. В подобных условиях особую роль начинает играть первичная нейропротекция. В качестве естественного метаболита, улучшающего состояние биоэнергетики нейронов, выступает глицин. Экспериментально доказано, что данная аминокислота сохраняет активность комплексов дыхательной цепи митохондрий нейронов в условиях аноксии как in vitro [20], так и in vivo [21]. Более того, в условиях гипоксии глицин стимулирует гликолиз и тормозит интернуклеосомальную фрагментацию ДНК [22], что указывает на нейропротекцию ишемических нарушений на молекулярном уровне. Данные наблюдения свидетельствуют в пользу того, что применение данной аминокислоты позволило бы снизить проявление рассматриваемого в работе побочного эффекта имипрамина.
Выводы
Проведенный в работе анализ нестационарных градиентов концентраций имипрамина на примере фантома пиальной оболочки крысы показал, что при физико-химических параметрах диффузии и поглощения в среде, соответствующих экспериментально оцененным значениям, высокое содержание данного трициклического антидепрессанта в значительной степени локализовано вблизи стенок кровеносных сосудов. Данное свойство распределения в случае наличия активного сукцинат-зависимого дыхания и высокого уровня гликолиза позволяет объяснить парадоксальный эффект рассматриваемого соединения на окислительное фосфорилирование в митохондриях нейронов.
Благодарности
Авторы выражают благодарность Е.С. Тюкиной за предоставление изображений пиальных оболочек мозга крысы, использованных для создания виртуального фантома.



