Нейроэндокринные опухоли (НЭО), впервые описанные Зигфридом Оберндорфером в 1907 г. [1], развиваются в разных органах и имеют одинаковое биологическое происхождение – плюропотентную нейроэндокринную или энтерохромафинную клетку, но в зависимости от сопровождающих рост и развитие опухоли секретирующих гормонов – разные клинические симптомы. Заболеваемость НЭО растет в первую очередь за счет опухолей желудочно-кишечного тракта (ЖКТ) и поджелудочной железы (ПЖ) или гастро-энтеропанкреатических – ГЭП-НЭО. Поскольку больные ГЭП-НЭО, а также и высокодифференцированными (Gr1-Gr2) НЭО бронхолегочной системы живут долго и длительное время находятся на лечении, правильные лечебные подходы чрезвычайно актуальны. Установлено, что 40–60% ГЭП-НЭО являются функционирующими и 30% опухолей тонкой кишки ассоциируются с карциноидным синдромом, характеризующимся приливами, диареей, одышкой, бронхоспазмом, телеангиэктазиями, дерматитом, цианозом, развитием карциноидного сердца по типу правожелудочковой недостаточности в связи с фиброзными изменениями в эндо- и миокарде правых отделов сердца и стенозом и недостаточностью трехстворчатого клапана и клапана легочной артерии.
В то же время при ГЭП-НЭО выявляют различные генные изменения, которые могут быть связаны с наследственными синдромами (МЭН-1 и МЭН-2) или же являются спорадическими и отражают механизмы канцерогенеза [2].
Карциноидные опухоли имеют на поверхности клеток рецепторы, обладающие высоким сродством к гормону соматостатину; выделено пять подтипов соматостатиновых рецепторов – sst2, sst5, sst1, sst3, sst4 (в порядке убывания по частоте встречаемости). Помимо соматостатиновых описаны и другие рецепторы: холецистокининовые, секретиновые, ВИП-рецепторы, бомбезиновые, СRF-рецепторы 1-го и 2-го типов при глюкогономах, инсулиномах и др. В 87% случаев они присутствуют и в метастазах, если встречаются в первичной опухоли [3].
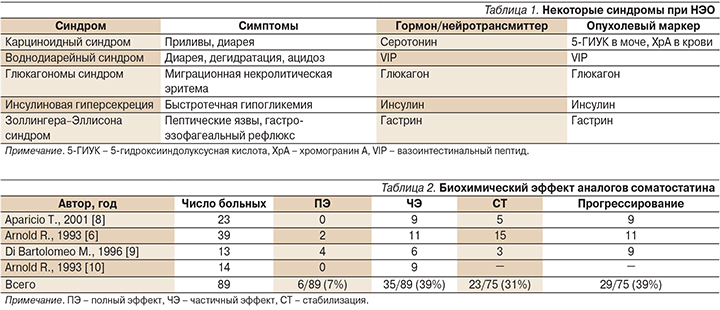
Помимо карциноидного синдрома существуют таковые, связанные с высвобождением других пептидов, характерных для опухолей (инсулинома – инсулин, гастринома – гастрин, соматостатинома – соматостатин и т.д.). В соответствии с синдромом возможен контроль динамики процесса по уровню опухолевых маркеров (табл. 1) [4].
В связи с развитием карциноидного синдрома для лечения НЭО начиная с 1990-х гг. используются аналоги соматостатина, блокирующие рецепторы и вызывающие уменьшение или полное исчезновение клинических проявлений синдрома приблизительно у 70% больных.
Первые результаты были описаны Обергом в 1994 г. [5]. Биотерапия использовалась в качестве симптоматического лечения больных функционирующими НЭО, например пациентов с карциноидным синдромом с выраженной диареей, улучшая качество их жизни.

Снижение уровня опухолевых маркеров обусловлено антисекреторной активностью аналогов соматостатина, и не может интерпретироваться как уменьшение опухоли. Однако уменьшение опухоли, по данным разных авторов, отмечено приблизительно у 10% больных, а стабилизация опухоли после КТ-документированного прогрессирования до начала лечения аналогами соматостатина наблюдалась приблизительно при 50% НЭО с медианой 18,0 –26,5 месяца [6].
В отобранной когорте больных с прогрессированием у 47% из них была зарегистрирована стабилизация процесса при лечении ланреотидом в высокой дозе (3×5 г/сут). Это было также далее подтверждено у 75% больных с распространенным процессом при опухолях средней кишки [7].
Наряду со стабилизацией процесса рядом авторов отмечен и биохимический эффект аналогов соматостатина (табл. 2).
Помимо симптоматического аналоги соматостатина могут обладать антипролиферативным эффектом. Это было продемонстрировано вначале в экспериментальных исследованиях, а затем и в клинике.

Экзогенный соматостатин циркулирует в виде двух активных форм: SS-14 и SS-28. Соматостатин связывается высокой аффинностью с пятью G-протеин-парными мембранными рецепторами – sst1-5.
Связывание лиганда тормозит активность аденилатциклазы, уменьшает кальциевый инфлюкс и негативно влияет на синтез и секрецию гормонов. Предполагают, что ингибиторный эффект на пролиферацию обусловлен активацией фосфотирозин-фосфатаз и ингибированием транскрипторных факторов комплекса активатора протеина 1. Высокие дозы аналогов соматостатина in vitro индуцируют апоптоз опухолевых клеток. Дополнительный антипролиферативный эффект может быть обусловлен антиангиогенной активностью.
Используемые аналоги соматостатина, октреотид и ланреотид, преимущественно связывают рецепторы второго и пятого подтипов – sst2 и sst5. Недавно появился еще один аналог – пасиреотид c высокой аффинностью к рецепторам 1–3-го и 5-го типов (табл. 3).
Большинство НЭО эксрессируют большее количество соматостатиновых рецепторов по сравнению с нормальными тканями, однако экспрессируемые подтипы широко варьируются в различных опухолях, а также в опухолях одного и того же типа.
Несмотря на распространенность биотерапии при НЭО, научные обобщенные данные о ее непосредственном действии на опухоль по критериям доказательной медицины отсутствовали. Встречались отдельные наблюдения, касающиеся времени до прогрессирования или смертности, но обычно число больных было небольшим и они включали результаты одного лечебного учреждения.

Проанализировав результаты лечения ГЭП-НЭО в 1988–2004-х и 1973–1987 гг., J.C. Yao показал повышение выживаемости больных местнораспространенным и метастатическим процессами в связи с применением аналогов соматостатина (рис. 1) [11].
Прямые рандомизированные плацебо-контролируемые исследования, доказывающие антипролиферативный эффект аналогов соматостатина, были проведены лишь в течение последних 10 лет.
В 2009 г. A. Rinke и соавт. подтвердили антипролиферативную активность Сандостатина ЛАР (октреотид длительного действия – октреотид-депо) в дозе 30 мг, вводимого 1 раз в 28 дней, доказанную в исследовании PROMID.
Исследование показало, что Сандостатин ЛАР значительно удлиняет время до прогрессирования (ТТР) у пациентов с высокодифференцированными метастатическими НЭО средней кишки (midgut). В группе Сандостатина ЛАР по сравнению с группой плацебо риск прогрессирования болезни снизился на 66%. Среди пациентов, получавших Сандостатин ЛАР, медиана ТТР увеличилась до 14,3 месяца по сравнению с 6 месяцами в группе плацебо (р=0,000072; рис. 2) [12, 13].
Далее было проведено изучение антипролиферативной активности ланреотида – исследование CLARINET (Controlled Study of Lanreitide Antiprolifirative Response in NET). Это было базовое рандомизированное исследование III фазы при НЭО ПЖ и ЖКТ, включившее применение ланреотида (Соматулин® Аутожель®) 120 мг каждые 28 дней и плацебо каждые 28 дней. Контролировали очаги поражения с помощью КТ/МРТ [4].
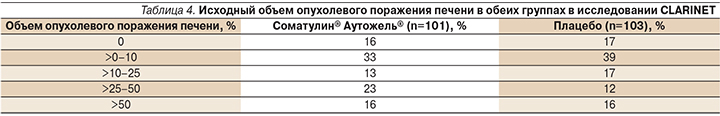
В исследование CLARINET включили больных ГЭП-НЭО Gr1 и Gr2 с Ki-67 до 10%, а также с обширным поражением печени; документально фиксировали факт прогрессирования заболевания (табл. 4).
В результате исследования было подтверждено противоопухолевое антипролиферативное действие ланреотида.
Ланреотид в дозе 120 мг 1 раз в 28 дней достоверно увеличил выживаемость без прогрессирования (ВБП) у пациентов с ГЭП-НЭО по сравнению с плацебо: медиана ВБП в группе ланреотида не была достигнута, а медиана ВБП в группе плацебо составила 18 месяцев. В группе плацебо 33% пациентов были живы без прогрессирования на 24-м месяце наблюдения, а в группе ланреотида этот показатель составил 65% (рис. 3) [14].
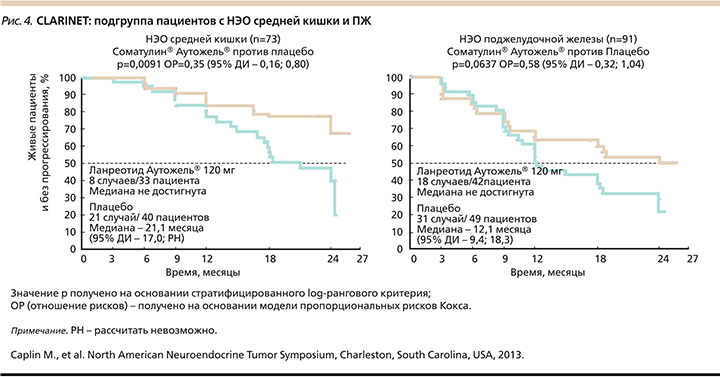
В подгруппах пациентов с НЭО средней кишки и ПЖ также наблюдалось улучшение в подгруппе ланреотида, достоверное при НЭО средней кишки (рис. 4) [15].
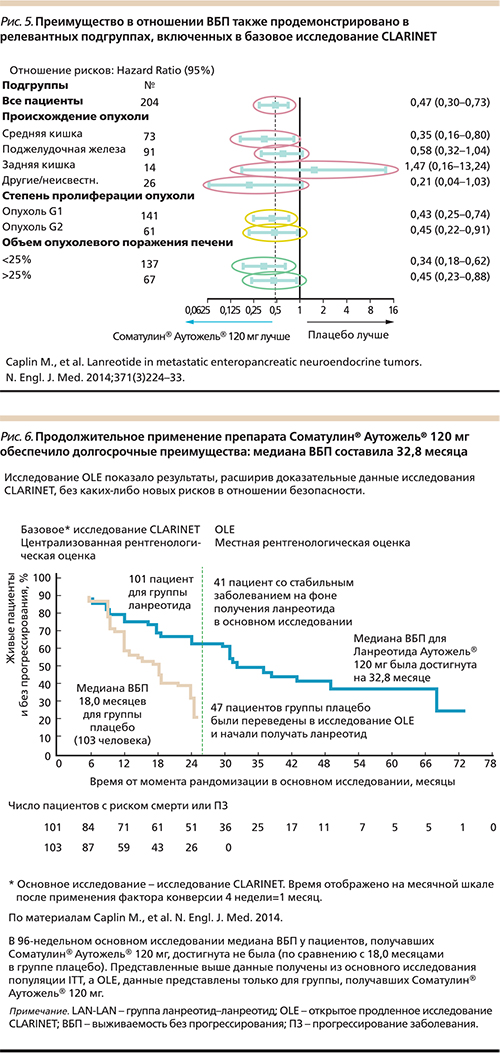
Анализ других подгрупп подтвердил преимущество ланреотида, за исключением немногочисленной группы пациентов с НЭО задней кишки (рис. 5) [14].
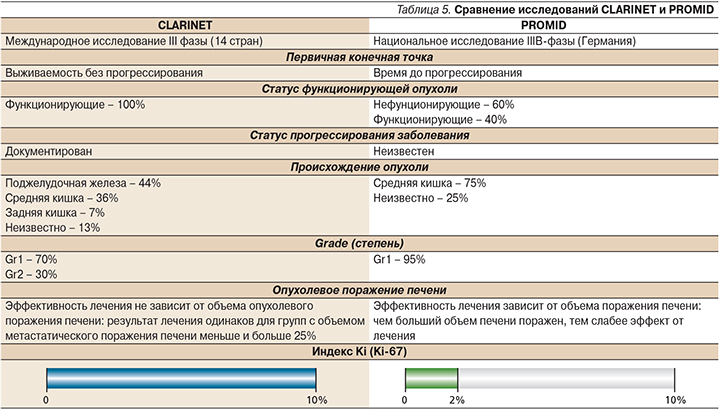
Сравнение двух похожих исследований – PROMID и CLARINET – позволяет выделить несколько отличительных позиций в последнем исследовании, а именно: это было международное исследование с участием 14 стран, в которое были включены 204 больных только нефункционирующими НЭО Gr1 и Gr2 <10%, а в германское исследование PROMID были включены 85 больных функционирующими Gr1 опухолями средней кишки (табл. 5).
Далее исследование CLARINET было продолжено как CLARINET-OLE и 47 больных группы плацебо были переведены на лечение ланреотидом.
В этом продолженном исследовании бала достигнута медиана ВБП, составившая 32,8 месяца (рис. 6) [14, 16, 17].
Таким образом, был подтвержден антипролиферативный противоопухолевый эффект ланреотида при лечении НЭО ПЖ и ЖКТ при опухолях с индексом дифференцировки Gr1 и Gr2 <10%.
При оценке переносимости не было отмечено каких-либо неожиданных явлений. Препарат ланреотид (Соматулин® Аутожель®) в дозе 120 мг, назначенный 1 раз в 28 дней, вызвал всего 3% серьезных нежелательных явлений, которые могли быть расценены как связанные с терапией и требовали отказа от лечения.
В качестве побочных явлений отмечены диарея в 26% случаев, абдоминальная боль – в 14 и холелитиаз – в 10%.
При лечении аналогами соматостатина в литературе в качестве осложнений описаны абдоминальный дискомфорт, газообразование, стеаторея, обусловленные торможением продукции панкреатических ферментов; обычно эти симптомы не очень выражены и проходят самостоятельно после первых недель терапии.
Стеаторею можно контролировать назначением панкреатических ферментов. Холестаз с последующим холецистолитиазом возникает, по данным литературы, у 60% больных и обусловлен торможением холецистокинина и продукции литогенной желчи. Профилактическая терапия ксенодезоксихолевой и урсодезоксихолевой кислотами может предупреждать развитие желчнокаменной болезни у больных, длительно получающих аналоги соматостатина. Также возможно снижение концентрации витамина В12 в связи с прямым действием аналогов на секрецию париетальных клеток.
Таким образом, сегодня мы можем назначать аналоги соматостатина не только при функционирующих НЭО, но и при нефункционирующих НЭО Gr1 и Gr2 <10% в качестве антипролиферативных противоопухолевых средств.



