Нейроэндокринные опухоли (НЭО) образуют редкую и гетерогенную группу.
В литературе продолжаются дебаты о клинико-морфологических характеристиках и особенностях биологического поведения этих новообразований. Интерес специалистов к данной проблеме обусловливается и значительным увеличением (5-кратным в течение 30 лет) частоты НЭО [1]. Бронхопульмональные НЭО составляют до 3% всех злокачественных новообразований этой локализации и порядка 25% всех нейроэндокринных опухолей. На мелкоклеточный нейроэндокринный рак легкого приходится 13% всех случаев рака легкого, большинство из которых приходится на диссеминированную форму заболевания [2].
В 2000 г. в России раком легкого заболели более 63 тыс. человек, а число умерших увеличилось за 20-летний период на 40% и достигло 58,9 тыс.
В структуре умерших от злокачественных новообразований доля рака легкого составляла 30,8% у мужчин и 6,6% у женщин, занимая соответственно первое и четвертое места.
В соответствии с классификацией Всемирной организации здравоохранения (2010) НЭО легких к категории карциноидов относятся типичный карциноид (ТК) и атипичный карциноид (АК) – НЭО низкой и промежуточной степеней злокачественности. Остальные два типа опухолей: крупноклеточный нейроэндокринный рак (КНЭР) и мелкоклеточный нейроэндокринный рак (МНЭР), относятся к категории низкодифференцированного рака высокой степени злокачественности, при этом КНЭР рассматривается как подгруппа крупноклеточных карцином, а мелкоклеточный рак легкого (МРЛ) является независимой нозологической единицей (см. таблицу).

МРЛ – наиболее частая нейроэндокринная опухоль данной локализации. К ее биологическим особенностям относят высокую степень злокачественности, быстрый рост, склонность к раннему лимфогенному и гематогенному метастазированию, высокую чувствительность к лекарственному и лучевому лечению. Общепринятая систематизация МРЛ на «локализованный» (в пределах гемиторакса) и «распространенный» правомочно дополняется оценкой распространенности (стадии) процесса в соответствии с классификацией TNM.
Предварительный диагноз НЭО может быть поставлен на основании клинической картины и обычного гистологического исследования, а окончательная верификация проводится с помощью иммуногистохимического исследования.
Специфическим клиническим проявлением НЭО является карциноидный синдром. В разных пропорциях эти опухоли секретируют биоактивные амины и пептиды, включая хромогранины А, нейронспецифическую енолазу, адренокортикотропный гормон, кортизол, 5-оксииндолуксусную кислоту и гистамин.
Главным провоцирующим фактором для развития данной опухоли считается курение [3].
К общепринятым методам лечения больных МРЛ сегодня относятся лучевой, лекарственный, хирургический и их комбинации. К сожалению, на момент установления диагноза лишь около 30% пациентов имеют локализованную стадию заболевания, а оперированными могут быть лишь пациенты с I стадией заболевания. В целом МРЛ высокочувствителен к существующим консервативным (лекарственному и лучевому) методам лечения, но риск рецидива крайне высок, поэтому на сегодняшний день результаты терапии пациентов с местнораспространенным и диссеминированным характером заболевания далеки от удовлетворительных.
В настоящее время химиотерапия служит основным системным методом лечения и 4–6 циклов платиновой химиотерапии без поддерживающей терапии стандартные [4]. Лучевая терапия может добавляться к химиотерапии при диссеминированном процессе для улучшения локального контроля или профилактического облучения головного мозга в случае хорошего ответа на химиотерапию, а при локальном процессе химиолучевая терапия носит обязательный характер [5]. При облучении грудной клетки основной задачей является предотвращение локального рецидива, удлинение безрецидивного интервала и в конечном счете – улучшение выживаемости. Однако выживаемость при распространенном МРЛ незначительна и в последние десятилетия мало улучшилась. Результаты анализа, проведенного в 2000 г., показали, что двухлетняя выживаемость составляет менее 5% [6]. Среднее время до прогрессирования составляет 4–6 месяцев, медиана выживаемости – 7–11 месяцев.
Хотя большинство подходов оказалось безуспешным, заметным исключением выглядит профилактическое облучение головного мозга после ответа на индукционную химиотерапию, что обеспечило увеличение продолжительности жизни в результате исследования фазы 3 [7]. В этом исследовании частота симптоматических метастазов в головном мозге значительно снизилась при профилактическом облучении головного мозга по сравнению с контрольной группой (15 против 40%), а однолетняя выживаемость улучшилась (27 против 13%). Контроль первичного очага остается главной проблемой этого заболевания, 75% пациентов в вышеупомянутом исследовании сохраняли местное проявление заболевания после химиотерапии, а примерно у 90% из них локальное прогрессирование болезни произошло в течение первого года после постановки диагноза [7].
В одноцентровом исследовании пациенты с диссеминированным МРЛ, у которых был полный ответ со стороны отдаленных метастазов, а также полный или частичный эффект со стороны первичной опухоли, были рандомизированы для лучевой терапии первичной опухоли и средостения с использованием химиотерапии [7]. Исследователи сообщили о значительном улучшении местного контроля и выживаемости после лучевой терапии первичного очага. Также было проведено рандомизированное исследование 3-й фазы, зарегистрированное в Nederlands Trial Register, номер NTR1527, куда входили пациенты с показателем по шкале ECOG (Eastern Cooperative Oncology Group) 0–2 и подтвержденным МРЛ с объективным эффектом на химиотерапию. Пациенты были рандомизированы (1:1) в группу, получавшую лучевую терапию на первичный очаг и средостение (30 Гр в десяти фракциях), и группу без облучения органов грудной клетки (контрольная группа). Всем пациентам провели профилактическое облучение головного мозга. Первичной и вторичной конечными точками были однолетняя общая выживаемость и выживаемость без прогрессирования. В исследование были взяты 495 пациентов за 2009–2012 гг. (247 пациентов в группе лучевой терапии и 248 в контрольной группе). Медиана наблюдения составила 24 месяца. Общая однолетняя выживаемость существенно не различалась между группами: 33% (95% доверительный интервал [ДИ] – 27–39) для группы с применением радиотерапии против 28% (95% ДИ – 22–34) для контрольной группы. Однако при вторичном анализе общая выживаемость за 2 года составила 13% (95% ДИ – 9–19) против 3% (95% ДИ – 2–8; р=0,004). Через 6 месяцев выживаемость без прогрессирования составила 24% (95% ДИ – 19–30) против 7% (95% ДИ – 4–11; р=0,001). Наиболее распространенным токсическим эффектом III, IV степеней были астения и одышка. Данное исследование позволило рекомендовать применение лучевой терапии на первичный очаг и средостение в дополнение к профилактическому облучению головного мозга для всех пациентов с диссеминированным МРЛ, отвечающих на химиотерапию.
Клинический случай
На наш взгляд, описываемый клинический случай отражает крайне редкое наблюдение успешного лечения пациента с диссеминированной формой МРЛ.
Больной Д. 1952 г.р. поступил 29.04.2015 в РОНЦ им. Н.Н. Блохина с жалобами на слабость и одышку при значительной физической нагрузке.
Из анамнеза: считает себя больным с января 2015 г., когда отметил появление одышки при умеренной физической нагрузке. В апреле 2015 г. отмечено резкое ухудшение состояния: усилилась одышка, появилась мокрота с примесью крови. В ЦКБ № 1 г. Подольска при рентгенографии грудной клетки выявлено опухолевое образование в верхней доле левого легкого. С целью дообследования и решения вопроса дальнейшей тактики больной был направлен в РОНЦ им. Н.Н. Блохина.
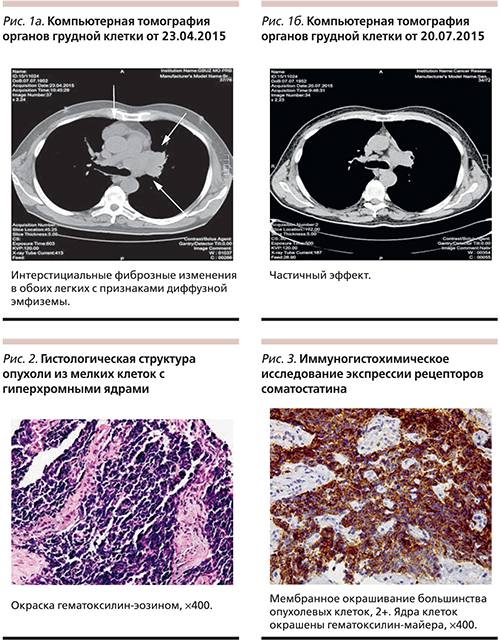
Компьютерная томография (КТ) органов грудной клетки от 23.04.2015. Заключение: центральный рак верхней доли левого легкого с проксимальным распространением опухолевой инфильтрации на левую стенку трахеи; с метастазом в ту же долю, с метастазами в лимфатические узлы корня левого легкого и средостения. Интерстициальные фиброзные изменения в обоих легких с признаками диффузной эмфиземы (рис. 1а).
Магнитно-резонансная томография (МРТ) головного мозга от 14.05.2015. Заключение: картина метастатического поражения головного мозга.
Бронхоскопия от 22.05.2015. Заключение: центральный рак верхней доли левого легкого. Косвенные признаки увеличения лимфатических узлов корня левого легкого.
Ультразвуковое исследование органов брюшной полости от 17.09.2015. Заключение: данных за метастазирование не получено. Гепатомегалия.
Сцинтиграфия костей от 08.05.2015. Заключение: признаков метастатического поражения скелета не выявлено.
Стадия по системе TNM: T4N3M1 Стадия опухолевого процесса IV.
Цитологическое заключение № 9089/2015 от 25.05.2015 (бронхоскопия). Заключение: в полученном материале найденные изменения соответствуют коду 8041/3 МРЛ, БДУ.
Гистологическое заключение № 18900/2015 от 26.05.2015 (бронхоскопия). Заключение: морфологическая и иммуногистохимическая картина опухоли соответствует диагнозу МРЛ. Статус рецепторов соматостатина 2-го типа (SSTR-2) в опухоли умеренно позитивный (рис. 2, 3).
По данным обследования РОНЦ был установлен диагноз: центральный (мелкоклеточный) рак верхней доли левого легкого с распространением на трахею, метастаз в верхнюю долю левого легкого, метастазы в лимфатические узлы корня легкого, средостения с двух сторон. Множественные метастазы в головной мозг.
С 25.05.2015 по 15.07.2015 проведена химиотерапия по следующей схеме: иринотекан 65 мг/м2 (общая доза – ОД=130 мг) внутривенно (в/в) капельно в 1-й, 8-й дни+цисплатин 75 мг/м2.
(ОД=150 мг) в/в капельно в 1-й день. С 28.05.2015 пациенту начата биотерапия аналогом соматостатина пролонгированного действия препаратом Октреотид-лонг 20 мг внутримышечно с учетом рецепторного статуса опухоли (SSTR-2 умеренно позитивный).
В связи с диареей IV ст. доза иринотекана во 2-м курсе химиотерапии редуцирована до 50 мг/м2.
При контрольном обследовании после трех курсов (КТ органов грудной клетки от 20.07.2015) – частичный эффект (51%) (рис. 1б). С 29.07.2015 по 17.09.2015 проведены 4–6-й курсы химиотерапии.
В связи с нейротоксичностью (полиневропатия II ст.) с 4-го курса доза цисплатина редуцирована до 65 мг/м2.
С 10.08.2015 по 21.08.2015 после 4-го курса проведен паллиативный курс дистанционной лучевой терапии на весь головной мозг 1 раз в сутки, 5 раз в неделю, РОД – 3 Гр, СОД – 30 Гр.
По данным контрольного обследования, после 6 курсов химиотерапии (КТ органов грудной клетки и МРТ головного мозга) существенной динамики не отмечается.
С 25.11.2015 по 22.12.2015 проведен паллиативный курс конформной лучевой терапии на первичный опухолевый узел в верхней доле левого легкого, конгломерат опухолевых узлов в средостении, РОД – 2,6 Гр 5 дней в неделю, СОД – 25 Гр, лимфоузлы средостения, РОД – 2,4 Гр 5 дней в неделю, СОД – 48 Гр.
С 12.2015 по настоящее время, по данным контрольных обследований (КТ органов грудной клетки от 07.02.2017, МРТ головного мозга от 06.03.2017), состояние без существенной динамики.
С началом химиотерапии больной стал получать Октреотид-лонг по 20 мг внутримышечно 1 раз в 28 дней и продолжает его прием по настоящее время. На протяжении 19 месяцев отмечается стабилизация процесса.
Описываемый нами успешный вариант при диссеминированном процессе с достижением частичного эффекта от комбинированной химиолучевой терапии и поддерживающей терапии аналогом соматостатина пролонгированного действия требует дальнейшего изучения в рамках рандомизированного исследования.



