Несмотря на достигнутые успехи, лечение острых инфекций ЛОР-органов остается нерешенной проблемой оториноларингологии. Антибиотикотерапия, которая является одним из важнейших компонентов комплексного лечения таких больных, с учетом сложности этиологической диагностики заболеваний в ежедневной практике отоларинголога в большинстве случаев назначается эмпирически. В связи с этим для обеспечения максимальной эффективности она должна подчиняться основным принципам, наиболее важный из которых – оптимальность спектра действия. Данное положение подразумевает наличие не только широкого спектра противомикробной активности эмпирически назначаемого антибиотика, но и действия против основных возбудителей той или иной инфекции с учетом региональных данных, полученных в контролируемых клинических исследованиях.
Выбор антибактериального препарата и путей его введения до сих пор представляет сложную задачу для практического оториноларинголога, поскольку антибактериального препарата, полностью удовлетворяющего перечисленным положениям, нет. И даже если бы он гипотетически существовал, назначая антибиотик, мы руководствуемся определенными алгоритмами, разработанными с целью обеспечения максимальной эффективности лечения и предотвращения селекции антибиотикорезистентных штаммов. Последнее положение предусматривает возможность манипулирования как антибиотиками выбора, так и препаратами резерва.
В этиологии обострений инфекций ЛОР-органов могут принимать участие различные бактерии и вирусы, однако большое значение имеют два микроорганизма – Haemophilus influenzae и Streptococcus pneumoniae, на долю которых в сумме приходится 60–80 % случаев ЛОР-инфекций [1–3]. В большинстве исследований, проведенных в 1990-е гг., приводятся данные о доминирующей роли этих двух микроорганизмов, причем ведущее место занимает пневмококк.
Наиболее репрезентативные обобщенные данные по чувствительности внебольничных респираторных патогенов в настоящее время представлены в многоцентровом исследовании PROTECT [4].
Наиболее выраженной активностью in vitro в отношении гемофильной палочки обладают цефиксим и антипневмококковые фторхинолоны. Чувствительность микроорганизма к амоксициллину, амоксициллину/клавуланату, цефуроксиму существенно ниже. Активность макролидых антибиотиков в отношении H. influenzae крайне низка, а цефаклор вообще не обладает клинически значимой активностью. Однако если практически все штаммы гемофильной палочки проявляют хорошую чувствительность к амоксициллину/клавуланату, цефиксиму и фторхинолонам, то уровень активности всех макролидов в отношении H. influenzae невысок [5]. Даже максимальные концентрации эритромицина, кларитромицина и азитромицина в крови (соответственно 2,5, 2,0 и 0,5) не достигают значений МПК90 (минимальной подавляющей концентрации) для H. influenzae, что не позволяет ожидать надежного клинического эффекта. Концентрации макролидных антибиотиков в тканях бронхолегочной системы обычно превышают их концентрацию в крови, однако следует учитывать факт уменьшения активности этих препаратов в отношении H. influenzae при снижении рН, что наблюдается при воспалительных процессах в верхних и нижних отделах дыхательных путей (особенно при гнойных процессах). Фармакодинамическое моделирование и клинические исследования показывают крайне малую вероятность достижения эрадикации гемофильной палочки при лечении макролидными антибиотиками. На основании этих данных Европейское агентство по лабораторным стандартам EUCAST (European committee on antimicrobial susceptibility testing) с 2010 г. рассматривает H. influenzae как природно устойчивую к макролидным антибиотикам [6].
Рассматривая антипневмококковую активность современных антибиотиков, следует отметить, что наиболее высокой природной активностью в отношении данного микроорганизма обладают аминопенициллины, цефуроксим и макролидные антибиотики. При этом активность цефиксима и антипневмококковых фторхинолонов ниже. В последние годы наблюдается снижение чувствительности пневмококков ко многим антибактериальным средствам. По данным исследования PROTECT [4], наибольшая чувствительность пневмококков сохраняется к новым фторхинолонам и амоксициллину. Наряду с устойчивостью к пенициллину отмечается рост устойчивых штаммов S. pneumoniae к эритромицину и другим макролидным антибиотикам, причем устойчивость к последним возрастает среди как пенициллинчувствительных, так и пенициллинрезистентных штаммов пневмококка. Большинство пенициллинрезистентных штаммов пневмококка также устойчиво к макролидам. Устойчивость S. pneumoniae к 14- и 15-членным макролидам перекрестная, т. е. если микроорганизм устойчив к эритромицину, то с высокой вероятностью он будет устойчив и к кларитромицину, и к азитромицину. Сходный уровень устойчивости пневмококков наблюдается к пероральным цефалоспоринам II–III поколений.
По данным российского исследования антимикробной резистентности ПеГАС-III, проведенного в 2006–2009 гг. в нескольких десятках городов страны, высокую активность в отношении S. pneumoniae сохраняют амоксициллин и амоксициллин/клавуланат (лишь 0,4 % штаммов проявляют умеренную резистентность). Также пневмококки всегда сохраняют высокую чувствительность к эртапенему, ванкомицину и респираторным фторхинолонам. При этом первые два препарата не могут быть рекомендованы к широкому применению из-за наличия только парентеральной формы, а применение фторхинолонов в детской практике ограниченно. Уровень резистентности (включая штаммы с умеренной резистентностью) к пенициллину составляет 11,2 %, к цефалоспоринам III поколения – от 1 % (цефотаксиму и цефтриаксону) до 6,8–12,9 % (цефиксиму и цефтибутену), макролидам – 4,6–12 %, клиндамицину – 4,5 %, тетрациклину – 23,6 %, хлорамфениколу – 7,1 % и к ко-тримоксазолу – 39 % [7].
На основании данных о текущем уровне антибиотикорезистентности к основным патогенным микроорганизмам регулярно обновляются международные и региональные рекомендательные документы с прописанными порядком и последовательностью назначения антибиотиков при различных инфекциях. Применительно к инфекциям верхних дыхательных путей в качестве антибиотиков первого выбора рекомендуется применение аминопенициллинов [8–11]. “Защищенные” аминопенициллины в ряде рекомендаций указываются как стартовые, а согласно другим документам, применяются как “альтернативные” в случаях предшествующей антибиотикотерапии в течение последнего месяца, тяжелого течения инфекции, проживания в эндемичных районах с высоким уровнем резистентности к пневмококку и в других случаях. Аналогичная ситуация отмечается с цефалоспоринами. Согласно исследованию ПеГАС III, пероральные цефалоспорины II–III поколений назначаются стартово [7], однако в других рекомендациях они являются альтернативными. Более того, в США их назначают только в комбинации с клиндамицином для усиления антипневмококковой активности [12].
Таким образом, приведенные данные наглядно показывают сохранение активности цефиксима в отношении наиболее актуальных возбудителей ЛОР-инфекций на достаточно высоком уровне (S. pneumoniae) и в то же время по некоторым позициям (H. Influenzae) препарат превосходит защищенные аминопенициллины.
В ряде клинических исследований цефиксим показал сравнимую активность с амоксициллином/клавуланатом при лечении больных хронической обструктивной болезнью легких [13]. Проводились исследования, подтвердившие эффективность применения цефиксима и больными оториноларингологического профиля. Однако с учетом обновленных данных по антибиотикорезистентности в российском исследовании ПеГАС III необходимо определить место пероральных цефалоспоринов III поколения в алгоритме антибиотикотерапии больных острыми ЛОР-инфекциями.
Моделью для начала такого исследования могла бы стать наиболее распространенная категория больных в российских стационарах, каковыми являются пациенты с острым бактериальным риносинуситом (ОБР). Так, по данным ЛОР-отделений ГКБ им. Боткина за 2011 г., каждый четвертый госпитализированный пациент страдает ОБР средней степени тяжести. В связи с этим возникает вопрос: что побуждает госпитализировать больного ОБР среднетяжелого течения? Очевидно, что в большинстве случаев это неправильная тактика лечения в амбулаторном периоде.
С учетом вышеизложенных положений проведено исследование, целью которого явилась оценка эффективности и безопасности препарата цефиксим (Панцеф) для больных острыми бактериальными инфекциями ЛОР-органов.
Материал и методы
Под наблюдением находились 83 пациента (49 женщин и 34 мужчины) в возрасте от 18 до 56 лет (средний возраст – 34,5 ± 6,2 года) с диагнозом ОБР, подтвержденным клинико-анамнестическими данными и результатами лабораторно-инструментальных методов исследования.
В амбулаторном периоде данным больным проведено лечение, включившее топические деконгестанты, муколитики, препараты для ирригации полости носа и др. Поскольку одной из задач исследования стало определение возможностей стартового применения цефиксима, из исследования исключили пациентов с предшествующей в течение последнего месяца антибиотикотерапией.
В исследование не включили также лиц с аллергическими реакциями на β-лактамные антибиотики, нуждавшихся в одновременном назначении других системных антимикробных препаратов, с тяжелым течением заболевания и/или другими факторами, определяющими целесообразность парентерального введения антимикробных препаратов и госпитализации по любому поводу в предшествующие 5 дней. Диагноз заболевания устанавливали на основании типичных клинических симптомов и данных рентгенографии.
С учетом анамнестических и клинических данных в качестве эмпирического антибиотика были определены аминозащищенные пенициллины (амоксициллин/клавуланат) и пероральные цефалоспорины III поколения (цефиксим). В зависимости от тактики лечения больные были рандомизированы в две группы (табл. 1). В группе 1 схема лечения предусматривала назначение амоксициллина/клавуланата перорально в дозировке 875/125 мг 2 раза/сут. В группе 2 назначали цефиксим перорально в дозировке 400 мг 1 раз/сут. Помимо антибактериальных препаратов в схему комплексного лечения в обеих группах по показаниям ввели топические деконгестанты, интраназальные глюкокортикостероиды, секретолитики, антигистаминные препараты. Метод пункции верхнечелюстных пазух в настоящем исследовании не использовался. Длительность лечения составила 7 дней.
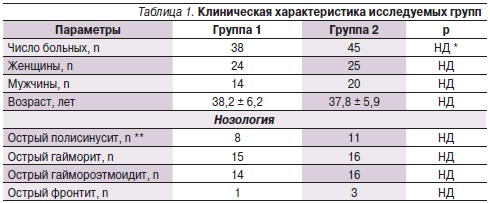
* НД – различия статистически недостоверны, ** – вовлечение более 2 пазух на одной стороне.
Эффективность проводимого лечения оценивали на 3-и, 5 и 7-е сутки и определяли по степени уменьшения субъективных и объективных симптомов ОБР по 3-балльной системе до и после лечения.
Выделены следующие параметры оценки:
• отсутствие эффекта: сохранение субъективных и объективных признаков ОБР после лечения;
• улучшение: существенное уменьшение субъективных и/или объективных признаков ОБР после лечения;
• выздоровление: полное исчезновение субъективных и объективных симптомов ОБР после лечения.
Результаты исследования и их обсуждение
Согласно полученным результатам, в основной группе выраженность субъективных ощущений ОБР, а также объективные симптомы, представленные в баллах, достоверно уменьшились к 3-м суткам терапии, положительная динамика клинических проявлений прогрессировала к 5-м суткам и стабильно сохранялась к 7-му дню лечения (табл. 2, 3). Для пациентов группы сравнения динамика клинических данных была аналогичной, что позволило достичь сравнимой итоговой эффективности лечения в обеих группах (р > 0,05) (см. рисунок).
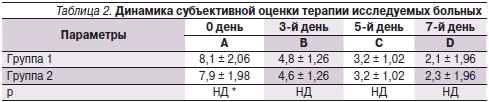
* НД – различия статистически недостоверны.
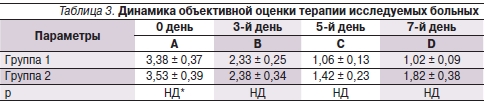
* НД – различия статистически недостоверны.
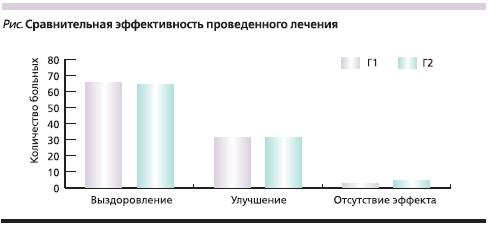
Суммарная оценка эффективности лечения исследуемых пациентов представлена на диаграмме (см. рисунок).
При анализе переносимости цефиксима в группе 2 обращала на себя внимание его хорошая переносимость: лишь у 1 больного из 38 отмечено развитие выраженной крапивницы, ставшей причиной отмены препарата. В то же время в группе 1 на фоне приема амоксициллина/клавуланата почти половина (49 %) больных отметили побочные эффекты: 2 пациента – аналогичные случаи крапивницы, а 12 больных — диспепсические расстройства (диарея), в половине случаев (6 пациентов) потребовавшие отмены терапии. Результаты лечения таких пациентов трактовались как удовлетворительные с учетом существенного уменьшения субъективных и объективных признаков ОБР на момент развития осложнения. Эти обстоятельства закономерно влияли на приверженность лечению. Кроме того, на данный показатель заметно влиял режим дозирования препаратов, когда однократный прием лекарственного средства вызывал бoльшую приверженность лечению, нежели двукратный. Указанные обстоятельства выразились в достоверно меньшей приверженности лечению в группе 1 по сравнению с группой 2, составившей 75 против 96 % соответственно (р = 0,025). Видимо, это обстоятельство в большей степени повлияло на достижение сравнимой эффективности лечения препаратом с более выраженной антипневмококковой активностью амоксициллина/клавуланата по сравнению с цефиксимом.
Панцеф (цефиксим) производства Алкалоид (Македония) – эффективный и безопасный пероральный цефалоспорин третьего поколения с высокой активностью в отношении основных патогенов, вызывающих инфекции ЛОР-органов, верхних и нижних дыхательных путей и мочевыводящей системы. Обладает бактерицидным действием, обусловленным угнетением синтеза клеточной мембраны широкого спектра возбудителей. Препарат устойчив к действию бета-лактамаз, продуцируемых большинством грамположительных и грамотрицательных бактерий. Цефиксим характеризуется хорошей биодоступностью (40–50 %) независимо от приема пищи, длительный период полувыведения делает возможным однократный прием в течение суток, повышает комплаентность лечения и улучшает качество последнего. Применяется при беременности и детьми с 6 месяцев с минимальным риском развития дисбактериоза.
Выводы
Результаты проведенного исследования подтверждают высокую эффективность цефиксима (Панцеф) при лечении больных ОБР, сравнимую с таковой у амоксициллина/клавуланата.
Препарат цефиксим (Панцеф) характеризуется лучшим профилем безопасности за счет меньшего числа побочных эффектов со стороны желудочно-кишечного тракта по сравнению с амоксициллином/клавуланатом.
Высокая приверженность лечению цефиксимом (Панцеф) обеспечивается возможностью однократного приема препарата и влияет на итоговую эффективность лечения.



