Введение
Болезнь Иценко–Кушинга (БИК) – тяжелое нейроэндокринное заболевание, вызванное гиперсекрецией адренокортикотропного гормона (АКТГ) доброкачественной опухолью гипофиза или в редких случаях – карциномой гипофиза. БИК является достаточно редким заболеванием: на его долю приходится 4–8% от всех гормонально активных опухолей гипофиза [1, 2]. При этом БИК служит второй по частоте (после экзогенной) причиной гиперкортицизма среди всех возможных его причин. Отсутствие лечения БИК приводит к тяжелым осложнениям, вызванным гиперкортицизмом, таким как сердечно-сосудистые нарушения, сахарный диабет (СД) и инфекции. Уровень смертности в отсутствие лечения БИК в 1,7–4 раза выше, чем в общей популяции, а 5-летняя выживаемость составляет лишь 50%. Летальность вследствие эндогенного гиперкортицизма скрывается под маской острых сердечнососудистых катастроф (острый инфаркт миокарда, острое нарушение мозгового кровообращения, тромбоэмболические осложнения), поэтому основное заболевание порой остается нераспознанным [1–3].
Существует несколько различных методов лечения БИК. «Золотым» стандартом лечения является нейрохирургическая операция, позволяющая в большинстве случаев достигать немедленной ремиссии [3–5, 8]. Однако ввиду частого рецидивирования не менее важными методами лечения являются лучевой и медикаментозный [6, 8]. В настоящее время лучевые методы лечения БИК применяются преимущественно в качестве «второй линии» при неполном удалении опухоли, отсутствии ремиссии заболевания, при возникновении рецидива, а также при невозможности хирургического лечения [5, 7]. Степень радикальности удаления опухоли – это фактор, который достоверно влияет на уровень снижения уровня повышенных до операции гормонов и на вероятность возникновения рецидива заболевания. В зависимости от степени радикальности проведенной операции решается вопрос о целесообразности назначения второго этапа хирургического или медикаментозного лечения.
Вопрос рецидивирующего и персистирующего течения БИК стал актуальным за последние 5 лет в связи с новыми данными о наблюдении пациентов с этим заболеванием. В опубликованных работах из центров, обладающих большим опытом в лечении БИК, на долю ремиссии после успешной операции приходится 70–90% в случаях микроаденом и 50–65% на пациентов с макроаденомами [5, 8, 9].
В отличие от персистирования заболевания для признания заболевания рецидивирующим необходимо наличие подтвержденной после операции ремиссии от нескольких месяцев до нескольких лет, на фоне которой вновь развивается симптомокомплекс клинических проявлений или лабораторная картина эндогенного гиперкортицизма. Критерии ремиссии и рецидива, к сожалению, не стандартизированы.
БИК рецидивируют приблизительно у 14% пациентов (5–21%) в интервале от 3 месяца до 13 лет (в среднем в течение 4,5 лет) течения заболевания [5, 9–11]. 50% рецидивов возникают в течение первых 3–5 лет после первичной операции [10–12]. Однако возможны и поздние рецидивы после десятилетий ремиссии. Именно поэтому ежегодный контроль за течением ремиссии служит основной рекомендацией ведения пациентов. Частота рецидивов сильно различается в разных исследованиях, скорее всего из-за разных хирургических подходов, а также продолжительности и качественности наблюдения за пациентами в послеоперационном периоде. Частота рецидивов, как и персистенция заболевания, выше при макроаденомах (до 30%), чем при микроаденомах (до 10%) [10, 11].
Ранняя предикция персистирующего течения или высокого риска рецидива БИК служит ориентиром для оценки лечебной тактики при выборе второй линии терапии. С учетом отсутствия ремиссии почти у половины пациентов после операции в случае макроаденомы и отсроченного ответа на лучевую терапию сохраняется необходимость в эффективном фармацевтическом лечении.
Сегодня медикаментозная терапия БИК представляет собой альтернативный, но необходимый вариант лечения пациентов, особенно с персистирующей или рецидивирующей формой заболевания.
Цель исследования: усовершенствовать и оптимизировать тактику выбора патогенетической медикаментозной терапии пациентов с персистирующим или рецидивирующим течением БИК.
Методы
В исследовании участвовал 51 пациент с подтвержденной БИК в активной стадии персистирующего и рецидивирующего течения, которому были определены показания к назначению медикаментозной терапии препаратами центрального типа действия.
Критерии включения: мужчины и женщины в возрасте от 18 до 80 лет с подтвержденным диагнозом БИК, наличие активной стадии эндогенного гиперкортицизма, информированное согласие на участие в исследовании.
Критерии невключения: возраст младше 18 и старше 80 лет, беременность, тяжелые заболевания печени и почек в течение последнего года, неконтролируемый сахарный диабет с гликированным гемоглобином (HbA1c) >9%, фиброзные изменения в легких, перикарде, острые жизнеугрожающие состояния, требующие лечения в отделениях интенсивной терапии, отказ в подписании формы информированного согласия.
Критерии исключения: развитие побочных эффектов на получаемую терапию, аллергические реакции, острые жизнеугрожающие состояния, требующие госпитализации, некомплаентность в процессе лечения.
Методы исследования:
- контроль массы тела (кг) с вычислением индекса массы тела (ИМТ, кг/м2);
- оценка контроля углеводного обмена по уровню глюкозы венозной плазмы натощак (ммоль/л), гликированного гемоглобина (НbА1с, %);
- содержания инсулина (мкЕД/мл), С-пептида (нг/мл);
- контроль липидного обмена по уровню общего холестерина (ХС, ммоль/л), холестерина липопротеинов низкой плотности (ЛПНП, ммоль/л);
- анализ функции почек по уровню креатинина (мкмоль/л) с расчетом скорости клубочковой фильтрации (СКФ, мл/мин/1,73 м2, рассчитанной по формуле CKD-EPI);
- анализ функции печени по уровню аланинтрансаминазы (АЛТ, ЕД/л) и аспарагинтрансаминазы (АСТ, ЕД/л);
- контроль активности эндогенного гиперкортицизма: кортизол крови (нмоль/л), кортизол слюны в 23.00 (нмоль/л), свободный кортизол суточной мочи (СКМ, нмоль/сут), адренокортикотропный гормон (АКТГ, пг/мл);
- контроль тестостерона (нмоль/л);
- контроль пролактина (мМЕ/л);
- электрокардиография с оценкой интервала QT с расчетом интервала QTc;
- ультразвуковое исследование органов брюшной полости с оценкой состояния желчного пузыря;
- МРТ гипоталамо-гипофизарной области с контрастированием с оценкой расположения, размера аденомы или структуры ткани гипофиза. Эффективность проводимого лечения оценивалась по объективным показателям снижения веса, цифр артериального давления, по показателям лабораторного контроля, отражающего активность эндогенного гиперкортицизма, а также по изменению размера аденомы гипофиза.
Безопасность назначенной терапии оценивалась по наличию и выраженности гипергликемии, впервые выявленного СД, появлению камней в желчном пузыре, удлинению интервала QTc, а также по появлению таких симптомов, как головокружение, головная боль, снижение артериального давления, диспепсические явления (тошнота, метеоризм), двукратному повышению уровня печеночных ферментов, повышению уровня креатинина. Безопасность планировали оценивать в те же периоды контроля, что и эффективность назначенной терапии, через 6 и 12 месяцев от начала лечения. При оценке безопасности терапии и нежелательных явлений проводился дополнительный контроль показателей, отклонившихся от референсных значений, через 3 месяца после отмены терапии.
Протокол исследования
Все пациенты, принявшие участие в исследовании, согласно критериям включения, были разделены методом случайных чисел на три группы, сопоставимые по полу, возрасту и основным показателям активности эндогенного гиперкортицизма.
На старте исследования после оценки и анализа лабораторных данных пациентам проведена корректировка по показаниям сахароснижающих, гиполипидемических и антигипертензивных препаратов.
Первой группе пациентов (n=18) назначен аналог соматостатина второго поколения пасиреотид в суточной дозе 1200 мкг/сут. Вторая группа пациентов (n=18) принимала агонист D2-дофаминовых рецепторов каберголин 2,0 мг в неделю. В третьей группе (n=15) применялась комбинация аналога соматостатина (пасиреотиод в дозе 600 мкг/сут) и агониста D2-дофаминовых рецепторов (каберголин 1,0 мг в неделю).
Оцениваемые объективные антропометрические показатели, лабораторные и инструментальные данные определяли эффективность и безопасность назначенной терапии в каждой группе исследования.
Наблюдение пациентов на фоне непрерывного проведения назначенной терапии планировалось в течение 12 месяцев с проведением контроля и анализа основных клинических, лабораторных и инструментальных показателей перед инициацией терапии, через 6 и 12 месяцев применения. При проведении исследования переносимость монотерапии пасиреотидом не позволила наблюдать всех пациентов в группе в течение 12 месяцев. В связи с этим для проведения анализа был выбран период непрерывного применения в течение 6 месяцев.
Методы статистической обработки данных
Для статистической обработки полученных данных использовали язык R, программное обеспечение RStudio (пакеты tidyverse, ggplot2, ggpubr, googlesheets4, tidymodels, rstatix). Нормальность распределения определялась с помощью критерия Шапиро–Уилка и Колмогорова– Смирнова, анализа значений асимметрии и эксцесса и построением графиков qqplot и гистограмм распределения. При изложении результатов пользовались методами параметрической и непараметрической статистики. Количественные показатели представлены в форме среднего значения (M)±стандартное отклонение (S) или как медиана (Me) 25 и 75 процентилей, номинальные показатели N и процент.
Для сравнения результатов между зависимыми неправильно распределенными выборками применяли критерий Манна–Уйтни. При сравнении нескольких выборок использовался критерий Краскела–Уоллиса. Для сравнения категориальных переменных строились таблицы частот, которые впоследствии проверялись с помощью теста χ2 с поправкой Йетса, при количестве человек в группе меньше 5 использовался очный тест Фишера с последующим проведением апостериорного анализа с поправкой на множественные сравнения методом Холма.
При проверке статистических гипотез нулевую гипотезу отвергали при уровне значимости менее 0,05.
Результаты
При инициации исследования три группы пациентов значимо не различались по возрасту и основным показателям активности эндогенного гиперкортицизма (табл. 1). В исследовании приняли участие женщины. Возраст пациентов в каждой группе составил 47,6±11,5, 52,7±11,4 и 50,8±11 лет соответственно.
Оценка основных исходных показателей активности эндогенного гиперкортицизма в группах не выявила значимых различий при сравнении веса, частоты сопутствующих заболеваний (СД, артериальная гипертензия), лабораторных показателей: кортизол крови (нмоль/л); кортизол слюны в 23.00 (нмоль/л); СКМ (нмоль/сут); АКТГ (пг/мл); тестостерон (нмоль/л); пролактин (мМЕ/л), при оценке данных углеводного и липидного обменов.
С целью оценки антипролиферативного эффекта были также изучены исходные характеристики аденом гипофиза у пациентов до начала терапии: средний размер аденомы на момент включения составил в группе 1 4±2,7, в группе 2 – 6,2±6,7, в группе 3 – 5,8±5 мм (p=0,678).
Контроль показателей эффективности лечения во всех группах проведен через 6 месяцев от начала терапии. Мы проанализировали снижение показателей активности эндогенного гиперкортицизма в зависимости от используемой схемы лечения. В табл. 2 приведена динамика основных показателей активности эндогенного гиперкортицизма на фоне проводимого лечения.
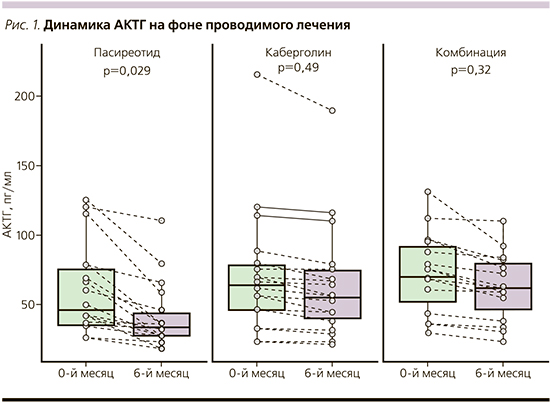
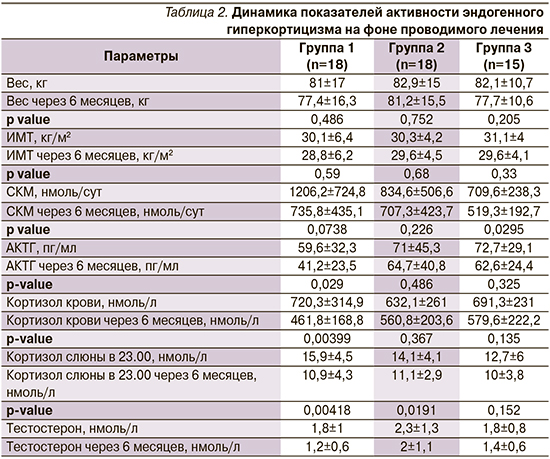
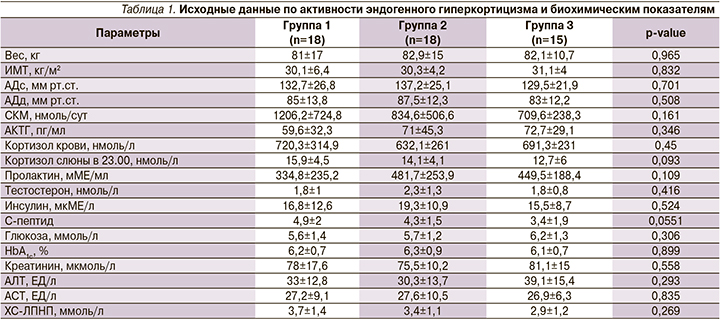
Статистически значимые результаты эффективности терапии получены в группе монотерапии пасиреотидом по динамике снижения кортизола суточной мочи, кортизола слюны в 23.00, кортизола крови, АКТГ.
В группе пасиреотида зарегистрирована лишь тенденция снижения уровня СКМ с 1206,2±724,8 до 735,8±435,1 нмоль/л (p=0,07), но достоверной разницы получено не было. Статистически значимо снизился уровень СКМ в группе 3 – с 709,6±238,3 до 519,3±192,7 (p=0,03). В группе 2 значимого снижения СКМ не наблюдалось (с 834,6±506,6 до 707,3±423,7; p=0,226; рис. 2).
Нормализации уровня СКМ в группе пасиреотида достигли 6 (30%) пациентов, снижения уровня СКМ более чем на 50% – 5 (27%). В группе каберголина нормализация уровня СКМ достигнута 4 (22 %) пациентами, в группе комбинации – 10 (67%). Снижения уровня СКМ более чем на 50% на фоне приема каберголина ни одним из пациентов достигнуто не было. На фоне комбинированной терапии указанный результат получен 2 (14%) пациентами.
При оценке уровня кортизола слюны в 23.00 (рис. 3) получено статистически значимое снижение в группах пасиреотида и каберголина (с 15,9±4,5 до 10,9±4,3; р=0,004, и с 14,1±4,1 до 11,1±2,9; р=0,02, соответственно). В группе комбинированной терапии кортизол слюны в 23.00 снизился с 12,7±6 до 10±3,8 без статистически значимой разницы (р=0,15). Статистически значимая динамика снижения АКТГ (рис. 1) с 59,6±32,3 до 41,2±23,5 пг/мл (р=0,03) и кортизола крови с 720,3±14,9 до 461,8±168,8 нмоль/л (р=0,004) наблюдалась в группе пасиреотида. В группах каберголина и комбинации двух препаратов наблюдалась только тенденция к снижению АКТГ с 71±45,3 до 64,7±40,8 пг/мл (р=0,486) и с 72,7±29,1 до 62,6±24,4 пг/мл (р=0,325), по снижению кортизола крови с 632,1±261 до 560,8±203,6 нмоль/л (р=0,367) и с 691,3±231 до 579,6±222,2 нмоль/л (р=0,135) соответственно.
Антипролиферативный эффект оценивался по динамике изменения объема аденомы гипофиза. Следует напомнить, что все пациенты, участвовавшие в исследовании, были ранее прооперированы. Оценивались как размеры оставшейся после операции ткани, так и ее изменения на фоне терапии. Антипролиферативный эффект был достигнут во всех группах. Размер опухоли в первой группе перед терапией составлял 4 [2,2; 5,8], через 6 месяцев – 3,5 мм [2; 5] (p=0,002), во второй группе перед терапией 4,5 [3,1; 6.4], через 6 месяцев – 4 мм [3; 6] (р=0,152), в группе комбинированной терапии объем аденомы не изменился: 4 [2,7; 7,5] до 4 [2; 6,5] мм (р=0,04) соответственно.
Для оценки безопасности проведен контроль показателей углеводного обмена и динамики секреторной активности β-клеток поджелудочной железы (табл. 3). Безопасность терапии в отношении функции почек и печени подтверждена во всех группах. Ни в одной группе не было получено отклонения показателей печеночных ферментов и функции почек.
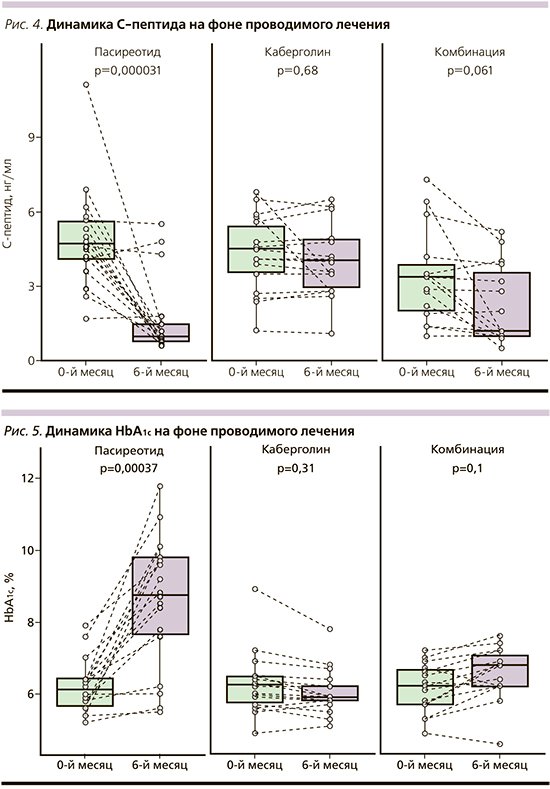
Статистически значимое снижение уровня инсулина с 16,8±12,6 до 4,6±4,1 мкМЕ/л (р=0,00001) и С-пептида с 4,9±2 до 1,7±1,5 нг/мл (р=0,00003; рис. 4) в группе пасиреотида закономерно привело к развитию гипергликемии в 78% случаев и впервые выявленному СД в 50% случаев. При этом отмечено повышение уровня глюкозы плазмы натощак с 5,6±1,4 до 8,3±1,9 ммоль/л (p=0,00007) и гликированного гемоглобина через 6 месяцев с 6,2±0,7 до 8,6±1,8% (p=0,0003; рис. 5), что потребовало назначения двухкомпонентной сахароснижающей терапии. В группе каберголина нарушений углеводного обмена зафиксировано не было, что не противоречит доступным данным по применению препарата. В группе комбинированной терапии пасиреотидом и каберголином гипергликемия зафиксирована в 73% случаев, при этом СД развился в 40% случаев. Однако стоит обратить внимание на то, что изменение гликемии с 6,2±1,3 ммоль/л до 7±1 (p=0,08)] и НbА1с с 6,1±0,7 до 6,6 0,8% (p=0,1) нивелировано назначением сахароснижающей монотерапии (рис. 5). При оценке нарушений ритма и сердечной проводимости удлинение интервала QTc в группе 1 составило 400,3±25,3, в группе 2 – 422,9±29,2, в группе 3 – 439,3±47,4 мс. Удлинение интервала QTc зарегистрировано в группах пасиреотида и комбинированной терапии в 44 и 13% случаев соответственно. При приеме каберголина нарушений работы проводящей системы сердца не зафиксировано.
В группе пасиреотида развивались метеоризм в 66,7%, тошнота в 27,8%, диарея в 33,3% случаев. При приеме каберголина диспепсических явлений не отмечено. В группе комбинированной терапии распределение было следующим: метеоризм в 33%, тошнота в 40%, диарея в 20% случаев. Следует отметить краткосрочность данных проявлений, которые при назначении симптоматической терапии удавалось нивелировать в течение недели.
На фоне проводимого лечения появление камней в желчном пузыре было выявлено: при монотерапии пасиреотидом в 44,4% случаев, у пациентов на комбинированной терапии почти в 1,5 раза реже – в 26,67% (p=0,004) случаев, на каберголине не отмечалось.
Головная боль чаще развивалась в группе каберголина (50% случаев) по сравнению с пасиреотидом (33%) и комбинированной терапией (13%; p=0,07). Эпизоды ортостатической гипотензии наблюдались чаще всего в группе каберголина – у 44,4% пациентов, в группе пасиреотида не отмечались; в группе комбинированной терапии у 26,7% пациентов (p=0,87). Аллергические реакции выявлены в 22, 11 и 13,1% случаев в 1-й, 2-й и 3-й группах соответственно (p=0,712).
Статистически значимые различия отмечены в возникновении следующих нежелательных явлений и осложнений: впервые выявленные СД (p=0,0007), гипергликемия (p=0,0000001), ЖКБ (р=0,004), брадикардия (р=0,001), метеоризм (р=0,00002), тошнота (р=0,007), ортостатическая гипотония (р=0,00302). При сравнении групп установлено, что статистически значимо чаще СД возникал в группе пасиреотида – 50,00% (9) по сравнению с каберголином – 0,00% (0; p=0,003) и в группе комбинированной терапии – 40,00% (6) по сравнению с каберголином – 0,00% (0; p= 0,009); различий между группами пареотида и комбинированной терапии отмечено не было (p=0,7). Гипергликемия отмечалась как нежелательное явление среди пациентов с уже имеющимся компенсированным СД на старте исследования. При сравнении групп отмечено, что статистически значимо чаще гипергликемия развивалась в группе пасиреотида – 77,78% (14) по сравнению с каберголином 0,00% (0; p=0,000005) и в группе комбинированной терапии – 73,33% (11; 0,000002), при терапии каберголином гипергликемия как нежелательное явление не развивалась. Брадикардия чаще возникала в группе пасиреотида – 44,44% (8) по сравнению с каберголином – 0,00% (0; p=0,009), в группе комбинированной терапии брадикардия возникала в 13,33% (2) случаев и не достигала статистической значимости (p=0,139) по сравнению с пасиреотидом и каберголином (p=0,199).
ЖКБ чаще возникала в группе пасиреотида – 44,44% (8) по сравнению с каберголином – 0,00% (0; p=0,009), в группе комбинированной терапии ЖКБ встречалась у 26,67% (4) больных и ее частота не достигала статистической значимости по сравнению с каберголином (p=0,07) и пасиреотидом (p=0,469).
Обсуждение
Существует несколько потенциальных терапевтических целей для лечения БИК [8, 13]. Недавние проспективные исследования продемонстрировали многообещающие возможности консервативного лечения [8, 13]. Медикаментозная терапия стала приобретать все большее значение в сфере лечения БИК, в основном из-за растущего числа доказательств эффективности и безопасности применяемых препаратов, что позволяет осуществлять персонифицированный подход к ее лечению. Выделяют три основных направления лечения БИК в зависимости от уровня контроля [13, 14]. Лекарственные препараты представлены средствами, действующими непосредственно на гипофиз (пасиреотид и каберголин), работающими на уровне надпочечников (ингибиторы стероидогенеза – кетоконазол, метирапон и митотан) и блокирующими глюкокортикоидные рецепторы в периферических тканях (мифепристон) [13, 14].
Основной целью лекарственной терапии на уровне надпочечников является блокирование стероидосинтеза, что обеспечивает прямой контроль над эндогенным гиперкортицизмом. Это наиболее распространенная группа лекарственных средств. Количество препаратов, действующих на пучковую зону коры надпочечников с целью снижения уровня кортизола, возрастает. Однако они не оказывают непосредственного влияния на причину БИК и в большинстве случаев имеют ограниченное применение из-за серьезных побочных эффектов [13–15, 17]. Концепция периферической терапии БИК основана на постулате, что на фоне блокирования глюкокортикоидных рецепторов непосредственно в тканяхмишенях будут нивелироваться эффекты гиперкортицизма. Представителем этой группы является мифепристон – антагонист рецепторов глюкокортикоидов II типа. Мифепристон увеличивает секрецию АКТГ за счет отрицательной обратной связи, что делает бесполезным определение уровней АКТГ и кортизола с точки зрения биомониторинга [16]. Поскольку биохимический маркер эффективности лечения отсутствует, потенциальную надпочечниковую недостаточность необходимо оценивать по изменениям лишь клинических признаков. На текущий момент мифепристон одобрен только в США.
Наиболее патогенетически оправданными при БИК являются препараты, действующие на кортикотропиному как причину развития заболевания. Таргетность терапии заключается в ингибировании секреции АКТГ и уменьшении объема опухолевой ткани [17, 18]. Доступные в настоящее время, эти препараты включают аналог соматостатина (пасиреотид) и агонист D2-дофаминовых рецепторов (каберголин). Однонаправленность терапии достигается путем воздействия на специфические рецепторы аденомы. Иммуногистохимический анализ подтвердил экспрессию всех 5 подтипов D2-дофаминовых рецепторов в передней доле гипофиза. В кортикотропиномах выявляется наиболее выраженная экспрессия ССР2 и ССР5 с акцентом на 5-й подтип [13, 17, 18]. Подобно рецепторам соматостатина, рецепторы дофамина широко экспрессируются в нейроэндокринных тканях и аденомах гипофиза, в т.ч. в 80% кортикотропином. Чаще всего обнаруживаются D1и D2-рецепторы, при этом большинство D2-рецепторов ассоциировано с ингибирующим действием [19].
Комбинированная терапия представляет собой ценный, хотя и недостаточно изученный, вариант лечения БИК. В настоящее время ни один из методов лекарственного воздействия не обладает 100%-ной эффективностью, поэтому синергия воздействий является логичным предложением для достижения биохимического контроля.
Назначение препаратов центрального типа действия ставит перед собой цель патогенетического влияния на развитие заболевания и клинических проявлений. Литературные данные неоднократно обсуждали эффективность монотерапии пасиреотидом (до 35–45%) [19] и каберголином (до 27%) [17–19]. Ограничениями при длительном применении терапии стали побочные эффекты, зарегистрированные при применении препаратов в максимальных дозах.
В нашем исследовании подтверждена эффективность как монотерапии пасиреотидом, так и комбинации двух препаратов центрального типа действия. При этом комбинированная терапия обеспечила многообещающие результаты при БИК. Комбинация каберголина и пасиреотида позволила добиваться нормализации СКМ и уменьшения симптомов гиперкортицизма в 67% случаев против 30% при монотерапии пасиреотидом и 22% при монотерапии каберголином. Снижение СКМ более чем на 50% за период наблюдения отмечен у 27% пациентов на пасиреотиде и в 14% случаев на фоне комбинированной терапии. Антипролиферативный эффект достигнут во всех группах. При этом статически значимый результат подтвержден в группе пасиреотида в виде уменьшения объема опухоли с 4 [2; 5,8] до 3,5 мм [2; 5] (p=0,002).
При оценке нежелательных явлений выявлены гипергликемия и СД в группах, получающих пасиреотид. Эти данные сопоставимы с литературными данными. В трех случаях манифестация неконтролируемого СД стала причиной отмены терапии. Однако отмена терапии по причине СД была отмечена только в группе монотерапии пасиреотидом. Не менее значимые результаты получены при оценке нарушений ритма и сердечной проводимости: удлинение интервала QTc зарегистрировано в группах пасиреотида и комбинированной терапии – в 44 и 13 % случаев соответственно, в группе каберголина нарушений ритма выявлено не было. Наибольшую безопасность продемонстрировала монотерапия каберголином. Специфические нежелательные явления в данной группе были статистически значимо представлены проявлениями ортостатической гипотонии в 44% случаях. В нашем исследовании комбинированная терапия продемонстрировала значимую безопасность и переносимость. Полученные результаты продемонстрировали, что потенциально комбинация двух препаратов центрального типа действия позволяет достигать при БИК как антисекреторного, так и антипролиферативного эффекта (при более длительном применении). При этом комбинированная терапия позволяет использовать более низкие дозы каждого препарата, следовательно, снижает частоту побочных эффектов без потери терапевтической эффективности. В перспективе возможность более длительного применения комбинированной терапии позволит обеспечить достижение терапевтических целей и как держать под контролем клиническую активность эндогенного гиперкортицизма, так и продемонстрировать антипролиферативный эффект.
Выводы
1. Анализ эффективности различных вариантов медикаментозной терапии пациентов с БИК препаратами центрального типа действия продемонстрировал преимущество применения аналогов соматостатина в виде как монотерапии, так и комбинированного лечения.
2. Комбинированная терапия аналогами соматостатина и агонистами D2-дофаминовых рецепторов имеет сопоставимую эффективность с монотерапией аналогами соматостатина по снижению активности эндогенного гиперкортицизма и антипролиферативному эффекту.
3. Анализ безопасности различных вариантов медикаментозной терапии пациентов с БИК препаратами центрального типа действия продемонстрировал преимущество агонистов D2-дофаминовых рецепторов в виде как монотерапии, так и комбинированного лечения.
4. Подтверждена рациональность применения комбинированной терапии за счет сопоставимой эффективности в сочетании с большей безопасностью при лечении гиперкортицизма. Это позволяет расширять показания для ее назначения в случае частичного ответа или непереносимости монотерапии пациентами с БИК на срок более 6 месяцев.



