Ювенильные спондилоартриты – группа клинически и патогенетически сходных ревматических заболеваний детского возраста, включающая ювенильный анкилозирующий спондилоартрит, ювенильный псориатический артрит, реактивные (постэнтероколитические и урогенные) артриты, ассоциированные с НLА-В27, синдром Рейтера, энтеропатические артриты при воспалительных заболеваниях кишечника (регионарный энтерит,язвенный колит) [1, 2].
Для ювенильных спондилоартритов характерны следующие особенности:
• преимущественная заболеваемость лиц мужского пола;
• особенности суставного синдрома, отличные от ревматоидного артрита по клинической характеристике, локализации и прогнозу;
• отсутствие ревматоидного фактора в сыворотке крови;
• частое вовлечение в патологический процесс позвоночника;
• высокая частота носительства НLA-В27;
• тенденция к семейной агрегации по НLА-В27-ассоциированным заболеваниям [1, 2].
Ювенильный анкилозирующий спондилоартрит (ЮАС) – хроническое воспалительное заболевание периферических суставов, сухожильносвязочного аппарата и позвоночника, начинающееся у детей до 16-летнего возраста и характеризующееся преимущественной заболеваемостью лиц мужского пола, тенденцией к семейной агрегации и ассоциацией с антигеном HLA-B27 [1].
Особенности клинической картины болезни у детей дают основание обсуждать ее нозологическую обособленность, подобно ювенильному ревматоидному артриту, четко отграниченному от ревматоидного артрита взрослых [1].
Точные данные о распространенности ювенильных спондилоартритов отсутствуют и базируются главным образом на математических расчетах. Наиболее удобной моделью таких расчетов является ЮАС. Если принять во внимание, что среди взрослых лиц белой расы манифестный анкилозирующий спондилоартрит (АС) встречается с частотой 2 : 1000 и выше, а среди всех случаев АС 15–30 % приходится на ювенильное начало, то распространенность ЮАС должна составлять от 0,03 до 0,06 % [3].
Ювенильным спондилоартритом заболевают 60–70 % детей в возрасте старше 10 лет, однако в редких случаях встречается раннее начало (до 7 лет), описан дебют ЮАС в 2–3-летнем возрасте. При ЮАС, как правило, поражаются крупные суставы нижних конечностей, пяточные области, суставы стоп, тазобедренные суставы, илеосакральные сочленения, поясничный отдел позвоночника. Развиваются
энтезопатии – спонтанные боли или боли, появляющиеся при пальпации в местах прикрепления связок и сухожилий к костям. Среди 80 % детей выявляется положительный результат типирования HLA-B27, ревматоидный фактор при этом отсутствует. У 5–10 % пациентов развивается острый иридоциклит.
В детском и подростковом возрасте течение ЮАС относительно доброкачественное, преимущественно рецидивирующее. Характерны длительные ремиссии, продолжительность которых иногда достигает 8–12 лет. Однако по мере взросления ребенка течение заболевания приобретает хронический прогрессирующий характер – особенно за счет нарастания симптомов поражения осевого скелета и коксита, в долгосрочном аспекте ЮАС свойствен более тяжелый прогноз в сопоставлении с АС взрослых [2, 4].
При большой давности ЮАС, как правило, уже в старшем возрасте причиной развития инвалидизации может быть деструкция тазобедренных суставов, требующая эндопротезирования, либо анкилозирование межпозвонковых суставов шейного отдела позвоночника. Поражение глаз редко имеет неблагоприятное течение; аортит ухудшает прогноз и может быть причиной летального исхода, что случается крайне редко. На летальность при ЮАС влияет амилоидоз, в связи с этим особую важность приобретает своевременное и адекватное лечение активного воспалительного процесса [2].
Лечение АС остается сложной проблемой. Большинство лекарственных средств, называемых “базисными препаратами” и применяемых при ревматоидном артрите, для больных АС малоэффективны или эффективны только в отношении отдельных проявлений болезни.
В патогенезе спондилоартрита существенное место принадлежит дисбалансу про- и противовоспалительных цитокинов [5]. В каскаде провоспалительных цитокинов ключевое значение имеет фактор некроза опухоли a (ФНО-α), обладающий воспалительной и иммунорегуляторной активностью [6]. Он способствует деструкции суставных поверхностей, принимает активное участие в костном ремоделировании и развитии внутрисуставного остеолиза, активирует лмфоциты и пролиферацию фибробластов, стимулирует синтез простагландинов и матриксных металлопротеиназ, включая коллагеназу и простагландин Е2, активирует остеокласты, регулирует продукцию многих хемокинов. Этот цитокин повышает экспрессию клеточных молекул адгезии, участвующие в миграции лимфоцитов в зону воспаления, индуцирует синтез интерлейкина-6 (ИЛ-6) и ИЛ-8, гранулоцитарно-макрофагального колониестимулирующего фактора, интерферона γ и др. [7].
Признание важной роли ФНО-α в патогенезе ревматических болезней привело к разработке генно-
инженерных биологических препаратов – ингибиторов ФНО-α – моноклональных антител и растворимых рецепторов к цитокину.
Основным преимуществом “биологической” терапии является максимальная избирательность воздействия на иммунную систему, позволяющая устранять необходимое звено в патогенетической цепи, не воздействуя на клетки других органов и систем. Высокая специфичность антител и рецепторов исключает возможность их неспецифических влияний на другие иммунологические механизмы. Ингибиторы ФНО-α с успехом применяются при наиболее тяжелых вариантах серонегативных спондилоартритов у взрослых [7, 8].
Угроза инвалидизации детей, больных спондилоартритом, определяет необходимость разработки и внедрения новых подходов к патогенетической терапии этого заболевания, рефрактерного к терапии классическими иммунодепрессантами [9, 10]. Такими препаратами могут стать ингибиторы ФНО-α.
Клинический случай
Хотим представить историю болезни мальчика с тяжелым дебютом ЮАС, успешно лечившегося растворимыми рецепторами к ФНО-α.
Больной И., возраст – 14 лет, наблюдается в ревматологическом отделении Научного центра здоровья детей РАМН с января 2011 г. Наследственный анамнез по ревматическим болезням не отягощен.
Мальчик заболел в ноябре 2010 г. в возрасте 12 лет, когда после травмы появились припухлость, болезненность и ограничение движений во втором пястно-фаланговом суставе правой кисти. К врачам не обращались, ребенок не лечился. Боль и припухлость в пораженном суставе самостоятельно уменьшились, ограничение движений сохранялось. Через месяц, в декабре 2010 г., мальчик перенес острое инфекционное заболевание с лихорадкой до 38,5 °С, однократной рвотой, умеренными болями в животе. Через неделю у ребенка появились боль, припухлость и ограничение движений в коленных
суставах. Родители обратились к врачу. В стационаре по месту жительства было проведено обследование, при котором по данным рентгенографии и ультразвукового исследования (УЗИ) коленных суставов был выявлен синовит. Ребенку установлен диагноз “реактивный артрит”. Назначены нимесулид и антибактериальный препарат группы пенициллинов. Эффекта от проводимой терапии не было.
В январе 2011 г. родители мальчика впервые обратились за помощью в ревматологическое отделение Научного центра здоровья детей РАМН. При поступлении состояние ребенка было расценено как тяжелое, температура тела повышалась до субфебрильных цифр. Несмотря на небольшую длительность заболевания, суставной синдром уже носил асимметричный полиартикулярный характер с выраженной припухлостью, болью и ограничением движений в коленных суставах; сгибание ног было крайне болезненным, занимало несколько минут, а пальпация доставляла мальчику сильное беспокойство. Также выявлялись воспалительные изменения в правом грудиноключичном сочленении, припухлость, болезненность и ограничение движений во втором пястно-фаланговом суставе правой кисти, в правом тазобедренном суставе. Поражение суставов привело к значительному нарушению
походки ― мальчик ходил на полусогнутых ногах вследствие сгибательных контрактур в коленных суставах, при ходьбе сгибал спину, приволакивал правую ногу. По утрам ребенок плохо вставал, при пробуждении чувствовал сильную боль в пораженных суставах нижних конечностей, утренняя скованность длилась 2 часа.
При обследовании выявлено ускорение СОЭ до 18 мм/ч, повышение сывороточной концентрации
С-реактивного белка (СРБ) в 3 раза –до 14 мг/л (норма до 5 мг/л), ревматоидный фактор и антитела к циклическому цитрулиновому пептиду отсутствовали. По данным УЗИ, отмечен синовит обоих коленных суставов. Ребенок осмотрен окулистом – выявлена миопия слабой степени. У пациента были исключены хламидиоз, микоплазмоз, сальмонеллез, шигиллез, герпетическая, цитомегаловирусная и Эпштейна–Барр вирусные инфекции. Проведены эзофагогастродуоденоскопия и ректороманоскопия
для исключения патологии верхних отделов желудочно-кишечного тракта и воспалительных заболеваний кишечника. При серологическом исследовании крови выявлены антитела к иерсиниям класса иммуноглобулиров G (IgG) в титре 275 усл. ед. (норма – 0–24 усл. ед.), класса IgA в титре 272 усл. ед.(норма – 0–24 усл. ед.), что свидетельствовало о перенесенном иерсиниозе. Мальчику был установлен диагноз “постэнтероколитический реактивный артрит”. Было продолжено лечение нестероидными противовоспалительными средствами (НПВС) и проведен курс антибактериальной терапии препаратом из группы аминогликозидов в течение 10 дней. На фоне лечения антибиотиком уже через 7 дней титр антител к иерсиниям вдвое снизился, а через месяц антитела к иерсиниям классов IgA и IgG в крови не определялись.
Несмотря на сероконверсию, состояние ребенка ухудшилось: наросли экссудативные изменения в коленных суставах, длительность утренней скованности увеличилась до 3 часов, наросла инвалидизация, повысились лабораторные показатели активности: СОЭ – до 43 мм/ч, сывороточной
концентрации СРБ ― до 26,05 мг/л. Сохранялись ежедневные подъемы температуры тела до субфебрильных цифр; появились энтезопатии в области илеосакральных сочленений и пяточных костей, ригидность в поясничном отделе позвоночника (проба Томмайера — положительная, мальчик
не доставал до пола 25 см).
С учетом болезненности в области илеосакральных сочленений проведена магнитно-резонансная томография (МРТ) костей таза и поясничного отдела позвоночника. По данным МРТ, у ребенка отмечено развитие двустороннего сакроилеита, проявившегося отеком мягких тканей с обеих сторон, расширением суставной щели и деструктивными изменениями хрящевой ткани справа. По данным
иммуногенетического исследования, ребенок является носителем антигена HLA-B27. Мальчик повторно осмотрен окулистом, выявлены начальные признаки острого переднего увеита, которые быстро купировались на фоне местного лечения в виде инстилляций препаратов, содержащих глюкокорти-
коидные гормоны.
На основании данных анамнеза и осмотра (асимметричный полиартрит с поражением коленных, правого тазобедренного суставов, второго пястно-фалангового сустава правой кисти, правого грудино-ключичного сочленения; энтезопатии в области проекции илеосакральных сочленений и
пяточных костей; ригидность в позвоночнике; острый передний увеит) и лабораторно-инструментальных исследований (ускорение СОЭ до 43 мм/ч, повышение уровня СРБ в 5 раз, наличие HLA-B27, сакроилеит по данным МРТ), мальчику был установлен диагноз “ювенильный анкилозирующий
спондилоартрит, активность 3-й степени, рентгенологическая стадия 1, функциональный класс – 3.
Анализ состояния ребенка свидетельствовал о дебюте ЮАС с агрессивным течением уже на ранних стадиях. За первые месяцы болезни у мальчика развились асимметричный полиартрит, значительная функциональная недостаточность, наросла инвалидизация. Мальчик был практически обездвижен
и нуждался в посторонней помощи. Терапия НПВС обычно значительно облегчает страдания таких пациентов. Однако в нашем случае применение НПВС не было эффективным. Наличие у ребенка факторов неблагоприятного прогноза заболевания, таких как острое начало, агрессивное течение,
быстрое развитие асимметричного полиартрита, сакроилеита, высокие лабораторные показатели активности процесса, наличие HLA-B27, раннее вовлечение в патологический процесс глаз, было основанием для решения вопроса об иммуносупрессивной терапии. Препаратами выбора могли стать преднизолон в средних дозах для перорального приема, внутрисуставное введение глюкокортикоидов и сульфасалазина. Однако было принято решение от применения глюкокортикоидов отказаться в связи с наличием у них выраженных побочных эффектов, а от назначения сульфасалазина в связи с его недостаточной эффективностью при таком тяжелом течении заболевания. Предпочтение было отдано биологической терапии генноинженерным препаратом этанерцепт (Энбрел, Пфайзер Эйч. Си. Пи.
Корпорэйшн, США), который представляет собой комбинированный препарат, состоящий из Fc-фрагмента IgG человека и рекомбинантных димерных форм растворимых ФНО рецепторов р75 [11]. Этанерцепт на 100 % состоит из человеческого белка, что отличает его от инфликсимаба, который в своем составе содержит 25 % мышиного белка [11–13].
Эффективность монотерапии этанерцептом и его комбинации с метотрексатом была показана в открытых нерандомизированных и рандомизированных контролируемых исследованиях взрослых с АС и детей с ювенильным идиопатическим артритом [7, 8, 14–25]. В одном из исследований проведена оценка эффективности этанерцепта для 164 детей с различными вариантами ювенильного идиопатического артрита (ЮИА), из них 45 (27 %) больных – с системным вариантом, 63 (38 %) – с серонегативным полиартритом, 31 (19 %) – с олигоартритом. Как показали результаты исследования, 30 %-ное улучшение по педиатрическим критериям Американской коллегии ревматологов (АКР педи)
было отмечено через 3 месяца терапии этанерцептом. Клинико-лабораторная ремиссия зарегистрирована для 59 (36 %) пациентов с поли- и олигоартритом. Наименее эффективной терапия этанерцептом была для детей с системным вариантом болезни, что отражает общую статистику эффективности ингибиторов ФНО-α [15].
В исследовании, включившем 40 пациентов с ЮИА, оценивалось влияние этанерцепта на прогрессирование костно-хрящевой деструкции [16]. Результаты исследования показали, что 30, 50 и 70 %-ное улучшение по АКРпеди было зарегистртровано среди 77, 72 и 50 % пациентов соответственно. Кроме того, среднее изменение костно-запястного индекса Познански через год от начала терапии составило +0,3, что свидетельствует о наличии у этанерцепта потенциальной способности замедлять костно-хрящевую деструкцию.
Одно из самых длительных исследований по оценке эффективности и безопасности терапии этанерцептом пациентов с ЮИА проводилось на протяжении 8 лет [17]. В исследование вошли 69 больных, из них 42 ребенка лечились этанерцептом в течение 4 лет, 26 – в течение 8 лет. Среди 100 % пациентов было зарегистрировано 70 %-ное улучшение по АКРпеди через 8 лет терапии. Случаев
туберкулеза, оппортунистических инфекций, онкологических заболеваний, лимфом, системной красной
волчанки, демиелинизирующих заболеваний и смерти не отмечено. Таким образом, на протяжении 8 лет терапии этанерцептом допустимое число нежелательных реакций не повышалось, а клиническое улучшение сохранялось для всех пациентов, продолжавших лечение. Исследований эффективности применения этанерцепта при ЮАС немного. Препарат применялся как в сочетании с глюкокортикоидами для перорального приема и метотрексатом, так и в виде монотерапии. Результаты
этих немногочисленных исследований показали, что этанерцепт высокоэффективен при ЮАС как в виде монотерапии, так и в сочетании с иммуноподавляющими препаратами [25].
С учетом положительных результатов клинических исследований эффективности и безопасности применения этанерцепта детьми больному И. была начата терапия препаратом в дозе 25 мг на введение в виде подкожных инъекций 2 раза в неделю. До начала лечения было проведено полное обследование с целью исключения активного и латентного туберкулеза (проведен диаскин-тест и компьютерная томография органов грудной клетки). Оценка эффективности терапии проведена по критериям 30, 50, 70 %-ное улучшение. Эти критерии включают следующие показатели: оценку пациентом (родителями) общего состояния здоровья, оценку врачом активности болезни с помощью визуальной аналоговой шкалы (ВАШ – минимально возможное значение 0, максимальное ― 100 баллов), функциональную способность по индексу CHAQ (the Children Health Assessment Questionnaire ―минимально возможное значение – 0, максимальное – 3 балла), число суставов с активным артритом, число суставов с нарушением функции (ограничением движений) и СОЭ.

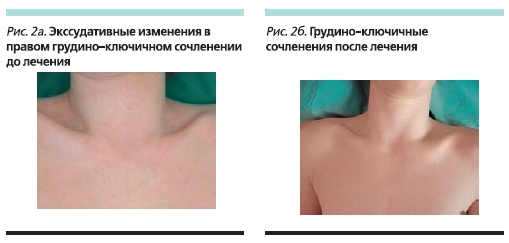
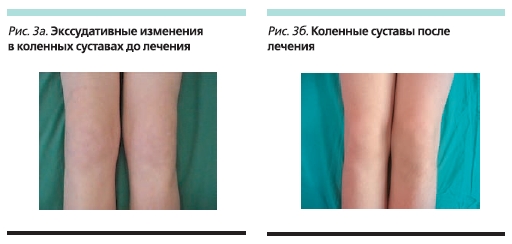
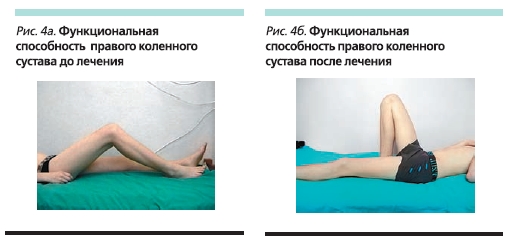
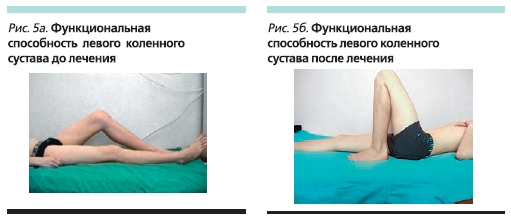
До начала терапии этанерцептом состояние мальчика расценивалось как тяжелое: продолжительность утренней скованности составляла до 180 минут, отмечены слабость, артралгии, особенно в утренние часы, пациент самостоятельно не мог встать с постели (рис. 1а). При осмотре ребенка выявлены припухлость правого грудино-ключичного сочленения (рис. 2а), выраженные боли, припухлость и ограничение дви-жений в коленных суставах (рис. 3а, 4а, 5а), боль и ограничение движений в правом тазобедренном суставе, припухлость и болезненнность во втором пястно-фаланговом суставе правой кисти. Также определены энтезопатии в области илеосакральных сочленений и бугров пяточных костей, ригидность в поясничном отделе позвоночника (см. таблицу). В коленных суставах определены сгибательные контрактуры. Отмечено ограничение функциональной активности ребенка: походка была нарушена, на корточки не садился, наклониться мог с трудом, самостоятельно себя не обслуживал.
Лечение этанерцептом было начато 9 февраля 2011 г. Мальчик продолжал получать НПВС. Побочных реакций на введение этанерцепта не было. К настоящему моменту длительность лечения составляет 1 год.
Анализ темпов развития эффекта анти-ФНО-α. терапии показал, что уже на следующий день после первой инъекции препарата уменьшилась выраженность боли в суставах, купировалась лихорадка. После второй инъекции уменьшилась продолжительность утренней скованности, мальчик стал легче вставать по утрам после сна. В контрольном клиническом анализе крови через неделю от начала терапии значительно снизилась СОЭ (см. таблицу).
Таблица. Динамика клинических и лабораторных показателей активности заболевания на фоне терапии этанерцептом больного И..
Через 4 недели от начала лечения этанерцептом в состоянии ребенка отмечена значительная положительная динамика: исчезла утренняя скованность, с самого утра мальчику больше не требовалась помощь в самообслуживании, движения в суставах стали безболезненными, купировались экссудативные изменения, нарос объем движений во всех группах суставов, наросла общая активность ребенка. Активность заболевания по ВАШ снизилась, по мнению как врача, так и родителей пациента; зарегистрирована ремиссия увеита, местного лечения не требовалось. По данным лабораторных исследований, нормализовались СОЭ и сывороточный уровень СРБ. Уже через 4 недели от начала терапии у ребенка была зафиксирована стадия неактивной болезни, о чем свидетельвовало отсутствие признаков активного артрита, ремиссия увеита, нормализовались лабораторные показатели (показатели СОЭ, СРБ) активности. Мальчику были отменены НПВС. Положительный эффект сохранился к 12-й и 24-й неделям наблюдения, активности болезни по ВАШ не было, по мнению как врача, так и родителей ребенка.
В настоящее время больному проводится терапия этанерцептом в течение 52 недель. Мальчик чувствует себя хорошо (рис. 1б). Островоспалительных изменений в коленных и мелких суставах и грудино-ключичных сочленениях нет (рис. 2б, 3б), во всех группах суставов восстановился полный объем движений (рис. 4б, 5б). Все движения безболезненны, ригидности в позвоночнике и энтезопатий нет. Ребенок себя обслуживает, свободно ходит на цыпочках, пятках, приседает, достает руками до пола. В клиническом и иммунологическом анализах крови все показатели в нормальных пределах.
Мальчика постоянно осматривает окулист. Весь период наблюдения увеит находится в неактивном состоянии. Местно лечение увеита не проводится. Оценка эффективности терапии этанерцептом, по критериям АКРпеди, показала, что к 4 неделям было достигнуто 70 %-ное улучшение, к 12-й и 24-й – 90 %-ное. К 7 месяцам была зафиксирована клинико-лабораторная ремиссия (см. таблицу). Высокая эффективность лечения этанерцептом обеспечила повышение качества жизни ребенка и его семьи.
В дебюте заболевания мальчик самостоятельно себя не обслуживал, требовалась посторонняя помощь,
существовали трудности адаптации в домашней, повседневной и школьной жизни. Через год лечения ребенок полностью адаптировался, самостоятельно справляется с работой по дому, посещает школу и дополнительные занятия по интересам наравне со своими сверстниками, успешно занимается в секции плавания. О повышении качества жизни ребенка свидетельствует положительная динамика индекса качества жизни по CHAQ (см. таблицу)
Через год от начала терапии этанерцептом была проведена повторная МРТ и компьютерная томография костей таза, показавшие полное купирование воспалительного процесса в илеосакральных сочленениях, восстановление хрящевой ткани и отсутствие деструктивных изменений костной ткани суставов. За год наблюдения ребенок вырос на 18 см, что невозможно было бы при сохраняющейся высокой активности заболевания и применении глюкокортикоидных гормонов.
Анализ представленного клинического случая демонстрирует дебют ЮАС с агрессивным течением, характеризующийся быстрым развитием инвалидизации. Уже в дебюте ребенок перестал себя обслуживать и был неспособен выполнять элементарные действия. В отделении было принято решение воздерживаться от назначения стандартной иммуноподавляющей терапии в связи с быстрым ухудшением состояния пациента и достаточно медленным развитием терапевтического эффекта иммунодепрессантов. Также не стали назначать глюкокортикоиды для перорального приема с учетом их нежелательных эффектов. Быстро подавить активность заболевания удалось благодаря успешному применению растворимых рецепторов к ФНО-α этанерцепта. Уже после первых инъекций препарата у ребенка снизилась активность болезни. Применение препарата в течение года индуцировало клинико-
лабораторную ремиссию и обеспечило повышение качества жизни мальчика до уровня здоровых сверстников.
Анализ скорости наступления и выраженности терапевтического эффекта этанерцепта показал, что применение препарата на ранних стадиях болезни позволяет быстро добиваться ремиссии, полностью восстанавливать функцию суставов, предотвращать прогрессирование деструкции в суставах и инвалидизацию пациентов. Считаем оправданным раннее включение в схему лечения ЮАС современных, высокоэффективных методов лечения, таких как генно-инженерные биологические препараты (ГИБП). быстро достигать желаемого результата, снижать активность заболевания, избавлять ребенка от тяжелых страданий, предотвращать развитие необратимых или труднообратимых изменений. ГИБП дают возможность растущему организму формироваться в соответствии с возрастными нормами, вести нормальный, полноценный образ жизни, позволяют детям с тяжелыми ревматическими заболеваниями строить планы на будущее и их реализовывать.



