Введение
Атопический дерматит (АтД), по данным E. Kowalska-Olędzka et al. на Европейском континенте встречается среди 8% (3,0–17,6%) населения [1, 2] У ВИЧ-инфицированных больных с предрасположенностью к развитию аллергических заболеваний риск развития АтД и бронхиальной астмы существенно выше, чем в обычной популяции [3]. Системная терапия АтД у ВИЧ-инфицированных больных имеет свои ограничения, связанные с возможными побочными эффектами иммуносупрессивных препаратов [4].
При этом возможности использования селективных и обратимых ингибиторов Янус-киназ в отношении ВИЧинфицированных пациентов обсуждается в отечественной и зарубежной литературе [5, 6]. Наиболее часто исследователей беспокоят возможное развитие нежелательных явлений (НЯ) под воздействием ингибиторов иммунного ответа, вероятность ухудшения течения самой ВИЧ-инфекции и появления инфекционных осложнений.
Нами проведено исследование эффективности и безопасности препарата Барицитиниб 4 мг, селективного и обратимого ингибитора Янус-киназ-1 и -2 (JAK1 и JAK2) для ВИЧ-инфицированных больных среднетяжелым и тяжелым АтД в рекомендуемых дозировках и способом, предложенным производителем.
Цель исследования: оценить возможности применения препарата Барицитиниб ВИЧинфицированными больными АтД.
Материал и методы
Дизайн исследования
Исследование проведено с участием шести ВИЧ-инфицированных пациентов, которым был верифицирован диагноз среднетяжелого или тяжелого АтД. Перед включением в исследование всем пациентам на своих базах проведено скрининговое обследование с целью оценки возможности применения ими ингибиторов Янус-киназ. После подписания добровольного согласия пациенты были включены в исследование.
Все больные АтД ранее получали различные эмоленты 1–3 раза в день, кремы и мази, содержавшие высокоактивные глюкокортикостероиды – 2 человека, 0,1%-ный такролимус – 2; 1%-ный пимекралимус – 2; антигистаминные препараты (цетиризин 10 мг и др.) получали все больные. Внутримышечно бетаметазон суспензию 2 мг получали 4 человека, гидроксизин 25 мг – 5.
На момент включения в исследование и весь период наблюдения пациенты продолжали прием антиретровирусной терапии (АРТ). За время наблюдения пациентам было разрешено использовать эмоленты, гклюкокортикостероидные мази со слабой и умеренной противовоспалительной активностью.
Препарат Барицитиниб, регистрационный номер в РФ – ЛП-005270, принимался ВИЧ-инфицированными пациентами внутрь 1 раз в сутки, в любое время независимо от приема пищи. У пациентов, получавших Барицитиниб, контролировали вирусную нагрузку РНК ВИЧ, количество CD4+-лимфоцитов перед включением в исследование и через 12 недель от начала терапии, а также стандартные параметры крови и мочи: общий анализ крови, общий анализ мочи, глюкозу крови, гемоглобин, количество лимфоцитов, нейтрофилов, креатинин, креатинкиназа, АЛТ, АСТ, ГГТ, ЩФ – ежемесячно, в лабораториях на основных базах.
Общая продолжительность лечения каждого пациента в рамках исследования составила 12 недель. Исследование выполнено в рамках диссертационной работы, согласно одобренному протоколу Локальным этическим комитетом ФБУН Центрального НИИ эпидемиологии Роспотребнадзора. Набор пациентов осуществлялся с января по август 2021 г. Анализируемый этап (12 недель) был завершен последним участником в марте 2022 г.
Критерии отбора в исследование
Ключевые критерии отбора в исследование: наличие подписанного информированного согласия пациента, возраст от 18 до 45 лет, наличие АтД среднетяжелой и тяжелой степеней в течение последних 6 месяцев, для верификации диагноза использовали диагностические критерии J.M. Hanifin и G. Rajka (сочетание трех основных и не менее трех дополнительных критериев АтД). Тяжесть АтД оценивалась на момент включения в исследование, подразумевала наличие клинических проявлений заболевания и проведение оценки индекса SCORAD (Scoring of Atopic Dermatitis). Легким течение АтД считалось при значениях SCORAD <25 баллов, умеренно-тяжелым SCORAD – 25–50 и при значениях SCORAD >50 течение АтД считалось тяжелым.
Всем пациентам, включенным в исследование, была показана местная и системная терапия АтД. В исследование не включались пациенты на стадии ВИЧ-4Б и последующих, с активными воспалительными заболеваниями, тяжелыми заболеваниями сердечно-сосудистой, дыхательной и эндокринной систем, аутоиммунными заболеваниями и другими состояниями, которые могли бы влиять на результаты исследования или создавать избыточные риски для жизни и здоровья пациентов.
Характеристика группы
В группу больных вошли пациенты, проживавшие в Москве и Московской области, из которых мужчин было 4 (66,7%), женщин 2 (33,3%). Исходные характеристики ВИЧ-инфицированных пациентов, включенных в группу, представлены в табл. 1.
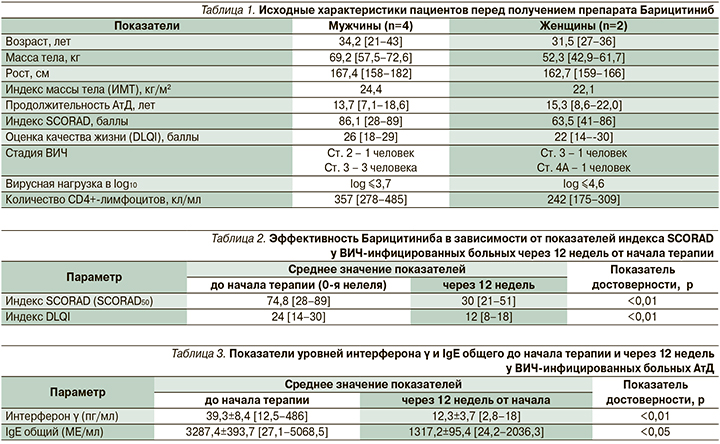
Средняя продолжительность ВИЧинфекции – 3,8 года (min – 0,7, max – 11 лет), продолжительность АРТ в среднем составила 3,4 года (min – 0,5, max – 9,6).
Параметры оценки
В рамках исследования анализировались эффективность и безопасность препарата Барицитиниб для ВИЧинфицированных больных АтД. Эффективность проводимой терапии оценивалась посредством анализа дерматологических индексов:
SCORAD (Scoring of Atopic Dermatitis). В качестве конечных точек оценивались доли пациентов, достигших 50и 75%-ного улучшения индекса SCORAD. Оценку эффективности проведенного лечения проводили с применением индекса SCORAD50, расчет выполняли по формуле:

Оценивали интенсивность снижения индекса SCORAD50 >50% от исходного; SCORAD75 >75 % [7].
Оценивалась также динамика индекса DLQI.
Улучшением считалась позитивная динамика не менее 50% от первоначального значения SCORAD и улучшение индекса качества жизни на 12-й неделе.
Оценка безопасности
Безопасность Барицитиниба признавалась для всех 6 (100%) пациентов. Оценка проводилась на основании оценки частоты развития случаев НЯ у больных, случаев серьезных НЯ, случаев НЯ, связанных с терапией, случаев тяжелой токсичности (НЯ 3–4-й степеней), случаев досрочного выбывания пациентов в связи с НЯ. Классификация НЯ осуществлялась согласно общим терминологическим критериям для нежелательных явлений 4.03 пересмотра (CTCAE v. 4.03) [8].
Полученные результаты
Полученные результаты представлены в табл. 2.
У ВИЧ-инфицированных больных, получавших Барицитиниб, отмечено выраженное улучшение показателей индексов SCORAD и DLQI, что свидетельствует об улучшении течения АтД. У троих больных позитивная динамика АтД достигла улучшения SCORAD50 на 46–57% по сравнению с первоначальными значениями SCORAD, улучшение показателей SCORAD на 75% от первоначальных значений отмечено у 3 (50%) больных (70–78%).
Оценку интенсивности кожного зуда проводили согласно рекомендациям к шкале ВАШ (визуально-аналоговая шкала) по оценке интенсивности зуда пациентом [9]; динамика изменений показана на рисунке.
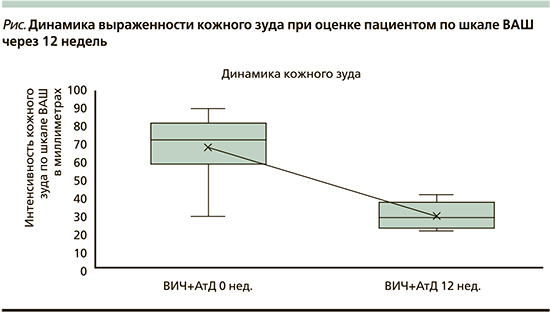
На графике отмечается выраженное снижение медианы интенсивности кожного зуда по шкале ВАШ через 12 недель (74,8 на 0-й неделе и 27,8 на 12-й; р<0,01).
Всем больным перед началом исследования и через 12 недель проводилась оценка уровней интерферона γ и IgE общего в периферической крови. Результаты приведены в табл. 3.
Отмечается позитивное влияние Барицитиниба на показатель кожного зуда и экспрессию интерферона-γ и IgE общий [10, 11].
Динамика показателей ВИЧинфекции до начала исследования и через 12 недель приведена в табл. 4.
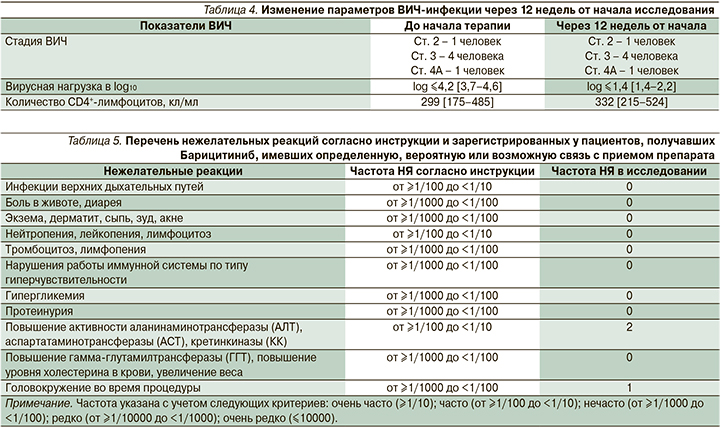
У пациентов не выявлено ухудшения параметров течения ВИЧ-инфекции.
В рамках проведенного исследования у ВИЧ-инфицированных пациентов с АтД препарат Барицитиниб показал благоприятный профиль безопасности. Применение Барицитиниба характеризовалось хорошей переносимостью и продемонстрировало благоприятный профиль безопасности по спектру НЯ. В ходе анализируемого этапа исследования не зарегистрировано ни одного случая досрочного выбывания пациентов, случаев отмены терапии или переноса приема препарата по причинам развития токсичности.
Все зарегистрированные НЯ, связанные с принятием препарата, имели легкую степень тяжести, определяемую по СТСАЕ v.4.03, и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Барицитиниб, в ходе исследования не было. Согласно инструкции к препарату Барицитиниб, нежелательные реакции представлены в соответствии с MedDRA (Медицинский словарь нормативно-правовой деятельности) [8].
Зарегистрированные НЯ имели легкую и умеренную степени (1–2) по критериям СТСАЕ 4.03; так, тошноту через 1–2 часа после приема Бацитириниба отметили 2 человека, выраженность симптома была незначительной, обращения к врачу не потребовалось, к утру следующего дня тошнота самостоятельно разрешилась. В контрольном анализе крови двоих пациентов после первого месяца приема препарата было отмечено повышение АЛТ, АСТ и КК на 20–25 МЕ/л выше верхней границы нормальных значений, при дальнейшем наблюдении у конкретных пациентов, подобных отклонений отмечено не было. Одна пациентка отметила появление слабости в момент приема Бацитириниба, которая самостоятельно разрешилось через 30 минут без дополнительных пособий.
Выводы:
- Селективный иммунодепрессант на основе Барицитиниба может использоваться ВИЧ-инфицированными больными.
- ВИЧ-инфицированные больные, страдающие АтД, хорошо переносят Барицитиниб, он не оказывает существенных побочных эффектов.
- При лечении АтД у ВИЧинфицированных больных Барицитиниб показал хорошую клиническую эффективность.



