Актуальной проблемой современной кардиологии служит прогрессирующая сердечная недостаточность (СН) после перенесенного инфаркта миокарда (ИМ) [1]. Выключение из акта сокращения определенного участка сердечной мышцы сопровождается комплексом структурно-функциональных изменений, включающих как поврежденные, так и интактные сегменты миокарда. Изменения структуры левого желудочка (ЛЖ), его геометрии часто предшествуют клиническому проявлению хронической CН (ХСН), являются предвестниками декомпенсации сердечной деятельности и отрицательно влияют на качество жизни и выживаемость пациентов [2–4].
Внедрение в практическую деятельность современных методов реваскуляризации миокарда в остром периоде заболевания позволило снизить в дальнейшем риск развития повторных коронарных событий [5]. Вместе с тем нет окончательного мнения о влиянии реперфузии на постинфарктное ремоделирование сердца, течение и выраженность ХСН в отдаленные сроки после перенесенного ИМ [2, 5]. По мнению ряда авторов, с одной стороны, реваскуляризация может замедлять ремоделирование ЛЖ, улучшать функцию миокарда за счет увеличения коллатерального кровоснабжения.
С другой стороны, существует потенциальный риск, связанный с осложнениями реперфузионного лечения, а также утраты коллатерального кровотока из соседних регионов вследствие ликвидации градиента давления между артерией-донором и артерией-реципиентом [2, 4]. Кроме того, активация нейрогуморальных систем у больных ИМ, первоначально направленная на компенсацию сердечной деятельности в ответ на гемодинамическую перегрузку и уменьшение массы функционирующего миокарда, в последующем может приводить к развитию ремоделирования ЛЖ, снижению коронарного резерва и появлению симптомов СН [3]. В связи с этим коррекция активности нейрогуморальных систем у больных в ранние и отдаленные сроки ИМ служит одним из основных направлений лечения заболевания и профилактики его осложнений. Кроме того, эффективность проводимых мер зависит от регулярности приема лекарственных препаратов [6].
В связи с этим целью работы стало изучение особенностей структурно-функционального ремоделирования ЛЖ и развития ХСН у больных, перенесших ИМ, с учетом способа реваскуляризации и приверженности терапии.
Материал и методы
В исследование включены пациенты (n=101), которые находились на лечении в отделении кардиологии № 1 сосудистого центра ГБУ РО «Ростовская областная клиническая больница» по поводу острого ИМ с подъемом сегмента SТ. Средний возраст больных, из которых 81,9% были мужчины, составил 56±9,99 года.
Все больные были распределены в группы с учетом проведения и способа реваскуляризации: 1-ю группу (n=28; 27,7%) составили пациенты, которым была выполнена только тромболитическая терапия (ТЛТ), 2-ю (n=42; 41,6%) – пациенты с проведенным чрескожным коронарным вмешательством (ЧКВ), причем в 50% случаев выполнению ЧКВ предшествовала ТЛТ (фармакоинвазивная стратегия). В 3-ю группу (n=31; 30,7%) включались больные без реперфузии в остром периоде ИМ, которым проводилась только оптимальная медикаментозная терапия. Следует отметить, что время от развития боли в груди до проведения ТЛТ составило в среднем 2,93±1,24 часа, среднее время от момента первого медицинского контакта до выполнения ЧКВ – 5,24±2,23 часа. Повторно через год после перенесенного ИМ пациентам выполнены эхокардиография (ЭхоКГ) и допплер-ЭхоКГ на аппарате MyLab 70 (Esaote, Италия) c использованием трансторакальных датчиков 3,5/5,0 МГц и одно-, двухмерного допплеровского и цветного режимов. Для суждения о наличии и выраженности ХСН определеляли уровень NT-концевого предшественника мозгового натрийуретического пропептида (NT-proBNP) в плазме крови иммуноферментным методом реактивом фирмы «Biomedica Gruppe» (Словакия). Принято считать, что пороговое значение NT-proBNP – 125 пг/мл (специфичность – 97%) [7–9]. Кроме того, использовали шкалу оценки клинических симптомов (ШОКС) в модификации В.Ю. Мареева (2000), выполняли тест 6-минутной ходьбы (ТШХ) как в стационаре на фоне стабильного состояния, так и через год наблюдения.
Приверженность 5-компонентной терапии (статины, аспирин+клопидогрел, блокаторы ренин-ангиотензин-альдостероновой системы, β-адреноблокаторы) в течение года оценивали с помощью шкалы-опросника Мориски–Грина.
Протокол исследования был утвержден локальным Этическим комитетом РостГМУ. От каждого участника исследования было получено письменное информированное согласие.
Статистическая обработка данных осуществлена с помощью программ «Microsoft Ехсеl 7.0» и «Statistica for Windows 8.0». В работе определены основные статистические характеристики: среднее (М) и стандартное отклонения (σ), при этом количественные значения представляли в виде М±σ. Качественные переменные описаны абсолютными и относительными величинами (процентами). Достоверность различий средних величин оценена с помощью параметрического критерия Cтьюдента для зависимых и независимых выборок. Достоверность различий между группами оценена с помощью непараметрического критерия Манна–Уитни. При сравнении выраженных в процентах величин использован критерий согласия хи-квадрат (χ²). Для оценки взаимосвязи между показателями вычислены парные коэффициенты корреляции Пирсона. Достоверными считали различия при р<0,05.
Результаты
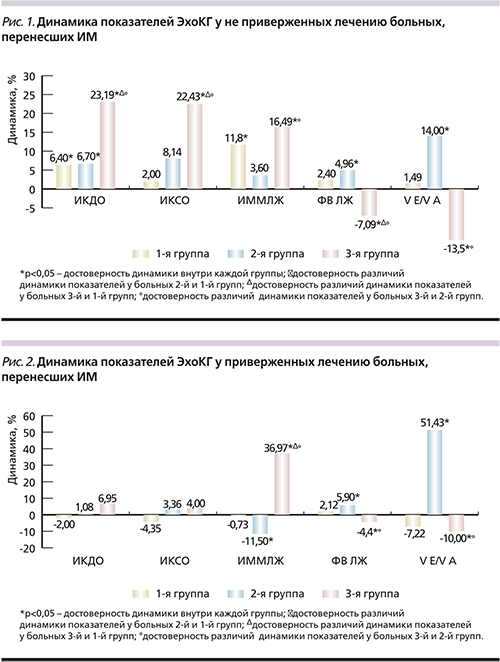
Анализ структурно-функциональ-ных показателей ЛЖ выявил, что у больных 1-й и 2-й групп, не приверженных терапии, было выявлено в динамике увеличение индекса конечно-диастолического объема (ИКДО) ЛЖ на 6,39% (р=0,040) и 6,70% (р=0,041) соответственно, что было достоверным по сравнению с динамикой у приверженных терапии пациентов этих групп (р=0,045; р=0,049) (рис. 1, 2). Следует отметить, что наиболее выраженные отрицательные изменения среди не приверженных терапии пациентов групп сравнения отмечены у больных 3-й группы: увеличение индекса конечно-систолического объема (ИКСО) ЛЖ на 22,43% (р=0,036), ИКДО ЛЖ на 23,19% (р=0,017). Выявленные изменения были статистически значимыми по сравнению с динамикой как у не приверженных регулярному приему препаратов пациентов 1-й (р=0,023; р=0,041) и 2-й (р=0,045; р=0,008) групп, т.е. с выполненной реперфузией в остром периоде ИМ, так и у приверженных лечению больных без реперфузии (р=0,045; р=0,031).
Важно подчеркнуть достоверные положительные изменения, выявленные у регулярно принимавших препараты больных 2-й группы через год после перенесенного ИМ в виде уменьшения индекса массы миокарда (ИММ) ЛЖ на 11,5% (р=0,045), что свидетельствует о регрессе гипертрофии ЛЖ. Выявленные изменения были достоверными по сравнению с динамикой как у не приверженных терапии пациентов с ЧКВ в анамнезе (р=0,005), так и у приверженных лечению пациентов 1-й (р=0,049) и 3-й (р=0,000) групп. Следует подчеркнуть, что у больных 3-й группы, несмотря на приверженность терапии, отмечено увеличение ИММЛЖ на 36,97% (р=0,002), уменьшение индекса относительной толщины стенки (ИОТС) ЛЖ на 14,29% (р=0,001), что, очевидно, способствовало увеличению в 3,99 раза числа пациентов с эксцентрической гипертрофией (ЭГ) ЛЖ (р=0,015) в данной группе. Выявленная отрицательная динамика была достоверной по сравнению с динамикой у приверженных терапии больных 1-й и 2-й групп. У не приверженных лечению пациентов 1-й и 3-й групп, у которых в динамике отмечено достоверное увеличение ИММЛЖ (в 1-й группе на 12,35% [р=0,046], в 3-й – на 16,49% [р=0,040]), что свидетельствует о прогрессировании гипертрофии ЛЖ в отсутствие ежедневного медикаментозного лечения. Следует обратить внимание, что в 3-й группе у не приверженных лечению число больных с ЭГ ЛЖ увеличилось в 5 раз (р=0,007). Выявленные изменения оказались достоверными по сравнению с динамикой показателей у пациентов 1-й (р=0,048) и 2-й (р=0,048) групп, что позволяет судить о выраженном дезадаптивном ремоделировании у больных без реваскуляризации миокарда в анамнезе, особенно у не приверженных терапии в постинфарктном периоде. Вместе с тем даже у не приверженных терапии пациентов 2-й группы достоверной отрицательной динамики данного показателя не наблюдалось.
Принимая во внимание приверженность пациентов лечению, следует отметить, что у регулярно принимавших препараты больных 2-й группы в динамике было отмечено достоверное повышение фракции выброса (ФВ) на 5,91% (р=0,000), что существенно отличалось от динамики у приверженных терапии пациентов 3-й группы (р=0,0004), у которых даже при регулярном приеме препаратов ФВ снизилась на 4,41% (р=0,049).
О положительном влиянии эндоваскулярной реваскуляризации позволяет судить и тот факт, что даже у не приверженных терапии пациентов 2-й группы было выявлено повышение ФВ на 4,96% (р=0,046), VЕ/VА МК – на 14,1% (р=0,001).
В свою очередь в 3-й группе даже у приверженных пациентов было выявлено достоверное снижение VЕ/VА МК на 10% (р=0,025), что значимо отличалось от положительной динамики у приверженных терапии больных, которым ранее выполнили ЧКВ (р=0,001). Ухудшение диастолической функции у пациентов 3-й группы, по-видимому, связано с более выраженным нарушением процесса расслабления и повышением ригидности сердечной мышцы в условии отсутствия реваскуляризации миокарда [2, 3]. Вместе с тем у пациентов, не имевших реперфузии в остром периоде ИМ и не приверженных лечению, через год было выявлено достоверно более выраженное снижение ФВ ЛЖ на 7,09% (р=0,045) и повышение миокардиального стресса на 15,52% (р=0,042) по сравнению с динамикой у не приверженных терапии больных 1-й (р=0,003; р=0,045) и 2-й (р=0,014; р=0,049) групп. Выявленные сдвиги свидетельствуют о прогрессировании ремоделирования ЛЖ у пациентов без реваскуляризации в анамнезе, особенно у не приверженных рекомендованной терапии.
Особый интерес представляют анализ частоты и выраженности симптома СН, оценка толерантности к физической нагрузке.
Анализ полученных данных показал, что у приверженных терапии пациентов средний балл по ШОКС был достоверно меньше (р=0,000; р=0,00; р=0,000), а средняя дистанция ТШХ достоверно больше (р=0,00; р=0,00; р=0,00) по сравнению с таковыми у не приверженных лечению больных во всех наблюдаемых группах.
Важно подчеркнуть, что даже у не приверженных терапии больных 2-й группы оказался самый высокий результат ТШХ по сравнению с показателями у приверженных лечению пациентов 1-й (р=0,000) и 3-й (р=0,00) групп, а также более низкий средний балл по ШОКС по сравнению с показателем у не приверженных лечению пациентов 1-й группы (р=0,000) и приверженных терапии больных 3-й группы (р=0,00). Вместе с тем у не приверженных лечению больных 3-й группы симптомы III ФК ХСН регистрировались достоверно чаще (р=0,003), встречаемость ХСН II Б-стадии была достоверно выше (р=0,013), а также выявлена тенденция к достоверности в меньшей частоте встречаемости ХСН I стадии (р=0,085) по сравнению с показателями у не приверженных терапии пациентов 2-й группы, что позволяет судить о более тяжелом течении ХСН у пациентов, которым реперфузия миокарда не проводилась. На необходимость регулярной медикаментозной терапии указывают результаты, полученные при детальном анализе данных пациентов 3-й группы. Так, у приверженных лечению достоверно реже встречалась ХСН III ФК (р=0,049) и отсутствовала тенденция к достоверности в более частой встречаемости ХСН II ФК (р=0,080) по сравнению с таковой у неприверженных.
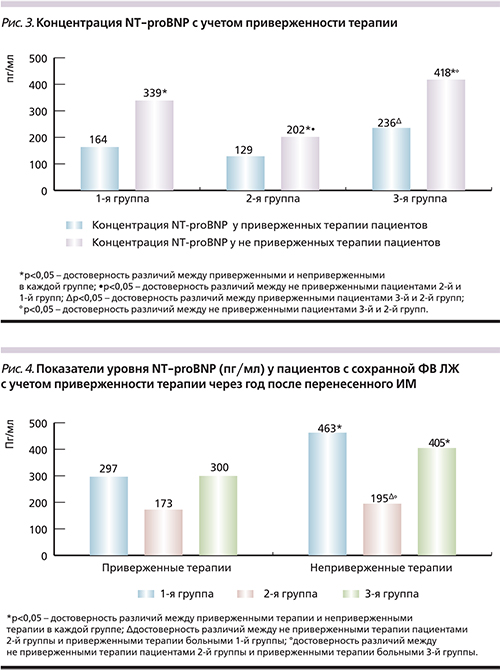
Поскольку симптомы и клинические признаки СН неспецифичны, важное значение для подтверждения ХСН представляет определение уровня NT-proBNP [6, 9]. Важно отметить, что во всех наблюдаемых группах у пациентов, приверженных терапии, регистрировался более низкий уровень NT-proBNP по сравнению с таковым у не приверженных лечению (р=0,011; р=0,015; р=0,047) (рис. 3).
О преимуществе ЧКВ как способа реперфузии в остром периоде ИМ позволяет судить тот факт, что даже у не приверженных терапии пациентов 2-й группы, имевших сохранную ФВ ЛЖ (>50%), среднее значение NT-proBNP (195±40,56 пг/мл) было достоверно ниже по сравнению с таковым у приверженных лечению пациентов и 3-й (300±17,9 пг/мл, р=0,010), и 1-й (297±22,13 пг/мл, р=0,000) групп (рис. 4).
Выводы
Резюмируя, важно отметить, что выполнение ЧКВ в остром периоде ИМ способствовало улучшению клинической картины, повышению переносимости физической нагрузки, положительной динамике показателей ЭхоКГ: регрессу гипертрофии ЛЖ, улучшению показателей систолической и диастолической функции, причем как у приверженных, так и не приверженных терапии.
Проведение ТЛТ в остром периоде ИМ способствовало в дальнейшем предотвращению отрицательной динамики структурно-функциональных показателей ЛЖ и прогрессирования ХСН у больных, приверженных терапии.
У больных без реперфузии миокарда отмечены признаки патологического дезадаптивного ремоделирования ЛЖ, что позволяет судить о более тяжелом течении СН, особенно среди пациентов, не приверженных терапии.



