Введение
Ишемический инсульт (ИИ) является проблемой чрезвычайной медицинской и социальной значимости вследствие высоких показателей частоты его развития, смертности и инвалидизации [1]. Внутривенный (системный) тромболизис с использованием рекомбинантного тканевого активатора плазминогена (rt-PA) – наиболее эффективный медикаментозный метод терапии ИИ в первые 4,5 часа от начала развития симптоматики в соответствии с Российскими национальными клиническими рекомендациями, рекомендациями Европейской инсультной организации (ESO) и Американской Ассоциации сердца и инсультной ассоциации (AHA/ASA) (класс доказательности 1, уровень А) [2–5].
С учетом эффективности тромболитической терапии (ТЛТ) по сравнению с другими методами лечения в острейшем периоде инсульта, а также исходя из фармакоэкономических данных [6, 7] в настоящее время значительные усилия прилагаются в направлении увеличения числа пациентов, которыми может использоваться тот или иной метод реперфузии [8]. Целью настоящего исследования стала оценка эффективности комплекса организационно-методических мероприятий, проводимых в условиях первичного сосудистого отделения на базе ГБУЗ КО «Городская клиническая больница № 2 “Сосновая роща”» Калуги, при внедрении метода системной ТЛТ в отношении пациентов с ИИ.
Материал и методы исследования
В настоящее исследование ретроспективно были включены все пациенты, проходившие стационарное лечение в отделении лечения пациентов с острыми нарушениями мозгового кровообращения (ОНМК) на базе ГБУЗ КО «Городская клиническая больница № 2 “Сосновая роща”» Калуги, которым проводилась системная ТЛТ с 2011 по 2015 г. ТЛП выполнялась при помощи rt-PA в соответствии с международными рекомендациями, методическими рекомендациями НИИ цереброваскулярной патологии и инсульта ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России и Национальными клиническими рекомендациями по проведению ТЛТ: системный тромболизис с использованием rt-PA (Актилизе®) в дозе 0,9 мг/кг массы тела, максимальная доза – 90 мг, 10% в виде болюса внутривенно в течение минуты, оставшаяся доза в течение часа [3–5, 9].
Диагноз ИИ установлен на основании жалоб, данных анамнеза и объективного исследования больных, результатов компьютерной томографии (КТ) при поступлении в клинику. Для объективизации тяжести состояния пациентов и оценки выраженности неврологического дефицита использовали шкалу инсульта Национального института здоровья США (NIH) при поступлении и далее в соответствии с протоколом ТЛТ [10]. Степень функционального восстановления нарушенных неврологических функций у выживших больных при выписке определяли по модифицированной шкале Рэнкина (МШР) [11]. Удовлетворительный функциональный исход соответствовал 0–2 баллам по МШР.
Всем пациентам при поступлении в стационар, а также через сутки после ТЛТ выполняли КТ головного мозга на 64-срезовом компьютерном томографе с определением ранних признаков ишемического повреждения (гиподенсивность размером менее 1/3 бассейна васкуляризации средней мозговой артерии, отсутствие контраста между серым и белым веществом, утрата ребристой структуры островка, сглаженность рисунка борозд и извилин) и в случае развития геморрагической трансформации (ГТ) ее тип в соответствии с критериями ECASS [12].
Всем пациентам проводили ультразвуковые исследования брахиоцефальных артерий и сердца, электрокардиографию, рентгенографию органов грудной полости, лабораторные исследования крови и мочи по стандартным методикам. На основании данных клинической картины, результатов КТ, ультразвуковых методов исследования устанавливали патогенетический вариант инсульта в соответствии с критериями TOAST [13].
В качестве временны́х критериев при проведении ТЛТ анализировались следующие показатели (в минутах): время от начала заболевания до ТЛТ, время от поступления до выполнения лабораторных тестов, время от поступления до выполнения КТ и время от «двери до иглы».
В качестве критериев безопасности оценивались показатель госпитальной летальности, частота развития ГТ очага поражения головного мозга, включая симптомную, которую определяли в соответствии с критериями исследования ECASS как любое кровоизлияние, сопровождавшееся увеличением балла по шкале NIH на ≥4 от исходного уровня или наименьшего уровня в первые 7 дней, либо любое кровоизлияние, закончившееся летальным исходом. Кроме того, кровоизлияние должно было быть идентифицировано как основная причина неврологического ухудшения [14].
Мероприятия организационно-методического характера, активно проведенные в 2014–2015 гг., включали:
- проведение четырех образовательных мероприятий для врачей отделения лечения больных ОНМК (мастер-классы по реперфузионной терапии, использованию шкалы инсульта NIH, в т.ч. в рамках Клинико-образовательного комплекса STROKE);
- проведение образовательных мероприятий со средним и младшим медицинским персоналом с целью повышения мотивации, с обязательным приведением примеров эффективности ТЛТ и подчеркиванием необходимости приоритетной работы с данными пациентами;
- более частое выполнение ТЛТ пациентам с баллом по шкале NIH 5–7, что соответствует протоколу реперфузионной терапии, однако крайне редко проводилось в 2011–2013 гг.;
- постоянный административный контроль за тактикой ведения больных, госпитализированных в периоде терапевтического окна, с разбором каждого случая, когда ТЛТ не выполнялась. При этом каждый пациент, поступивший в первые 4,5 часа от начала инсульта, рассматривался как потенциальный кандидат для проведения ТЛТ.
Статистическую обработку полученных данных проводили с использованием программного обеспечения SPSS 8.0. Категориальные переменные сравнивали с помощью теста χ2 и знакового критерия Уилкоксона, а для непрерывных переменных использовали t-тест или критерий суммы рангов Уилкоксона (Манна–Уитни) в зависимости от нормальности распределения. Значение вероятности <0,05 (двусторонняя проверка значимости) демонстрировало статистическую значимость.
Результаты исследования
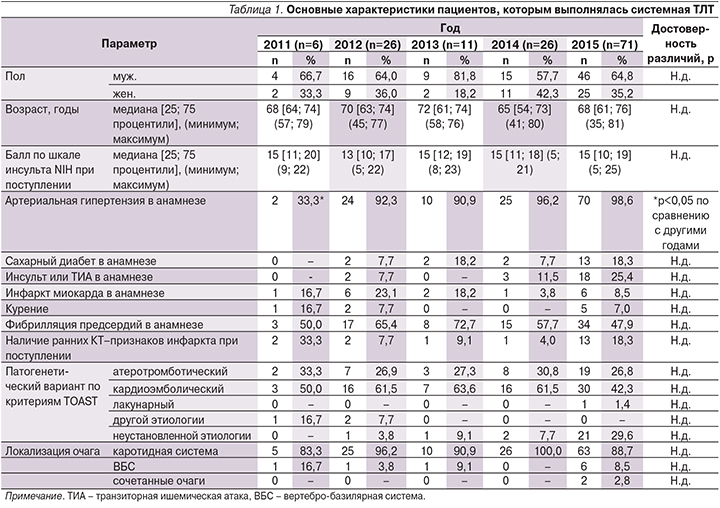
С 2011 по 2015 г. было выполнено 140 процедур системной ТЛТ (Актилизе®), базисные характеристики пациентов представлены в табл. 1. Среди факторов риска инсульта выявлена более низкая частота представленности артериальной гипертензии у больных в 2011 г. (33,3%; p<0,05) по сравнению с пациентами, пролеченными в другие годы, при сравнении других базисных показателей (пол, возраст и т.д.) между группами больных достоверных различий выявлено не было.
Среди пациентов преобладали мужчины (от 57,7% в 2014 г. до 81,8% в 2013 г.) медиана возраста больных колебалась от 65 лет в 2014 г. до 72 в 2013 г. Степень выраженности неврологического дефицита по шкале инсульта NIH также была сопоставимой (12 баллов в 2012 г., в остальные годы – 15 баллов). Существенно преобладали пациенты с каротидной локализацией очага поражения (от 83,3 до 100%) и кардиоэмболическим патогенетическим вариантом инсульта (от 42,3 до 63,6%). Несмотря на отсутствие достоверных различий между группами больных по возрасту, отмечалось расширение возрастного диапазона в 2014 и 2015 гг. по сравнению с предшествовавшим периодом (минимальные и максимальные значения составили 41 год и 80 лет в 2014 г. и 35 лет и 81 год в 2015 г. соответственно).
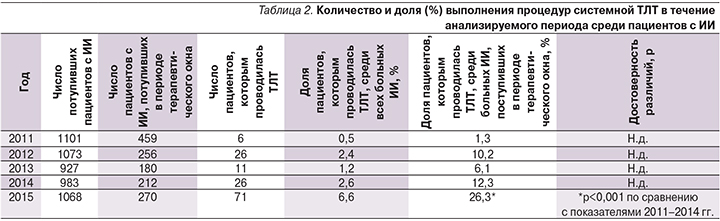
Сравнительный анализ частоты выполнения ТЛТ среди пациентов, госпитализированных в стационар в периоде терапевтического окна, выявил значительное увеличение доли лиц, которым проводилась ТЛТ, в 2015 г. (26,3%; р<0,001) по сравнению с показателями в другие годы (табл. 2). При этом максимальное число пациентов, поступивших в первые часы от начала инсульта, отмечено в 2011 г. (459 человек), однако доля лиц, получавших ТЛТ, составила всего 1,3%.
В последующем удельный вес выполненных процедур ТЛТ колебался от 6,1% в 2013 г. до 12,3% в 2014 г., достигнув максимального показателя в 2015 г. Доля больных, которым проводилась ТЛТ, среди всех пациентов с ИИ в 2015 г. составила 6,6%.
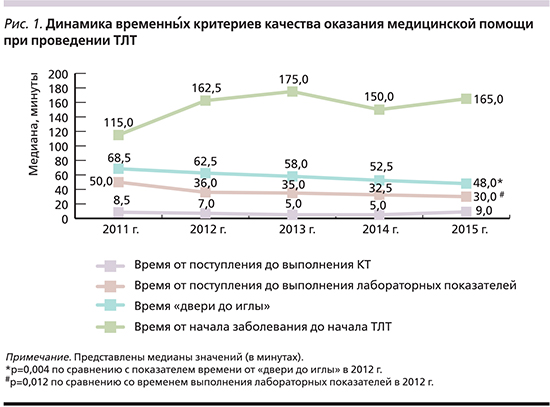
При анализе временны́х критериев качества оказания помощи при проведении системного тромболизиса выявлено значительное уменьшение (на 20,5 минут) времени «от двери до иглы» в течение анализируемого периода (с 68,5 минут в 2011 г. до 48 – в 2015-м), при этом различия между 2012 и 2015 гг. носили достоверно значимые различия (р=0,004, рис. 1).
Показатель времени от поступления до выполнения лабораторных анализов, предписанных протоколом ТЛТ, также имел тенденцию к снижению в течение всего анализируемого периода, достигнув значимых различий при сравнении данных 2012 и 2015 гг. (р=0,012). Данные о времени выполнения КТ-исследований существенно не различались и колебались в диапазоне от 5 до 9 минут. Выявлена тенденция к увеличению времени от начала заболевания до выполнения ТЛТ (без достоверных различий), свидетельствующая о более поздней обращаемости за медицинской помощью.
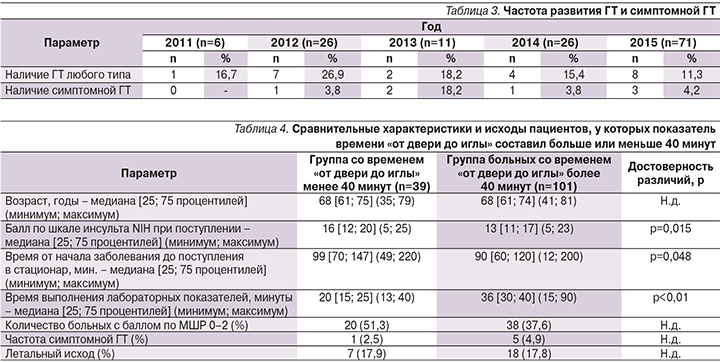
Показатель частоты ГТ очага поражения головного мозга (как симптомной, так и асимптомной; табл. 3) варьировался от 11,3% в 2015 г. до 26,9% в 2012 г. (без достоверных различий), при этом частота симптомной ГТ в 2012 г. составила 3,8%, в 2013 г. – 18,2%, в 2014 г. – 3,8%, в 2015 г. – 4,2%, также без достоверных различий между годами. В целом в течение всего анализируемого периода частота симптомной ГТ составила 4,3% (6 пациентов) и в 4 случаях была причиной летального исхода (у 2 больных в 2013 г. и у 2 – в 2015 г.).
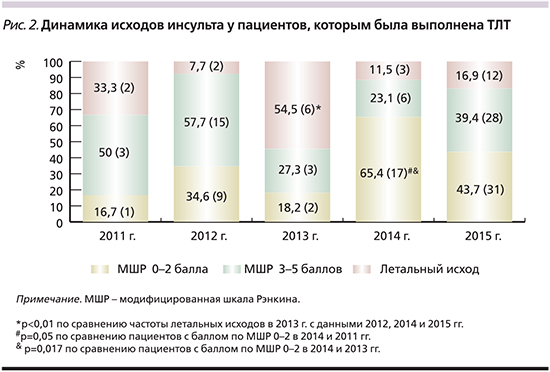
Анализ частоты летальных исходов выявил значительное преобладание умерших пациентов в 2013 г. (6 человек, 54,5%, р<0,01 по сравнению с данными 2012, 2014 и 2015 гг.; рис. 2).
Причиной летального исхода у 2 больных послужила симптомная ГТ, в 4 случаях смерть наступила при явлениях нарастающего отека головного мозга у пациентов с обширными ишемическими очагами. В течение всего анализируемого периода летальность среди пациентов с ИИ, которым проводилась ТЛТ, составила 17,9% (умерли 25 больных).
Выявлена тенденция к увеличению числа пациентов с удовлетворительным функциональным восстановлением нарушенных неврологических функций (от 0 до 2 баллов по МШР) в течение 2011–2015 гг. (с максимальным уровнем в 2014 г. – 65,4%; р=0,05 по сравнению с данными 2011 г. и р=0,017 по сравнению с данными 2013 г.). В 2015 г., когда было выполнено наибольшее количество процедур ТЛТ, данный показатель составил 43,7% (31 пациент).
При анализе (табл. 4) групп пациентов с показателем времени «от двери до иглы» менее (39 человек; 27,9%) или более 40 минут (101 больной; 72,1%) было выявлено, что, несмотря на более выраженную неврологическую симптоматику при поступлении (медиана балла по NIH 16 против 13; р=0,015) и более высокий показатель времени от начала заболевания до поступления в стационар (медиана времени 99 против 90 минут; р=0,048), для группы пациентов, ТЛТ которым была начата в течение 40 минут от поступления в стационар, был характерным более низкий показатель времени от двери до выполнения лабораторных показателей (медиана времени – 20 против 36 минут; р<0,01). Также, несмотря на более высокий исходный балл по шкале NIH при поступлении больных со временем «от двери до иглы» менее 40 минут, отмечались тенденции к более частому удовлетворительному восстановлению неврологических функций (на 13,7%) и меньшей частоте развития симптомной ГТ (на 2,4%) по сравнению с пациентами, выполнение ТЛТ которым было начато позднее 40 минут от момента поступления.
Обсуждение
Таким образом, проведенное исследование показало значимость комплекса организационно-методических мероприятий при внедрении метода ТЛТ в клиническую практику. В течение 5-летнего периода работы отделения для лечения больных ОНМК количество процедур системного тромболизиса увеличилось с 6 в 2011 г. до 71 в 2015 г. Доля больных, которым проводился тромболизис в 2015 г., составила 26,3% среди всех пациентов с ИИ, госпитализированных в период терапевтического окна, и 6,6% среди всех больных ИИ, превысив значение минимального целевого показателя (5%), установленного Министерством здравоохранения Российской Федерации. При этом абсолютное число больных, поступивших в стационар, было максимальным в 2011 г. (459 человек) и в последующие годы довольно значительно уменьшилось (табл. 2). По нашим данным, результаты настоящего исследования – первые, опубликованные в Российской Федерации, в отношении максимального числа пациентов, которым выполнялась ТЛТ в условиях одной медицинской организации, а также доли таковых среди всех больных ИИ. Согласно проведенным ранее исследованиям [15], частота ТЛТ до 2015 г. в России не превышала 2% среди больных ИИ, тогда как в ряде стран данный показатель может достигать 5–10% [16, 17].
С позиций безопасности наиболее значимым вопросом при проведении ТЛТ является частота развития симптомной ГТ. В ряде рандомизированных исследований этот показатель варьировался от 2,4 до 6,4% [12, 14, 18–20], а в ранее опубликованных данных в РФ – от 4 до 6,2% [21–23], составив в нашем исследовании 4,3%. Следует отметить, что увеличение количества процедур ТЛТ в течение анализируемого периода времени не сопровождалось увеличением частоты развития указанного осложнения, что свидетельствует о правильном исключении больных с противопоказаниями к ТЛТ и соблюдении протокола по ее проведению.
В соответствии с зарубежными рекомендациями [5] показатель времени «от двери до иглы» не должен превышать 60 минут (в идеале – чем меньше, тем лучше). В настоящем исследовании было показано, что по мере внедрения метода реперфузии и реализации организационных мероприятий отмечалось существенное уменьшение времени «от двери до иглы» (с 68,5 до 48 минут). При сравнении групп больных с данным показателем менее или более 40 минут было выявлено, что при меньшем показателе «от двери до иглы» увеличивалось число больных с удовлетворительным функциональным восстановлением и уменьшалась частота симптомной ГТ, несмотря на более выраженную неврологическую симптоматику при поступлении в стационар. Таким образом, уменьшение возможных задержек при поступлении в стационар (внутрибольничная маршрутизация, время от поступления до выполнения диагностических исследований, скорость работы бригады специалистов) является чрезвычайно значимым фактором, влияющим на исход заболевания у пациентов с ИИ.
Уровень летальности среди больных, которым была проведена ТЛТ (17,9%), соответствовал таковому в ранее проведенном российском исследовании (18,2%) и был несколько выше, чем в исследовании ECASS III и регистре SITS-MOST (11,3 и 7,7% соответственно) [14, 22, 24]. Возможно, указанное различие можно объяснить исходно более тяжелым неврологическим дефицитом у больных в нашем исследовании, что не могло не отразиться на уровне летальности (15 баллов по шкале инсульта NIH по сравнению с 10,7 балла в исследовании ECASS III и 12 баллам в SITS-MOST). Косвенным образом это подтверждается сходными с нашими данными результатов исследования NINDS, в котором уровень летальности через 3 месяца был зарегистрирован на уровне 17%, а суммарный балл по шкале NIH при поступлении составил 14 [18].
Таким образом, результаты настоящего исследования подтвердили значимость внедрения комплекса организационно-методических мероприятий в увеличении количества процедур ТЛТ в условиях первичного сосудистого центра, что способствовало улучшению качества оказания медицинской помощи больным ИИ и увеличению числа пациентов с хорошим функциональным восстановлением нарушенных неврологических функций.



