Вступление
Меланома – злокачественная опухоль нейроэктодермального происхождения, развивающаяся из меланоцитов, расположенных преимущественно в коже. Именно поэтому меланома кожи (МК) является одним из наиболее распространенных злокачественных новообразований и в настоящее время представляет реальную угрозу для значительного числа людей. Заболеваемость МК составляет у мужчин 9,5 на 100 тыс. населения, у женщин – 8,6, смертность – 1,8 и 1,1 на 100 тыс. населения соответственно [1].
Самая высокая заболеваемость МК зарегистрирована в США, где она составляет 50 на 100 тыс. белого населения и где ежегодно умирают 7800 человек, а также в Австралии, где заболеваемость выросла в 2 раза и составляет 50 на 100 тыс. для мужчин и 35 на 100 тыс. для женщин. Аналогичные тенденции роста заболеваемости МК отмечены в странах Европы, где в целом она остается в пределах 5–20 на 100 тыс. населения, при этом наибольшая заболеваемость отмечается в развитых странах Северной Европы [2].
Современные эпидемиологические исследования установили стремительный рост заболеваемости МК в разных странах, в т.ч. и в России. Мировой кумулятивный рост МК среди мужчин – 1,0 на 100 тыс. населения, среди женщин – 0,9 [1]. Заболеваемость МК в Российской Федерации в 2013 г. составила 6,25 на 100 тыс. населения, при этом удельный вес больных с запущенным опухолевым процессом III–IV стадий достигает 23,8%, летальность до года составляет 12,3% [3].

Одним из основных пусковых механизмов, лежащих в основе роста заболеваемости МК в мире, считается увеличение суммарного времени воздействия ультрафиолетовой части спектра естественного солнечного света на кожу человека [2, 4]. К группе риска относят лиц со светлой кожей, проживающих в южных странах и районах, а также проводящих много времени на открытом воздухе, что присуще Крымскому региону. В Крыму также отмечается тенденция к росту заболеваемости МК; так, в 2006 г. заболеваемость составила 6,1 на 100 тыс. населения, а в 2013 г. – 9,1 на 100 тыс. населения [5].
МК различной локализации, несмотря на общую клиническую картину, общую высокую склонность к метастазированию, имеет ряд различий [6–8], что требует рассматривать данное новообразование в зависимости от ее локализации. Отличиями МК туловища является то, что опухоль располагается не на открытых участках кожи и имеет множество путей лимфогенного метастазирования в различные коллекторы – это влияет на выбор объема операции и, соответственно, на результаты лечения [9, 10].
Цель исследования – изучить особенности течения МК туловища при различных локализациях и отдаленные результаты в зависимости от объема хирургического вмешательства.

Материал и методы
Материалы исследования базируются на результатах лечения 304 больных МК туловища, прошедших хирургическое лечение в Крымском республиканском онкологическом клиническом диспансере им. В.М. Ефетова в период с 1982 по 2004 г. Из исследования исключались больные, к которым применялись любые методы профилактического воздействия на опухоль (химио-, иммунотерапия), и пациенты, имевшие в анамнезе другие злокачественные новообразования. В ходе стратификации патоморфологических данных учитывались такие параметры первичной опухоли, как уровень инвазии по Кларку, гистологическая структура и форма роста опухоли.
В зависимости от локализации опухоли пациенты были разделены на следующие группы: у 93 больных (30,6±2,6%) меланома располагалась на коже спины, у 50 (16,4±2,1%) – на передней грудной стенке, у 130 (42,8±2,8%) – в пояснично-крестцовой области, у 31 (10,2±1,7 %) – на передней брюшной стенке.
Объем радикального хирургического лечения пациентов исследуемой группы заключался в широкой электроэкс-цизии кожно-фасциального лоскута с опухолью. Пластика дефекта тканей выполнялась по А.А. Лимбергу. При наличии метастазов в регионарных лимфоузлах выполнялась лимфаденэктомия (ЛАЭ). В 134 (44,1±2,8%) случаях проводилась только электроэксцизия кожно-фасциального лоскута с опухолью. 99 (32,6±2,7%) больным вместе с удалением первичной опухоли была выполнена синхронная ЛАЭ.
В 71 (23,3±2,4%) случае была выполнена отсроченная метахронная ЛАЭ, сроки которой колебались от 1 месяца до 14 лет.
Статистический анализ проводился с помощью программ статистических расчетов Microsoft Excel 2007, Statistica for Windows v. 6.0. Исследование непосредственных результатов лечения проводилось на основании использования U-критерия Mann-Whitney, χ2 с поправкой Йетса на непрерывность («Yates corrected Chi-square»), точного критерия Fisher, two-tailed. В качестве меры центральной тенденции для оценки продолжительности жизни после операции в исследованных выборках использовались средняя продолжительность, медиана и квартили (25 и 75 процентили). Основным статистическим методом исследования стал анализ выживаемости. Функция выживания оценивалась с помощью метода Каплана–Мейера. При попарном сравнении выборок был использован критерий Log-Rank Test. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий) принимали равным 0,05. Статистически значимым для всех показателей считался критерий достоверности p<0,05.
Результаты и обсуждение
Меланома кожи туловища встречалась у женщин чаще (55,6±2,8%; n=169), чем у мужчин (44,4±2,8%; n=135; р=0,43) (табл. 1).
Установлено, что МК туловища чаще встречается в возрастном промежутке от 41 до 60 лет, составляя 42,1±2,8% (n=128) случаев (женщины 53,9%, n=69; мужчины 46,1%, n=59). Среди больных в возрасте от 14 до 40 лет также преобладали женщины – 57 (62,0±5,1%) случаев, мужчины соответственно 35 (38,0±5,1%) (р>0,05). Средний возраст заболевших составил 49,9±16,2 (14–96) года: в женской популяции – 49,3±16,0 лет, в мужской – 50,7±16,4 года. Статистически значимых различий показателя среднего возраста в зависимости от локализации опухоли и пола не выявлено.
В ходе стратификации данных патоморфологического исследования установлено, что большая часть пациентов (254 – 83,6±2,1%; p<0,05) имели глубокий (III–IV–V) уровень инвазии по Сlark, меланома in situ, I и II уровни инвазии встречались только у 50 (16,4±2,1%) пациентов (табл. 2).
Чаще всего диагностирована эпителиоидноклеточная МК туловища – 58,6±3,7% случаев (р>0,05), реже – невоклеточная (16,7±2,8%) и веретеноклеточная (10,9±2,4%) МК.
В зависимости от локализации МК туловища III–IV–V уровни инвазии наблюдали у 88,2±3,3% на области спины, у 87,1±6,0% на передней брюшной стенке, у 82,0±5,4% на передней грудной стенке и у 80,0±3,5% в пояснично-крестцовой области. Статистически значимых отличий показателя глубины инвазии опухоли от локализации и пола не выявлено.
В ходе анализа отдаленных результатов хирургического лечения пациентов общей выборки МК туловища установлено, что средняя продолжительность жизни составила 8,6±8,1 года, медиана выживаемости – 5,0 лет. Статистически значимых различий в средней продолжительности жизни в зависимости от локализации МК туловища выявлено не было (табл. 3).
Ход кривых выживаемости в группах пациентов с МК туловища практически совпадал (рис. 1).
Рассмотрена выживаемость больных МК туловища по временным шкалам (1, 3, 5 и 10 лет) с учетом локализаций. Оценивая отдаленные результаты хирургического лечения МК туловища общей когорты пациентов (n=304), следует отметить, что в течение первого года умерли 11,3% больных, трехлетняя выживаемость составила 64,4±2,8%, пятилетняя – 53,8±2,9%, десятилетняя – 41,0±2,9%.

При попарном сравнении функции выживаемости у пациентов исследуемых групп в зависимости от локализации опухоли статистически значимых различий выявлено не было (табл. 4).
В 170 (55,9±2,8%) случаях стадия и характер лимфогенного распространения заболевания требовали произведения ЛАЭ. Произведено 117 подмышечных, 19 подвздошно-паховых и 4 фасциально-футлярных ЛАЭ на шее, включая операции Крайля. Учитывая поражение двух коллекторов лимфогенного метастазирования 20 (17,6%) больным произведены билатеральные ЛАЭ: подмышечные с обеих сторон в 15 случаях, паховые с обеих сторон в 3 случаях, подмышечные и шейные в 8 случаях, подмышечные и паховые в 4 случаях. Диагностика лимфогенных метастазов осуществлялась с помощью физикального и ультразвукового методов исследования. Гистологическая верификация лимфогенных метастазов установлена у 118 (69,4±3,5%) из 170 больных, которым выполнены ЛАЭ, при этом у 56 (56,6±4,9%) больных после синхронной и у 62 (87,3±3,9%) (р>0,001) после метахронной ЛАЭ.
Регионарное лимфогенное метастазирование в отдаленные сроки наблюдений после удаления первичного опухолевого очага было верифицировано при метахронной ЛАЭ у 55 больных через один год после операции, у 5 больных – через два, у 2 больных – через три, у 5 больных – через четыре года. По одному случаю регионарного лимфогенного метастазирования установлено спустя 5, 6, 10 и даже 14 лет.
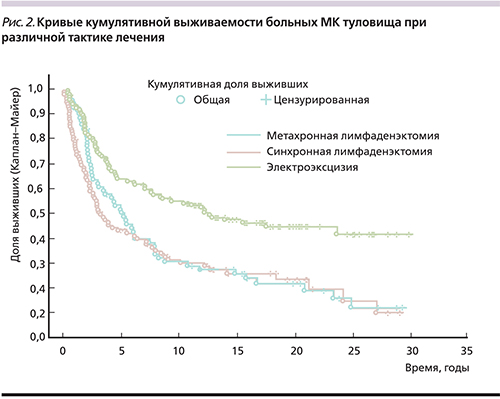
Таким образом, в 38,8±2,8% (118 больных) случаев при МК туловища регионарные лимфогенные метастазы были диагностированы либо синхронно 56,6±5,0% (56 больных), либо метахронно 87,3±3,9% (62 больных). Средняя продолжительность жизни отличалась в зависимости от тактики хирургического лечения (табл. 5, рис. 2).
Наиболее высокая средняя продолжительность жизни установлена у тех пациентов, у которых не было метастазирования в регионарные лимфоузлы, перенесших только электроэксцизию кожно-фасциального лоскута. Наиболее неблагоприятные отдаленные результаты отмечены при наличии МК туловища с одновременным метастазированием в регионарные лимфатические коллекторы, что потребовало синхронного удаления первичного опухолевого очага с ЛАЭ (р=0,00005). Появление метастазов меланомы в лимфоузлах в отдаленные периоды жизни после удаления первичного опухолевого очага занимает промежуточное положение неблагоприятного течения (р=0,00072).
Ход кривых кумулятивной выживаемости между группами пациентов с синхронной и метахронной ЛАЭ практически совпадает (рис. 2). Средняя продолжительность жизни пациентов после метахронной ЛАЭ выше, чем у пациентов после синхронной ЛАЭ, однако эти показатели статистически недостоверны (р=0,502). Поэтому была изучена выживаемость больных МК туловища по временным шкалам с учетом тактики лечения (табл. 6).
Установлено, что выживаемость пациентов с синхронным хирургическим лечением первичного опухолевого очага и вмешательством на регионарном лимфатическом аппарате статистически значимо ниже, чем у больных, у которых лимфогенное метастазирование отмечено в более поздние сроки.
В сравниваемых группах 5-летняя выживаемость достоверно не отличалась, но была выше в группе после метахронной ЛАЭ (50,0±6,0% против 41,8±5,0%).
Тактика наблюдения больных после удаления первичной опухоли и выполнения лимфодиссекции только при появлении клинических признаков метастатического поражения лимфоузлов не ухудшает показатели выживаемости.
Выводы
МК туловища чаще болеют женщины молодой и средней возрастных групп. Более чем у одной трети больных имеют место метастазы в регионарные лимфатические узлы. Различные локализации МК туловища существенно не влияют на особенности течения, характер метастазирования и глубину инвазии опухоли. Несмотря на то что только у 56,6% больных при синхронном удалении меланомы с регионарной ЛАЭ были верифицированы метастазы в лимфоузлах, именно в данной группе были получены наиболее неблагоприятные отдаленные результаты, соответственно, необходим комплекс мер, направленных на выявление меланомы на ранней стадии развития, а метастазирование в регионарные лимфоузлы следует считать фактором неблагоприятного течения, достоверно сокращающим продолжительность жизни и выживаемость больных.



