Несмотря на значительные успехи фундаментальной медицины, до настоящего времени четко не определены этиопатогенетические факторы, ответственные за развитие и формирование персистенции воспалительного процесса при язвенном колите (ЯК). Последние годы вектор научных исследований направлен на изучение изменений иммунологической реактивности при воспалительных заболеваниях кишечника (ВЗК).
По мнению большинства исследователей, ведущая роль в иммунопатогенезе ВЗК принадлежит молекулам адгезии (МА) [1–3], которые запускают сложную энергозависимую миграцию лейкоцитов из кровотока в зону тканевого поражения, т.н. хоминг лейкоцитов [4].
Хоминг, в результате которого лейкоциты пересекают эндотелиальный барьер, это многоэтапный процесс, начинающийся с захвата и роллинга лейкоцитов на стенке кровеносного сосуда с последующей прочной адгезией к эндотелиальным клеткам и миграцией в очаг воспаления [5] (рис. 1). Установлено, что повышение адгезии имеет большое значение в патогенезе дисфункции эндотелия и коррелирует с активностью воспаления [6].
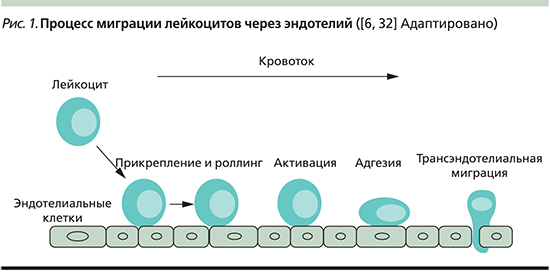
По данным литературы, увеличение в сыворотке крови уровня МА и нарушение рекрутинга лейкоцитов регистрируются при широком круге иммуноопосредованных хронических воспалительных, инфекционных и аллергических заболеваний, например при ревматоидном артрите, псориазе, рассеянном склерозе, ВЗК [7]. Вместе с тем, несмотря на массу публикаций, освещающих вопросы патофизиологии и иммунопатогенеза ВЗК, имеющиеся результаты, полученные в ex vivo- и in vitro-исследованиях, отражающие роль МА, особенно суперсемейства иммуноглобулинов, в развитии воспаления при ЯК малочисленны и нередко противоречивы.
Выделяют несколько классов МА, которые имеют принципиально общую схему строения и служат мембранными белками: селектины (P, L, E), интегрины, молекулы суперсемейства иммуноглобулинов (IgSF), у млекопитающих выделена дополнительная группа, представленная кадгеринами [8].
Суперсемейство иммуноглобулинов составляют VCAM (CD106;vascular cell adhesion molecule), ICAM (intercellular adhesion molecules), содержащую ICAM-1 (CD54), ICAM-2 (CD102), ICAM-3 (CD50), ICAM-4 (вещество эритроцитов Ландштейнера–Винера), ICAM-5 (телеэнцефалин), а также PECAM (platelet-endothelial cell adhesion molecule) [9].
Установлено, что ICAM-1 – высокогликозилированный трансмембранный белок, постоянно экспрессирующийся в небольших количествах на негемопоэтических клетках, таких как клетки сосудистого эндотелия, эпителия вилочковой железы, кератиноциты и фибробласты, а также на гемопоэтических клетках – моноцитах, некоторых субпопуляциях T- и B-клеток [10]. Известно, что ICAM-1 активируется под воздействием провоспалительных сигналов фактора некроза опухолей α (ФНО-α), интерлейкина-1β и интерферона-γ. Уровень синтеза ICAM-1 и ICAM-2 на моноцитах сопоставим, но в отличие от ICAM-1 экспрессия ICAM-2 не подвергается дополнительному влиянию воспалительных цитокинов [11].
Интегрины представляют трансмембранные гетеродимерные МА, образованные двумя нековалентно связанными субъединицами: α (120–170 кДа) и β (90–100 кДа). У позвоночных описаны 18 α- и 8 β-субъединиц, которые комбинируются для генерации по меньшей мере 24 различных вариантов интегринов, 14 из которых присутствуют в клетках иммунной системы [12]. Столь значительное количество возможных комбинаций обеспечивает широкое функциональное разнообразие этих молекул [3]. При этом специфичность интегрина определяет β-субъединица. Именно поэтому β2 (CD18), α4 и β7 семейства интегринов играют наиболее важную роль в индукции воспалительных состояний [13]. β1-интегрины взаимодействуют с компонентами межклеточного матрикса и мембранным рецептором VCAM-1 (СD106), который экспрессируется активированными клетками эндотелия [8]. β2-интегрины представлены на лейкоцитах, и их экспрессия широко варьируется среди лейкоцитарных субпопуляций [13]. В качестве рецепторов для β2-интегринов, способных конкурентно тормозить процессы межклеточных взаимодействий, выступают мембранные молекулы, образующие группу ICAM [8].
Интегрины могут существовать в клетке в нескольких формах: активной, неактивной и промежуточной. Активированные интегрины участвуют в опосредовании клеточной адгезии. При этом прочность клеточной адгезии, связанной с интегрином, определяется как авидность последнего [14]. В свою очередь авидность определяет прочность индивидуальной связи между одним интегрином и его лигандом и регулируется конфигурацией субъединиц интегрина, тогда как валентность интегрина опосредуется кластеризацией его рецепторов на клеточной поверхности. В отсутствие активирующих сигналов интегрины имеют неактивную изогнутую конфигурацию [15]. После активации интегрины подвергаются значительным конфигурационным изменениям, что приводит к экспонированию их лиганд-связывающего сайта во внеклеточных доменах [16]. Другой особенностью процесса активации интегрина является необходимость присутствия двухвалентных катионов, особенно ионов марганца (Mn2+) и магния (Mg2+), контролирующих конфигурационные изменения его молекул [15]. Обычно интегрины экспрессируются на поверхности клетки в неактивном состоянии. Это важное условие, т.к. именно оно обеспечивает свободную циркуляцию лейкоцитов и тромбоцитов в крови с минимальным взаимодействием и агрегацией к эндотелию сосудов. Связывание с рецепторами агонистов, таких как хемокины или цитокины, вызывает «inside-out»-сигналы, которые переводят интегрин в активное состояние [2].
α4β7-интегрин играет важную роль в миграции Т-лимфоцитов в слизистую оболочку (СО) кишки за счет способности распознавать гликозилированный адрессин MAdCAM-1, избирательно экспрессирующийся посткапиллярными венулами пейеровых бляшек и являющийся ключевым лигандом с наиболее высокой специфичностью и сродством к указанному интегрину [8]. В результате этого взаимодействия происходит прочная адгезия циркулирующих α4β7+ клеток с их последующей миграцией в СО. Установлено, что при ВЗК этот процесс усилен и приводит к увеличению миграции активированных Т-лимфоцитов в кишечную стенку и к воспалению [14].
Именно MAdCAM-1, опосредуя синергичное взаимодействие L-селектина и α4β7-интегрина, служит ключевым звеном в хоминге лимфоцитов в воспаленную СО кишки [17, 18]. Обращает на себя внимание тот факт, что в период обострения ВЗК экспрессия MAdCAM-1 регистрируется за пределами кишки: в суставах, глазах, коже, печени [19]. Возможно, аномальная экспрессия MAdCAM-1 в этих тканях способствует привлечению патогенных клеток, манифестации воспаления и, как следствие, формированию внекишечных проявлений [18].
Ряд проведенных экспериментальных исследований внес свой вклад в понимание роли МА при ЯК и БК.
По мнению B.R. Yacyshyn et al. (1994), экспрессия ICAM-1 при ЯК и БК отличается ввиду различий в патофизиологии этих заболеваний [20].
В то же время, как установлено B. Vainer et al. (2000), экспрессия ICAM-1 имеет прямую корреляцию с эндоскопической активностью ЯК [21].
F. Magro et al. (2004) определили уровни sE-, sP-селектина, sVCAM-1, sICAM-1, фактора роста эндотелия сосудов (VEGF), ангиогенина (ANG) и плацентарного фактора роста (PIGF) у 218 пациентов с ВЗК (73 с ЯК, 145 с БК) в разные периоды заболевания и в группе 115 здоровых добровольцев [22]. Установлено, что у пациентов с рецидивом БК значения sE-селектина выше, чем в группе сравнения, а формирование клинической ремиссии БК сопровождается снижением уровней sP-, sE-селектина, sVCAM и sICAM. В группе с ЯК вне зависимости от воспалительной активности уровни sP-селектина и sVCAM были значительно ниже, чем у здоровых добровольцев. Кроме того, с началом клинической ремиссии БК содержание ANG и VEGF снизилось. У пациентов с ЯК сывороточные показатели VEGF, ANG и PIGF не отличались от таковых у здоровых добровольцев. Авторы делают вывод: низкие уровни МА и ангиогенных факторов у пациентов с БК и ЯК, находящихся в ремиссии, свидетельствуют о нарушении ангиогенных и репаративных процессов [22].
M. Apostolaki et al. (2008), G. Gorfu et al. (2010) в экспериментальных условиях продемонстрировали, что развитие острого колита у мышей непосредственно зависит от рекрутинга Т-лимфоцитов, опосредованного β7-интегринами. Кроме того, доказано, что дефицит β7-интегрина полностью блокировал развитие колита in vivo [23, 24]. К сожалению, использование экспериментальных моделей на животных не позволяет однозначно экстраполировать полученные результаты и судить о ведущей роли α4β7- и/или αEβ7-интегринов в хоминге T-лимфоцитов в СО тонкой кишки в процессе воспаления, что обусловливает необходимость дальнейшего изучения компонентов врожденного иммунитета при ВЗК.
I. Adamska et al. (2009) исследовали содержание slCAM-1, sVCAM-1 и sPECAM-1 в сыворотке крови детей с ЯК и БК и пришли к выводу, что концентрация МА не коррелирует с воспалительной активностью заболевания [16].
От представленных выше отличаются результаты, полученные В.В. Павленко и соавт. (2012), которые оценивали клинико-диагностическое значение растворимых изоформ клеточных МА (ICAM-1, ICAM-2 и L-селектин) в динамике лечения препаратами базисной терапии 84 больных ЯК [26]. Авторами отмечена прямая корреляция между сывороточными уровнями ICAM-1, ICAM-2, L-селектина и активностью ЯК. Так, максимальные концентрации МА зарегистрированы при высокой активности заболевания. Интересным представляется следующее: при формировании клинической ремиссии ЯК показатели изучаемых факторов адгезии снижались, однако не достигали референсных значений, что, очевидно, свидетельствует о сохраняющейся активации иммунокомпетентных клеток. Авторы предполагают, что определение некоторых МА может иметь существенное клиническое значение, т.к. в период обострения ЯК вне зависимости от локализации воспалительно-деструктивных изменений в СО толстой кишки, характера течения заболевания и клинических проявлений регистрируется повышение сывороточных уровней ICAM-1, ICAM-2 и L-селектина.
Сопоставимые результаты получены В.И. Ашкинази и соавт. (2013), которые изучали взаимосвязь sP-селектина и sPECAM-1 с ФНО-α свободными радикалами и неоптерином в педиатрической популяции больных ЯК [9]. Эти данные впоследствии получили подтверждение в более масштабном исследовании, проведенном В.И. Ашкинази и соавт. (2015), в которое были включены 194 ребенка с ВЗК (87 с БК, 107 с ЯК). Помимо sP-селектина sPECAM-1, изучался цитокиновый статус, определялись уровни неоптерина, эластазы полиморфнонуклеарных лейкоцитов, проводилось морфометрическое исследование биоптатов СО кишки, а также оценивался кислородзависимый метаболизм нейтрофилов. Авторы отметили повышение содержания sP-селектина и sPECAM-1 у пациентов с ВЗК по сравнению с группой контроля. Кроме того, была установлена корреляция между содержанием МА и усилением респираторного метаболизма, эндоскопической активностью и маркерами воспаления. На основании полученных данных высказывается предположение, что увеличение уровней МА sP-селектина и sPECAM-1 вносит свой вклад в патогенез ВЗК [9].
Влияние базисной и биологической терапии на изменение концентрации МА изучалось в исследовании Л.Б. Лазебника и соавт. (2013). У 9 пациентов с БК, получавших инфликсимаб в дозе 5 мг/кг, определяли концентрацию L-, P-, E-селектина и интегрина sVCAM-1 перед началом терапии и через 2 месяца после завершения курсового лечения. Было установлено, что у всех пациентов имело место достоверное снижение уровня факторов адгезии, в то время как в группе, получавших азатиоприн (2 мг/1 кг массы тела) и глюкокортикостероиды (1 мг/кг массы тела) сохранялись клинические и лабораторные признаки активности ВЗК и высокие уровни МА. По мнению авторов L-, P- и E-селектин, а также sVCAM-1 могут использоваться в качестве прогностических критериев для оценки течения ВЗК и ответа на их терапию [26].
Аналогичное исследование представлено В.В. Павленко и соавт. (2015), изучавшими некоторые показатели апоптоза, содержание МА и ФНО-α у больных с тяжелым течением и высокой степенью клинической активности ЯК в динамике индукционного курса инфликсимабом [27]. Полученные результаты позволили авторам прийти к заключению: высокоселективная блокада провоспалительных цитокинов и МА может рассматриваться как перспективная альтернатива возможностям базисного лечения, а также определять необходимость пролонгирования биологической терапии.
Данные о роли различных классов МА, полученные в ходе доклинических испытаний на животных и клинических исследований пациентов с ВЗК, послужили предпосылкой к активному поиску перспективных терапевтических мишеней для антиинтегриновой терапии [1, 28].
Антиинтегриновые препараты – это моноклональные антитела, которые внеклеточно воздействуют на лиганд-связывающий участок в гетеродимерных рецепторах адгезии (рис. 2). На сегодняшний день, несмотря на массу проводимых клинических исследований, основные механизмы действия антиадгезивных средств остаются не до конца понятыми [29].
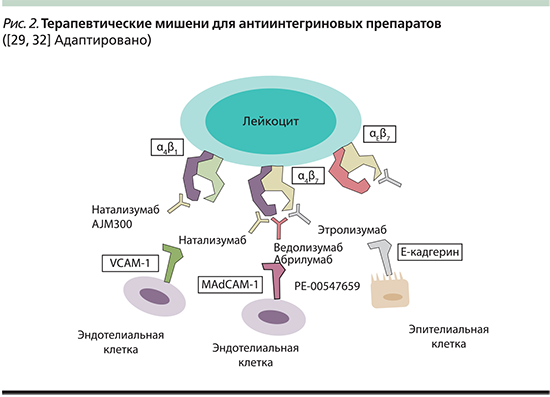
Первым представителем группы препаратов, блокирующих хоуминг α4β1- или α4β7-интегринов, стал натализумаб. В ходе клинических испытаний установлено, что натализумаб способен реактивировать вирус Джона Каннингема и тем самым вызывать прогрессирующую мультифокальную лейкоэнцефалопатию (ПМЛ) – редко встречающуюся оппортунистическую инфекцию ЦНС [14]. В связи с этим активный практический интерес вызывает разработка селективных антиинтегриновых препаратов, блокирующих хоминг лейкоцитов в ЦНС.
В данном контексте особый интерес представляет новый таргетный препарат, ведолизумаб, одобренный к применению для лечения ЯК и БК в США и странах ЕС, а в 2016 г. зарегистрированный в Российской Федерации. Ведолизумаб селективно распознает α4β7-гетеродимер и блокирует его взаимодействие с MAdCAM-1, тем самым препятствуя хомингу лимфоцитов в стенку кишки [30]. Эффективность ведолизумаба при ВЗК и его профиль безопасности оценивались в двух интегрированных рандомизированных контролируемых исследованиях III фазы – GEMINI-1 для ЯК и GEMINI-2 для БК. По результатам исследования GEMINI-1 препарат продемонстрировал преимущество по сравнению с плацебо в отношении пациентов с тяжелым и среднетяжелым ЯК, был безопасным и хорошо переносился. Профиль безопасности ведолизумаба был сопоставимым с таковым у анти-ФНО препаратов, однако необходимо проведение длительных наблюдательных исследований, особенно в отношении частоты ПМЛ и риска возникновения злокачественных новообразований [31].
В настоящее время проводятся клинические исследования ряда перспективных препаратов, позволяющих с различной эффективностью воздействовать на миграцию лейкоцитов, таких как PF-00547659 (SHP647), AJM300, абрилумаб (AMG181/MEDI7183), этролизумаб [32].
Этролизумаб (rhuMAb β7) – это гуманизированное моноклональное IgG1-антитело против β7-субъединицы α4β7- и αEβ7-интегринов. Этролизумаб блокирует хоминг лейкоцитов двумя путями: посредством ингибирования взаимодействия не только α4β7 с MAdCAM-1, но и αEβ7 с E-кадгерином. На сегодняшний день в мире продолжаются 5 рандомизированных плацебо-контролируемых клинических исследований III фазы, оценивающих эффективность и безопасность применения этролизумаба для пациентов с тяжелым и среднетяжелым ЯК, а также одно открытое расширенное исследование.
Поскольку при ингибировании αEβ7-интегрина, который экспрессируется не только Т-клетками СО кишки, но и другими тканями, возрастает частота местных инфекций, наиболее дискутабельным аспектом применения этролизумаба является вопрос: должны ли латентные инфекции относиться к серьезным нежелательным явлениям [32].
PF-00547.659 – полностью человеческое IgG2-антитело к MAdCAM-1, которое блокирует эндотелиальную МА и не позволяет ей связаться с лигандом интегрина-α4β7, что представляет собой новую стратегию ингибирования хоминга лейкоцитов.
В настоящее время проводится крупномасштабное клиническое исследование III фазы пациентов с ЯК, в ходе которого будут получены дополнительные данные о безопасности препарата, однако уже сейчас известно, что терапия PF-00547.659 требует тщательного мониторинга нежелательных явлений со стороны желудочно-кишечного-тракта [32].
Известно, что во II фазе клинических испытаний находятся два препарата для индукции ремиссии при ЯК: AJM300 (анти-α4-интегрин для перорального приема) и полностью человеческое IgG2-моноклональное антитело для подкожного применения – абрилумаб (AMG181/MEDI7183), мишенью для которого служит α4β7-интегрин [32].
Заключение
Приведенные выше результаты исследований демонстрируют многообразие биологических реакций, связанных с избыточной продукцией МА, однако их роль в иммунопатогенезе ВЗК требует дальнейшего изучения. Очевидно, что это позволит позиционировать МА, с одной стороны, в качестве потенциальных биомаркеров, определение экспрессии которых оптимизирует диагностический процесс, с другой – как перспективные терапевтические мишени. На сегодняшний день на финальных стадиях клинических испытаний находится ряд новых биологических препаратов, которые с большой вероятностью могут продемонстрировать эффективность и благоприятный профиль безопасности в отношении достижения стойкой клинической ремиссии при ВЗК. Очевидно, что это послужит предпосылкой к разработке ряда новых специфических схем лечения.



