Введение
Гангренозная пиодермия (ГП) – реактивный неинфекционный воспалительный дерматоз, относящийся к группе нейтрофильных дерматозов, включающих также синдромы Свита и Бехчета [1]. ГП может быть идиопатической, но часто является спутником других соматических, прежде всего воспалительных, заболеваний кишечника (ВЗК), к которым относятся язвенный колит (ЯК) и болезнь Крона (БК), и считается их внекишечным проявлением [3–5]. С ГП также ассоциированы ревматологические и онкогематологические заболевания, аутовоспалительные синдромы.
Впервые ГП была описана французскими дерматологами L. Brocq и C. Simon в 1908 г., которые назвали заболевание геометрическим фагеденизмом (phageton, греч. – пожирать). Термин «гангренозная (эритема) пиодермия» впервые упомянут в 1930 г. в работе L.A. Brunsting et al. [6], которые описали в т.ч. четыре случая язвенно-гнойного поражения кожи при ЯК. Так, уже на ранних этапах изучения проблемы отмечена связь ГП с ВЗК.
Эпидемиология
ГП – редкое заболевание. Его эпидемиологические характеристики недостаточно изучены, в отдельных исследованиях распространенность составляет на 100 тыс. населения: 0,63 случая – в Великобритании, 5,8 – в США и 0,3 – в Японии [7–9]. В итальянском исследовании зарегистрирована заболеваемость 5,17 нового случая на 1 млн населения в год. В большинстве исследований ГП чаще наблюдалась у женщин, а средний возраст при обращении составлял 51,6–59 лет [7, 8].
Патогенез
Патогенез ГП малоизучен. Обсуждается роль генетического фактора, иммунной/воспалительной дисрегуляции, дисфункции нейтрофилов. Исследования последних десятилетий показали роль полигенной наследственной предрасположенности (мутации, определяющие аберрантную активность иммунной системы) и значение хемокинов в активации и хемотаксисе нейтрофилов, приводящих к формированию очагов ГП. Последнее время исследователи склоняются к аутовоспалительному генезу ГП.
ГП во многом обусловлена нарушением врожденного иммунитета. Некоторые случаи ГП связаны с мутацией янус-киназы 2, которая участвует в продукции ряда цитокинов. Особо выделяют роль мутации в гене PSTPIP1, отвечающем за выработку ингибитора активации инфламмасом. В результате активации инфламмасом происходят активация каспазы-1, выработка провоспалительного интерлейкина-1β (ИЛ-1β), активация натуральных киллеров и фибробластов, продуцирующих ИЛ-8, в ответ на действие триггера (например, механического повреждения или инфекционного агента), с последующим развитием пироптоза в эпителиальных тканях, в частности в коже. Активация приобретенного иммунитета в свою очередь происходит с преобладанием клональной экспансии Тh1/Тh17 лимфоцитов и формированием периферической лимфоцитарной инфильтрации в очаге ГП. Усиливается выработка и активность ряда цитокинов, хемокинов и ферментов (фактора некроза опухоли-α [ФНО-α], ИЛ-8, -17, -18, металлопротеиназ [MMP], преимущественно MMP-2 и -9, миелопероксидазы и фактора роста эндотелия сосудов), что в конечном итоге реализуется в хемотаксис нейтрофилов. Важную роль в активации нейтрофилов и стимуляции воспаления, опосредованного ИЛ-17, играет ИЛ-23, уровень которого повышен при ГП. Развиваются нейтрофильные инфильтраты, более выраженные в центральной зоне очагов, и нейтрофильная васкулопатия по периферии [11–14].
Клиническая картина
Клиническая картина ГП может весьма варьироваться. Чаще всего выделяют классическую язвенную, пустулезную, буллезную и вегетирующую формы [13–16]. Отдельные авторы описывают также перистомальную (как вариант – послеоперационную), генитальную, злокачественную и внекожные формы [1, 12, 15, 16].
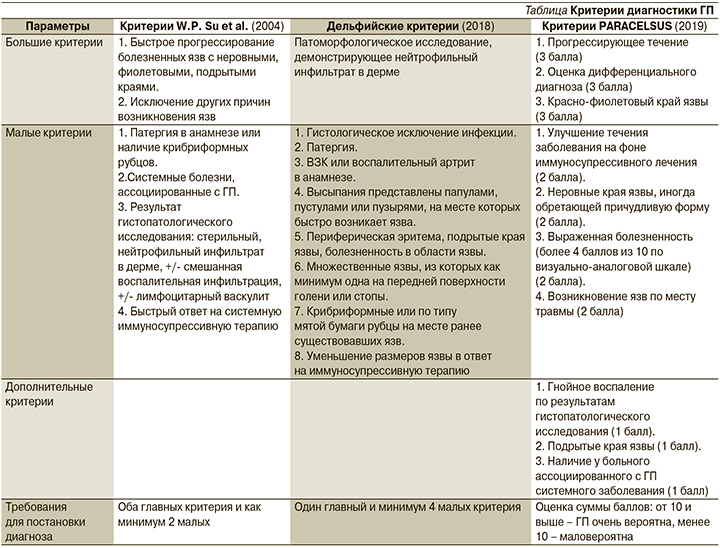
Классическая язвенная форма ГП встречается чаще других, характеризуется развитием единичных или множественных язв на фоне эритематозных очагов с геморрагическим или цианотичным оттенком. Чаще наблюдаются быстрое развитие (в течение нескольких дней от возникновения эритемы) и периферический рост, слияние язв. Описано и медленное течение заболевания [17]. Характерны цианотичные края язвы с неровной подрытой внутренней и возвышенной наружной поверхностями (рис. 1). Типична болезненность краев как в покое, так и при пальпации. Форма язв чаще неправильная, нередко с угловатыми очертаниями. Дно неровное, покрыто густым вязким гнойным экссудатом с островками некротизированной кожи. Типична локализация язв на разгибательной поверхности дистальных отделов нижних конечностей [18], что, по мнению участников американского консенсуса (2022), является одним из критериев диагностики ГП [19]. При таком расположении на участках кожи с практически отсутствующей подкожно-жировой клетчаткой на дне язв иногда визуализируются подлежащие сухожилия и мышцы. Дальнейшая эволюция язвы приводит к образованию т.н. крибриформных рубцов (рис. 2), их поверхность сравнивают со смятой бумагой – она неровная, на свежих рубцах западающие цианотичные участки перемежаются с розовато-белыми выступающими извилистыми тяжами. Этот признак является одним из диагностических критериев ГП, хотя и носит ретроспективный характер.
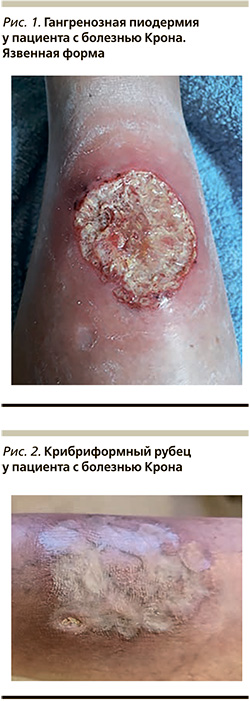
Пустулезная форма ГП впервые описана у больных ВЗК, встречается реже, чем язвенная. Характеризуется возникновением обычно множественных, первоначально не сливающихся между собой пустул, окруженных зоной эритемы. В дальнейшем пустулы могут изъязвляться с образованием типичных язвенных очагов, могут сосуществовать с язвами. Но считается, что чаще пустулы спонтанно подвергаются обратному развитию без формирования язвы и, соответственно, рубца [15, 17, 18]. При этой форме чаще поражаются кожа корпуса и проксимальные отделы конечностей.
Вегетирующая форма чаще начинается как классическая, но затем нередко на фоне лечения на поверхности язв появляются вегетации [20]. Для этой формы ГП характерны поражение головы, шеи и верхних отделов туловища, меньшая подрытость края и скудное гнойное отделяемое язв [21].
Буллезная форма начинается с возникновения отдельных поверхностных нестойких пузырей, окруженных неярким воспалительным венчиком, заполненных мутным экссудатом, которые быстро вскрываются. Возникают эрозии, затем язвы и дальнейшее течение напоминает язвенную форму.
По данным ретроспективной работы L. Schosler et al., у 49% пациентов заболевание развилось спонтанно, у 27% – после незначительной травмы, а у 17% – после обширной операции или тканевой терапии [22].
Диагностика
Длительное время ГП считалась диагнозом исключения. Но в последние годы были предложены диагностические инструменты, состоящие из больших и второстепенных критериев (см. таблицу).
Первоначально диагностические критерии были предложены P.Von Den Dreisch в 1997 г. [23]. В 2004 г. они были дополнены W.D. Su et al. [24] и долго оставались основным диагностическим инструментом. Они удачно сочетали первостепенность данных клинической картины с дополнительным значением гистопатологического исследования. Но положение о дифференциальной диагностике, которая при ГП сложна, оставляло широкие возможности для диагностических ошибок.
В критериях, предложенных Дельфийским консенсусом в 2018 г. [25], основным является патоморфологическое подтверждение ГП, клиническая картина отступает на второе место. Хотя риск патергической реакции ограничивает широкое использование биопсии кожи, было бы идеально получать гистологическую верификацию клинического диагноза. На практике такое подтверждение часто отсутствует. Например, в исследовании P. Hammer et al. при слепой сравнительной оценке биоптатов воспалительных язв тремя патоморфологами заключительный клинический диагноз ГП совпадал с результатами оценки патоморфологами лишь в 26% случаев [26].
Американским консенсусом по внекишечным проявлениям ВЗК оптимальной диагностической стратегией признана экспертная клиническая оценка поражения кожи и исключение других возможных заболеваний [19]. При таком подходе данные гистопатологического исследования играют вспомогательную роль, хотя и отмечается их несомненное значение в дальнейшем развитии диагностических инструментов для ГП [19].
В 2019 г. опубликованы критерии PARACELSUS (аббревиатура, состоящая из первых букв определений критериев на английском языке). В них акцент вновь перенесен на клинические признаки, значимость и специфичность которых для ГП отражена в количестве баллов, присвоенных каждому. Результаты гистопатологического исследования относятся к дополнительным критериям и имеют относительно небольшой «вес» [27]. Авторам статьи критерии PARACELSUS кажутся наиболее удобными для рутинного применения.
Дифференциальная диагностика
Дифференциальный диагноз проводят с другими язвенными поражениями кожи: поражением при васкулитах, сосудистых заболеваниях с окклюзией сосудов, инфекциями, онкопроцессом, внешними повреждениями кожи, другими нейтрофильными дерматозами, пустулезной лекарственной реакцией [28]. Язвы, возникающие при глубоких микозах, лейшманиозе и микобактериальной инфекции, клинически трудно отличимы от проявлений ГП.
ГП у больных ВЗК, получающих иммунодепрессивное лечение, чаще приходится отличать от инфекций кожи и мягких тканей. На практике обычно отсутствие ожидаемого эффекта от системной антибактериальной терапии приводит к переоценке диагноза и подозрению на ГП [29].
Теоретически отрицательный результат бактериологического исследования гноя имеет решающее значение, но ожидание его результатов может отсрочить начало необходимой системной терапии ГП. С другой стороны, в очаге часто обнаруживаются как патогенные, так и сапрофитные кокки, синегнойная палочка, протей или Escherichia coli, но позитивные результаты культурального исследования не исключают ГП. Эти микроорганизмы, по меткому высказыванию M.H. Cohen, являются «вторичными захватчиками» [11].
Особенности ГП при ВЗК
Внекишечные проявления наблюдаются примерно у трети больных пациентов с ВЗК. При этом поражение кожи является вторым наиболее частым проявлением после суставных симптомов и наиболее частыми кожными заболеваниями являются узловатая эритема и ГП [30, 31]. ГП, с позиции гастроэнтерологов, традиционно рассматривается как внекишечное проявление ВЗК, связанное с активностью кишечного процесса [2]. Однако существуют разногласия относительно корреляции между ГП и активностью ВЗК, поскольку она может быть параллельной активности ВЗК или протекать независимо [4].
С другой стороны, ВЗК является наиболее частой коморбидной патологией при ГП. В крупном популяционном исследовании распространенность ВЗК была более чем в 24 раза выше среди пациентов с ГП, чем в контрольной группе [32]. В работе, изучавшей ассоциацию ГП с различными заболеваниями, чаще всего она встречалась именно при ВЗК (33% наблюдений), а не при ревматоидном артрите или гематологических нарушениях [33]. По данным H.J. Ashchyan et al. (2018), пациенты с ВЗК составляют 41% от всех пациентов с ГП [34].
Сообщалось об общих генах предрасположенности к ВЗК и ГП, таких как IL-8Rα, MUC17 и MMP24, выявленных в полногеномном исследовании [35].
Считается, что ГП развивается у 0,6–2,1% пациентов с ЯК, несколько реже – с БК [4]. В отдельных работах ГП, наоборот, чаще наблюдалась при БК. Согласно недавнему мета-анализу, оценивавшему кумулятивную когорту из 61 695 пациентов с ВЗК, наличие ГП взаимосвязано с женским полом, БК, глазными внекишечными проявлениями и наличием стомы у стационарных пациентов [31].
Для ВЗК описаны классическая, буллезная, пустулезная и перистомальная формы ГП [29]. Локализация ГП при ВЗК может быть различной, но чаще наблюдается на нижних конечностях. Патергия – классическая характеристика ГП – может быть причиной подобной локализации, т.к. это часто травмируемая зона. Тот же феномен также может объяснить и уникальный для пациентов ВЗК после колэктомии перистомальный фенотип [36].
ГП может ограничивать пациента в силу болевого синдрома, осложняться суперинфекциями, приводить к косметическим уродствам, требовать проведения пересадки кожи. Она считается одним из наиболее тяжелых внекишечных проявлений ВЗК, поскольку оказывает большое влияние на повседневную активность и качество жизни пациента, а также требует коррекции лечения [13, 36]. В британском популяционном исследовании риск смерти у пациентов с ВЗК и ГП был на 72% выше, чем у контрольной группы с ВЗК [33].
Существует лекарственно-индуцированная форма ГП. Важно, что ее вызывает ряд лекарственных средств, в т.ч. используемых в лечении ВЗК. Так, ГП может возникать как парадоксальная реакция на ингибиторы ФНО-α [35].
Лечение ГП
При ГП рекомендуется госпитализация для детального обследования, лечения и обезболивания. Кроме того, базисным лечением любых язвенных поражений голени является режим покоя, они не заживают быстро при сохранении нагрузки [35]. Хирургической обработки поражений ГП не рекомендуется, ухудшает течение ГП, возможна лишь при развитии осложнений, таких как гематома или абсцесс [35].
Местное лечение. Наружная терапия является первоначальным методом выбора у пациентов с ранними легкими локализованными поражениями (<2 см2). Рандомизированных клинических исследований (РКИ) наружной терапии ГП не проводилось, и препараты, дозы и частота аппликаций остаются нестандартизованными [29]. Топические глюкортикостероиды (ГКС) и/или ингибиторы кальциневрина наиболее часто используются на область язвы и зону периферического воспаления. Полное заживление обычно занимает длительное время: от нескольких недель до многих месяцев [29].
Уход за язвой – важная составляющая терапии ГП. В задачи наружной терапии входит устранение экзогенных факторов, таких как травматизация (как спонтанная, так и ятрогенная) и профилактика присоединения вторичной инфекции [29].
Необходимый минимум включает очищение дна язвы, особенно необходимое при активности процесса, когда имеется выраженная экссудация. Рекомендуется использовать теплые стерильные физиологический и водные растворы бесцветных антисептиков. Это обычно приводит к уменьшению раздражения и облегчению болей. Для удаления вязкого гнойного экссудата возможно кратковременное наложение на дно язвы марлевой салфетки, смоченной раствором хлоргексидина биглюконата. Если некротическая ткань прилипает к поверхности кожи, ее можно осторожно удалить ножницами, но следует избегать чрезмерной санации и прямой фиксации клейкой поверхности перевязочного материала к коже [35]. Также необходимо следить за возможным развитием контактного дерматита [35]. Края язвы необходимо защищать от мацерации отделяемым. Рекомендуются пасты (или кремы, содержащие 30% порошка) с оксидом цинка. Нельзя допускать образования массивных корок. Использование мазей позволяет поддерживать соответствующую влажность поверхности язвы, что способствует ее заживлению.
Язва должна быть закрыта повязкой. Выбор повязки основывается на количестве отделяемого. В начале лечения, когда количество экссудата велико, целесообразно выбирать абсорбирующую антибактериальную повязку. Когда экссудация уменьшается, важны антибактериальные свойства повязки для профилактики бактериальной колонизации. Современные полимерные противомикробные и гиперабсорбирующие повязки оказываются наиболее подходящими для лечения ГП. Они не требуют частой смены, тем самым уменьшают риск патергии [37].
Спорным моментом является применение местных антибактериальных средств для профилактики инфицирования. При ГП, осложненной бактериальной инфекцией, рекомендуется системное применение антибиотиков. Профилактическое наружное применение антибиотиков может вызывать образование устойчивых штаммов [35]. Существуют ограниченные данные об эффективном местном применении повидон-йода и сульфадиазина серебра в составе комплексной терапии [38, 39].
Системное лечение. ГП (кроме вегетирующей формы) сопровождается болями, поэтому требуется контроль боли с помощью нестероидных противовоспалительных средств [35].
Это может составлять определенную проблему при ВЗК в связи с их неблагоприятным воздействием на слизистую оболочку желудочно-кишечного тракта.
Системная терапия ГП 1-й линии – иммунодепрессивные препараты. Сообщалось об эффективности ряда иммунодепрессантов. Но наибольшую доказательную базу имеют преднизолон и циклоспорин, которые, что важно, являются быстродействующими [29, 35].
РКИ показало, что терапия циклоспорином и преднизолоном близка по эффективности. Но серьезные побочные эффекты, преимущественно инфекции, значительно чаще осложняют ГКС-терапию [40].
Пероральный преднизолон назначают в дозе 0,5–1,0 мг/кг/сут так, чтобы максимальная доза не превышала 60 мг/сут [29, 35]. Доза циклоспорина составляет 2,5–5,0 мг/кг/сут [35]. Хотя эти препараты эффективны, заживление происходит очень долго (в течение многих месяцев) [35].
Клиническое улучшение (остановка прогрессирования язвы и уменьшение боли, воспаления в области язвы) определяется появлением симптома Гулливера, предложенного E. Landis et al.: уменьшение приподнятости краев язвы при ГП и развитие нитевидных тяжей, простирающихся от края ко дну язвы, напоминающих канаты, которыми лилипуты держали героя произведения Дж. Свифта [41]. Такие изменения характеризуют стадию консолидации кожного процесса и служат показанием к снижению дозы системных ГКС.
Такролимус близок к циклоспорину механизмом действия и является разумным выбором [35], но, несмотря на многочисленные сообщения и открытые исследования по применению перорального такролимуса, РКИ не проводилось.
Колхицин считается эффективным в качестве дополнения к стероидной терапии и используется в дозах 0,6–1 мг/сут [35]. Имеются ограниченные данные об эффективности в составе комплексной терапии миноциклина, макролидных антибиотиков, доксициклина, иодида калия, дапсона, но РКИ отсутствуют [29, 35].
Анти-ФНО-препараты имеют доказанную эффективность при ГП, наиболее изучены при ГП инфликсимаб и адалимумаб [35]. Так, в РКИ было продемонстрировано, что уже через 2 недели инфликсимаб приводит к улучшению у 46% пациентов по сравнению с 6% при применении плацебо [42].
Поскольку пациенты с ГП часто имеют другие аутоиммунные или аутовоспалительные заболевания, проводится коррекция базисной терапии коморбидности, включая биологическую терапию и малые молекулы. Благодаря этому описаны случаи позитивной реакции ГП на ряд препаратов. Японская дерматологическая ассоциация, проанализировав публикации до 2022 г. включительно, указывает на зарегистрированную эффективность применения устекинумаба, рисанкизумаба, гуселькумаба, анакинры, канакинумаба, тоцилизумаба, секукинумаба, бродалумаба, апремиласта, алефацепта, тофацитиниба и барицитиниба [35].
Особенности лечения при ВЗК
Основной терапевтической целью при ВЗК является клинический контроль воспалительной активности в кишечнике. Но наличие ГП влияет на тактику ведения пациента с ВЗК даже в отсутствие активности кишечного процесса [43]. C учетом доказательной базы консенсус Европейской организации по изучению болезни Крона и колита [ECCO – European Crohn’s and Colitis Organisation] рекомендует лечить ГП при ВЗК системными ГКС, инфликсимабом или адалимумабом, а также местными или пероральными ингибиторами кальциневрина [4].
Важно, что пациенты с ГП и ВЗК плохо реагируют на стандартную терапию ГП преднизолоном [44]. Поэтому лечение такого сочетания часто приводит к пересмотру базисной терапии ВЗК, переводу на биологическую терапию или смену препарата. Предполагается, что именно биологическая терапия может приносить наибольшую пользу пациентам с ВЗК и ГП [44]. Увеличивающееся число сообщений о эффективности при ГП различных биологических препаратов и малых молекул, используемых при ВЗК, позволяет при выборе системной терапии исходить из наиболее показанной при данном кишечном процессе.
Заключение
В заключение отметим, что ГП, ассоциированная с ВЗК, сложное для диагностики и лечения состояние, требующее системной и местной терапии. Большинство проводившихся исследований носит ретроспективный характер и описывает серии случаев. Необходимы РКИ для изучения оптимальных доз и комбинаций существующей терапии с учетом коморбидности.
Вклад авторов. А.В. Якубовский, Е.В. Соколовский – концепция и дизайн исследования, сбор и обработка материала, написание текста, редактирование.



