Введение
Язвенный колит (ЯК) и болезнь Крона (БК) представляют собой две нозологии, объединенные единым термином «воспалительные заболевания кишечника». ВЗК привлекают внимание всего мира из-за их растущей распространенности. В США около 3 млн человек имеют диагноз БК или ЯК и ежегодно диагностируется до 70 тыс. новых случаев заболевания [1]. В России ежегодный прирост заболеваемости увеличился в 6 раз за последние 10 лет. Дебют ВЗК, как правило, отмечается у людей трудоспособного возраста, пик заболеваемости отмечается между 20 и 30 годами жизни [2]. Социальная значимость этих заболеваний обусловлена необходимостью проведения длительной, часто пожизненной, терапии, регулярным физикальным, лабораторным и инструментальным обследованиями, высоким риском инвалидизации, необходимостью в госпитализациях, повышением качества и увеличением продолжительности жизни, а также предотвращением прогрессирования патологического процесса и развития осложнений.
На сегодняшний день причины возникновения ВЗК остаются неизвестными. Общепринятая концепция развития ВЗК включает комплекс генетической предрасположенности, нарушений регуляции иммунных реакций, микробного дисбиоза и влияния факторов окружающей среды [3]. Несмотря на то, что у ЯК и БК клиническая картина имеет значительные различия, увеличение количества и активация нейтрофилов в крови и в слизистой оболочке кишки, а также хроническое воспаление являются их общими чертами.
Цель представленного обзора - выяснить степень изученности процесса нетоза при воспалительных заболеваниях кишечника и определить, какие вопросы требуют дальнейшего более пристального рассмотрения для формирования новых патогенетически обоснованных методов диагностики и лечения.
Роль нейтрофилов в патогенезе ВЗК
Нейтрофилы - основные агенты иммунной системы, составляют около 70% лейкоцитов в крови человека и являются одними из первых клеток, реагирующих на воспаление и прибывающих к месту инфекции. Нейтрофилы представляют собой фенотипический гетерогенный пул клеток крови, которые воздействуют как на микробные клетки, так и на клетки организма хозяина через продукцию цитокинов и антимикробных белков. Они являются одновременно как модуляторами воспаления, так и агентами иммунной системы. Нейтрофилы вызывают повреждение и гибель клеток, высвобождая миелопероксидазу и нейтрофильную эластазу [4], а также генерируя высокотоксичный супероксид кислорода и перекись водорода, в результате чего происходит окислительный взрыв, что непосредственно разрушает клеточные мембраны [5]. Нейтрофилы играют ключевую роль в воспалительном процессе и при ВЗК, производят в большом количестве активные формы кислорода, что в конечном итоге приводит к повреждению эпителиального барьера [6]. Помимо этого они высвобождают про-воспалительные цитокины, такие как фактор некроза опухоли а (ФНО-а), интерлейкин (ИЛ)-8, лейкотриен В4, которые также повреждают эпителиальный барьер, привлекая еще большее количество нейтрофилов в кишечник [7]. Очевидно, что инфильтрация нейтрофилами коррелирует с активностью ВЗК и является широко используемым надежным маркером оценки степени тяжести повреждения при ЯК [8]. В качестве лабораторных маркеров могут определяться различные биоактивные молекулы, образуемые нейтрофилами в процессе воспаления. Например, кальпротектин - это белок цитозоля, связывающий кальций и цинк, который продуцируется полиморфноядерными нейтрофилами. На сегодняшний день фекальный кальпротектин считается одним из лучших лабораторных биомаркеров воспаления в кишечнике, поскольку является точным неинвазивным тестом, позволяющим отобрать пациентов для проведения дополнительного радиологического и/или эндоскопического исследования. Содержание данного маркера коррелирует с гистологической и эндоскопической оценкой активности ВЗК [9]. Комитет по выбору терапевтических мишеней при ВЗК STRIDE (The Committee on Strategies and Tactics for Recruiting to Improve Diversity and Excellence) рекомендовал использовать фекальный кальпротектин и С-реактивный белок для мониторинга ответа на терапию [10]. Лактоферрин - гликопротеин, который также синтезируется нейтрофилами, мононуклеарными фагоцитами и эпителиальными клетками. Как и в случае с фекальным кальпротектином, лактоферрин используется в дифференциальном диагнозе между воспалительными и функциональными заболеваниями кишечника, поскольку обладает высокой чувствительностью и специфичностью [11]. Существуют и другие биомаркеры ВЗК, выделяемые нейтрофильными лейкоцитами.
Существует три основных схемы борьбы нейтрофилов с патогенами: фагоцитоз, дегрануляция с выделением активных форм кислорода и формирование нейтрофильных внеклеточных ловушек (НВЛ) [12]. Первые две схемы давно известны и хорошо изучены, тогда как об НВЛ стало известно относительно недавно.
Нейтрофильные внеклеточные ловушки
Нетоз (от англ. Neutrophil extracellular traps, NET) - это физиологический процесс, характеризующийся выбросом НВЛ в ответ на патогенное воздействие [13]. НВЛ представляет собой сеть, высвобождающуюся из нейтрофильного лейкоцита в ответ на контакт с антигеном, который этот лейкоцит не в состоянии уничтожить при помощи фагоцитоза, дегрануляции и генерации активных форм кислорода.
НВЛ обнаружены коллективом авторов из Японии в 1996 г. [14]. Цель их исследования - уточнение процесса взаимосвязи между активацией нейтрофилов и апоптозом при помощи форбол-12-миристат-13-ацетата, при этом были обнаружены изменения, нетипичные ни для апоптоза, ни для некроза. H. Takei et al. предположили, что здесь может иметь место альтернативный путь гибели клеток. Ими были описаны процессы слияния мультиглобулярного ядра нейтрофила и уменьшение конденсации хроматина, разрушение ядерной оболочки при сохранении цитоплазматических органелл и дальнейшее разрушение мембраны [14]. В 2004 г. Brinkmann et al. более подробно описали этот процесс и назвали его нетозом [15]. Образование ловушек обусловлено взаимодействием нейтрофила с болезнетворным агентом, при этом основой ловушки выступают нити ДНК, связанные с гистонами и цитотоксическими белками - производными нейтрофилов, которые могут захватывать, нейтрализовать и уничтожать патогены [16]. В процессе нетоза наиболее часто обнаруживаются ферменты, которые его активируют: миелопероксидаза и нейтрофильная эластаза, они являются маркерами высвобождения НВЛ [17].
НВЛ — внеклеточные структуры, которые являются физическим барьером, препятствующим распространению воспалительного процесса. Площадь ловушки может превышать размер нейтрофила в 10-15 раз, что позволяет атаковать крупные и/ или многочисленные патогены [18]. Активация нейтрофильных ловушек обусловливается как инфекционными агентами (бактерии, вирусы, грибы, простейшие, паразиты), так и немикробными патогенами (например, аутоиммунные антитела, опухолевые клетки) [19]. Выделяют три типа нетоза. Первый - «суицидальный» нетоз. Начинается он с распознавания нейтрофилами воздействующих факторов, которые активируют внутриклеточные ферменты, способствуя деаминированию гистонов и деконденсации хроматина [20]. Далее постепенно утрачивается ядерная мембрана и хроматин распределяется в цитоплазме, смешиваясь с цитоплазматическими белками, после чего выходит за пределы клеточной мембраны путем клеточного лизиса. В качестве завершения процесса ДНК высвобождается в виде внеклеточных ловушек. При «суцидальном» нетозе клетка разрушается. Второй вид - витальный, при котором высвобождение НВЛ происходит без потери ядерной или плазматической мембраны и гибели клетки. В этом случае последовательно происходят процессы увеличения ядерной оболочки, деконденсация ядер и разрушения ядерной оболочки. После высвобождения ядра нейтрофилы попрежнему способны к фагоцитозу [21]. Третий тип был описан S. Yousefi et al. из Бернского университета, при котором вместо ядерной ДНК высвобождается митохондриальная [22].
Условно-патогенные бактерии также индуцируют образование НВЛ, что может нарушать естественную микрофлору организма [23], при муковисцидозе НВЛ индуцируют выработку ИЛ-8, что усугубляет процесс течения заболевания [24], при ревматоидном артрите служат основой для аутоантител [25], при васкулите способствуют тромбообразованию, создавая условия для адгезии тромбоцитов [26], а также способствуют прогрессированию рака захватывая и распространяя раковые клетки [27]. В связи с этим возникает необходимость в более подробном изучении механизмов, регулирующих нетоз.
НВЛ, эпителиальный барьер и ВЗК
Совокупность различных современных факторов образа жизни оказывает влияние на микробный пейзаж кишечника и приводит к изменению его разнообразия. Важной характеристикой кишечной микробиоты является ее индивидуальная изменчивость, обусловленная генетической предрасположенностью. Микрофлора толстой кишки находится в непосредственном контакте с апикальной мембраной колоноцитов и формирует в слизистом слое микроколонии, разнообразие которых зависит от состава химуса. То есть пищевые волокна, сахара и белки, которые не перевариваются ферментами макроорганизма в тонкой кишке, ферментируются микробиотой. Патогенетические механизмы влияния западной диеты на возникновение ВЗК остаются неизвестными, предполагают о прямом воздействии на состав микробиома толстой кишки и косвенные эффекты через продукцию микробных метаболитов, изменение локального иммунного ответа и нарушение барьерной функции слизистой оболочки толстой кишки [28]. Совокупность факторов агрессии: нарушение состава кишечного микробиома, наличие агрессивных кишечных метаболитов приводят к нарушению проницаемости слизистой оболочки кишки, нарушается барьерная функция, которая в норме определяется состоянием плотных межклеточных контактов, а также количеством и качеством муцина, защищающего эпителий. Энтероциты - наиболее распространенный тип клеток, которые образуют эффективный барьер для защиты внутренней среды, контролируют селективное поглощение (абсорбцию) ионов, питательных веществ и других компонентов из люминальной среды [29]. Дисрегуляция эпителиального барьера с изменениями парацеллюлярной проницаемости из-за измененных межклеточных соединений, вероятно, служит одним из ключевых первичных факторов в патогенезе ВЗК [30].
Парацеллюлярное (околоклеточное) пространство закрыто плотными соединениями (tight junctions, TJs), которые регулируют поток ионов воды и малых молекул и строят динамический кишечный барьер [31]. Плотные контакты состоят из двух типов белков: трансмембранные белки, к которым относятся окклюдин и клаудины, а также трицеллюлин, молекулы адгезии соединений, и периферические мембранные белки апикальной части клеток zonula occludens (ZO-1, ZO-2 и ZO-3). Некоторые белки TJs обладают свойствами повышенной барьерной пропускной способности, другие образуют селективные по размеру и/или заряду каналы и поры [32]. Дисфункция TJs приводит к нарушению целостности кишечного барьера.
Для изучения роли НВЛ в патогенезе ВЗК E. Lin et al. была создана модель экспериментального колита у мышей, вызванного 3,5%-ным раствором декстрансульфат натрия (DSS) [33]. Ученые наблюдали, что НВЛ изменяют целостность межклеточных соединений окклюдина, ZO-1 и E-кадгерина, индуцируют апоптоз эпителиальных клеток кишечника и увеличивают транслокацию просветных бактерий. Повреждение эндотелия приводит к локальной гипоксии, которая предшествует дисфункции эпителиального барьера, является важным патофизиологическим процессом образования эрозий, язв и воспаления при ВЗК. НВЛ у больных активным ЯК, оказывают цитотоксическое действие на эндотелиальные клетки, разрывая межклеточные плотные соединения с потерей нормальной морфологической картины [34]. Другие белки, связанные с НВЛ, такие как матриксные металлопротеиназы, разрушают E-кадгерин и окклюдин, тем самым приводя к дисфункции эпителиального барьера [35]. Описана роль катепсина G в расщеплении и активации PAR-4, что приводит к повышению парацеллюлярной проницаемости и барьерной дисфункции [36]. Кальпротектин также оказывает проапоптотическое действие [37]. Таким образом, биологические эффекты медиаторов экспрессируемых НВЛ регулируют проницаемость, усугубляют воспаление и вызывают дисфункцию эпителиального барьера кишечника через разрывы и разрушение межклеточных контактов, приводя к апоптозу эпителиальных клеток (рис. 1).
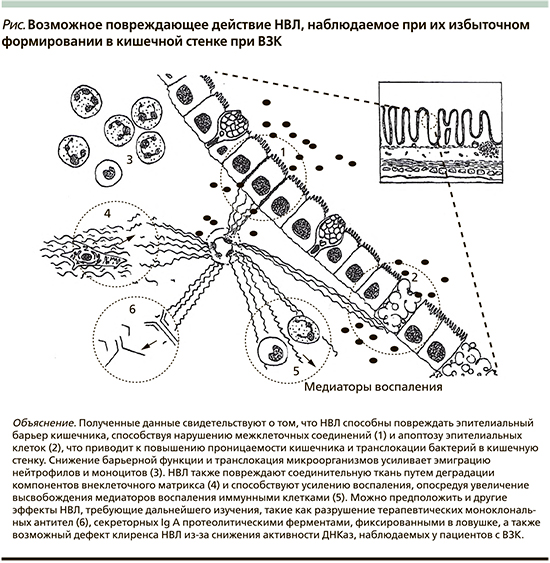
В своей работе В. Drury et al. [16] проанализировали результаты ряда исследований, в которых при обследовании биоптата слизистой оболочки кишечника, кала или крови пациентов с ВЗК была обнаружена положительная корреляция между количеством НВЛ и активностью заболевания. Методом жидкостной хроматомасс-спектрометрии выявлено увеличение миелопероксидазы и нейтрофильной эластазы — специфических белков — маркеров процесса нетоза, а также увеличение кальпротектина и катепсина G в биоптате и образцах кала. Далее биоматериал изучали методами иммунофлуоресценции, иммуногистохимии и вестернблота. Помимо миелопероксидазы и нейтрофильной эластазы в сыворотке крови пациентов обнаружены и другие НВЛ-специфические маркеры: цитруллинированный гистон H3 (метод вестернблот), комплексы ДНК с нейтрофильной эластазой, миелопероксидазы и гистонами (метод иммунофлуоресценции). Методом иммуногистохимии обследованы образцы биоптата пациентов, в которых обнаружены ДНК, связанные с миелопероксидазой. Вероятно, такие различия могут быть связаны с разными диагностическими возможностями используемых методов обследования, а также ограничением перехода нуклеарных компонентов НВЛ из крови в ткани.
Повышенное количество НВЛ не специфично для ВЗК, однако более высокие уровни белков, связанных с НВЛ, включая миелопероксидазу, нейтрофильную эластазу и кальпротектин, позволяют дифференцировать больных ВЗК от людей с функциональной патологией толстой кишки. Были описаны специфические для заболевания подмножества нейтрофилов, такие как гиперреактивные нейтрофилы интерферона I типа, которые считаются более восприимчивыми к образованию НВЛ. Нейтрофилы CD177+, склонные к образованию НВЛ, обнаруживаются в больших количествах в крови и воспаленной слизистой оболочке кишечника пациентов как с ЯК, так и с БК [38]. CD177 - это гликопротеин, который концентрируется исключительно на нейтрофилах, нейтрофильных миелоцитах и метамиелоцитах, участвует в процессе миграции нейтрофилов и повышается при острой бактериальной инфекции [39]. CD177+нейтрофилы имеют более высокую экспрессию генов, кодирующих гранулярные белки и более активны при ряде заболеваний, таких как васкулит, астма и др. [40]. При ВЗК у CD177+нейтрофилов основная функция смещена в сторону микробной защиты, они выделяют больше активного кислорода, миелопероксидазы, кальпротектина и производят больше НВЛ, чем CD177 нейтрофилы [41]. Продолжительность жизни нейтрофилов увеличивается за счет факторов роста, цитокинов и продуктов жизнедеятельности микробов во время инфекции и воспалительного процесса [42]. Задержка апоптоза приводит к персистенции специфических аутоантигенов, повышенному риску повреждения тканей и повышенной способности к образованию НВЛ [24]. При ВЗК спонтанный апоптоз нейтрофилов задерживается ИЛ-8 и гранулоцитарным колониестимулирующим фактором [43]. Таким образом, при ВЗК популяция нейтрофилов с повышенной способностью к образованию НВЛ может стимулироваться микробиотой кишечника через толлподобные рецепторы [44]. Эта популяция уменьшается при истощении микробиоты под воздействием антибактериальной терапии [45].
Роль внеклеточных нейтрофильных ловушек в тромбообразовании при ВЗК
Пациенты с ВЗК подвержены повышенному риску как первичной, так и повторной венозной тромбоэмболии, а также относительно высоким риском сердечно-сосудистой патологии [46]. Различные исследования показали, что НВЛ могут активировать тромбоциты, которые затем способствуют коагуляции путем высвобождения фосфатидилсерина и прокоагулянтных микрочастиц тромбоцитов [47]. ВЗК характеризуются инфильтрацией и активацией макрофагов. Известно, что протромботические цитокины (такие, как ИЛ-1в, ФНО-а, ИЛ-6) из воспаленной кишки при ВЗК активируют компоненты коагуляционного каскада и опосредуют изменения тромбоцитов, которые усиливают внекишечный тромбоз [48]. При ВЗК гибель энтероцитов является отличительной чертой кишечного воспаления [34], а повреждение эндотелия приводит к локальной гипоксии, дисфункции эпителиального барьера и служит основой патогенеза эрозии, язвы и воспаления при ВЗК [49].
Для выявления влияния НВЛ на прокоагулянтную активность тромбоцитов проведены эксперименты in vitro. В исследовании T. Li et al. [34] тромбоциты, выделенные от здоровых участников, инкубировали с нейтрофилами, выделенными из образцов пациентов с ВЗК. При этом у пациентов с активным ВЗК время коагуляции значительно сократилось по сравнению с пациентами, находящимися в ремиссии и контрольной группой. C помощью измерения мутности авторы исследования оценили способность тромбоцитов, обработанных НВЛ, поддерживать образование фибрина: у пациентов с ВЗК были обнаружены более плотные фибриновые сети. Усиленное образование НВЛ обнаружено у мышей с DSS-индуцированным колитом на 6-й день эксперимента. НВЛ определяли методами иммуногистохимии, вестернблот и иммунофлуоресценции. Далее мышей лечили ДНКазой I, которая приводила к разрушению НВЛ и предотвращала повышение циркулирующих сывороточных уровней ИЛ-6 и ФНО-а, а также улучшала гемостаз. Повреждение клеток кишечника, приводящее к нарушению эпителиального барьера, служит важнейшей характеристикой в патофизиологии колита, а нарушение сосудистого эндотелия приводит к задержке заживления кишечных язв, что также усугубляет процесс поражения кишечника [50].
Заключение
Формирование и высвобождение НВЛ при заболеваниях кишечника являются относительно новой и малоизученной областью. Единый взгляд на механизмы, классификацию и роль НВЛ в настоящее время отсутствует. Детальная расшифровка этого процесса, на наш взгляд, открывает перспективы в проведении нескольких направлений. Во-первых, возможность дифференциальной диагностики не только между функциональной и органической патологией, но и внутри группы ВЗК. Во-вторых, возможность оценки т.н. глубины ремиссии ВЗК, что особенно актуально в аспекте профилактики колоректального рака у больных, поскольку известно, что патофизиология колоректального рака, ассоциированного с ВЗК, сводится к канцерогенному эффекту воспаления. В-третьих, изучение специфических для ВЗК механизмов формирования НВЛ позволит прогнозировать и мониторировать ответ на проводимую терапии наряду с такими неинвазивными маркерами, как фекальный кальпротектин и С-реактивный белок, рекомендованными Комитетом по выбору терапевтических мишеней при ВЗК STRIDE. И наконец, дальнейшее изучение этого направления поможет в разработке новых методов лечения ВЗК, направленных на снижение активности нейтрофилов, замедление высвобождения и ускорение клиренса НВЛ.



