Введение
Для поддержания биологического гомеостаза необходимы условия надлежащего снабжения тканей кислородом. Баланс между потреблением и доставкой кислорода особенно важен для почек, которые всегда находятся в активном метаболическом состоянии.
Было установлено, что при хронической болезни почек (ХБП) гипоксия носит многофакторный характер, в т.ч. за счет повышенной потребности в кислороде, нарушения микроциркуляции, сосудистого ремоделирования, нарушения диффузии кислорода вследствие его накопления в экстрацеллюлярном матриксе и нарушения работы митохондрий [1]. В терминальной стадии ХБП хроническое воспаление, уремическая интоксикация и анемия создают условия для более тяжелого течения патологического процесса и поддерживают гипоксию [2]. В развитии анемии также имеет значение острая и хроническая кровопотеря, дефицит макро- и микронутриентов, но патогенетически наибольшую роль играет сниженная продукция эритропоэтина перитубулярными фибробластами.
В условиях низкой напряженности кислорода в крови синтезируются факторы транскрипции, называемые гипоксией индуцируемые факторы (hypoxia inductor factors – HIF′s), играющие важную роль в репаративных реакциях, кислородно-чувствительном механизме, обмене и утилизации железа. HIF относится к транскрипционным факторам и состоит из двух субъединиц: одной альфа- (HIFα) и одной бета-субъединицы (HIFβ). HIFα существует в виде множества изоформ (HIF-1α, HIF-2α и HIF-3α) с различными биологическими свойствами и особенностями синтеза [3]. HIF-1α экспрессируется во всех клетках организма человека, обеспечивает синтез эндогенного эритропоэтина на ранних стадиях ХБП, определяет ранний ответ организма на гипоксию, а также отвечает за синтез более чем 60 генов, участвующих в эритропоэзе, ангиогенезе, росте клетки, дифференциации, апоптозе [4, 5]. Экспрессия HIF-2α осуществляется в эндотелиоцитах, пневмоцитах II типа, интерстициальных почечных клетках, гепатоцитах и в клетках миелоидного ряда в условиях длительного недостатка кислорода [6]. Физиологическое значение HIF-3α на настоящий момент изучено недостаточно, однако предполагается его участие в обмене глюкозы и аминокислот, регуляции апоптоза, протеолиза, а также в дифференцировке адипоцитов [7].
В нормоксических условиях происходит гидроксилирование аминокислотных остатков пролина молекулы HIF-1α посредством HIF-пролилгидроксилаз или аспарагиновых остатков при помощи фактора, индуцирующего HIF-1 (Factor-Inhibiting HIF-1 – FIH-1), с последующим убиквитинированием молекулы посредством VHL-убиквитин-Е3-лигазы. В условиях гипоксии разрушения HIF-1α не происходит, в результате чего запускается каскад адаптационных механизмов.
В настоящее время динамической оценки активности HIF-1α у пациентов с ХБП 5Д и ее осложнений не проводится, тогда как единственным значимым показателем при оценке гипоксии выступает уровень гемоглобина.
Целью исследования стало изучение роли HIF-1α в развитии анемии у пациентов с ХБП 5Д, получающих лечение программным гемодиализом.
Материал и методы
Были обследованы 80 пациентов с ХБП-5Д, находившихся на лечении программным гемодиализом в ООО «ГЦ “Ростов”». Исследуемая группа была представлена 47 мужчинами и 33 женщинами, средний возраст которых составил 51,7±11,6 года, длительность диализа – 33,5 (19,7; 58,25) месяца.
Критерием исключения были возраст моложе 18 и старше 80 лет, ХБП 1–4 и 5 стадий, не получавших заместительной почечной терапии, алкоголизм или наркомания в анамнезе, подтвержденные заболевания мышечной ткани, психические нарушения. Гемодиализ проводился 12 часов в неделю. Клиническое обследование включило сбор жалоб, оценку объективного статуса, в т.ч. биоимпедансометрию аппаратом «Диамант АИСТ-мини» (Россия). Определение уровня HIF-1α проведено методом количественного иммуноферментного анализа однократно всем пациентам исследуемой группы с использованием набора Hypoxia-inducible factor (HIF-1α) ELISA Kit (США).
Статистический анализ данных проведен с помощью пакета прикладных программ «Statistica 10,0» («StatSoft», США). Статистическая значимость различий двух средних определялась с помощью критерия Стьюдента при нормальном распределении выборки, при отличии от нормального – критерием Манна–Уитни. Оценка силы взаимодействия между количественными признаками при нормальном распределении осуществлялась с помощью коэффициента Пирсона, при ненормальном – коэффициента Спирмена. При проведении сравнения двух независимых выборок применяли методы дисперсионного анализа: параметрический дисперсионный однофакторный анализ ANOVA с применением тестов Levene и Braun–Forsite при нормальном распределении и анализ Крускала–Уоллиса при распределении, отличном от нормального. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
Результаты
Концентрация HIF-1α в крови пациентов исследуемой группы колебалась в пределах от 0,16 до 0,27 нг/мл (Индекс К-С=0,26, p<0,01; Lilliefors p<0,01), медиана составила 0,17 (0,16; 0,21) нг/мл. В связи с тем что референсных значений HIF-1α у пациентов с ХБП в литературе не описано, нами была выделена группа пациентов с повышенными значениями показателя относительно медианы, с которой и проводилось сравнение (табл. 1)
Самостоятельного вклада анемии в развитие системной гипоксии обнаружено не было: группы достоверно не различались по уровню гемоглобина, внутри групп корреляционная связь с уровнем HIF была статистически незначимой (p>0,05). Целевые значения гемоглобина были достигнуты 34/42 (80,95%) и 32/38 (84,2%) пациентами, однако в группе с повышенным уровнем HIF-1α достоверно больше встречалась анемия средней степени тяжести: у 4/42 (10%) и 1/38 (3%) пациентов соответственно.
У всех пациентов определен повышенный уровень β2-микроглобулина, причем отмечена слабая корреляционная связь с показателем HIF-1α (r=-0,26; p<0,05), что подтверждалось различием в средних значениях показателя в группах (24,9±5,98; 27,61±5,44; p=0,041). Связи с уровнем С-реактивного белка (СРБ), в т.ч. внутри групп по уровню HIF-1α, выявлено не было.
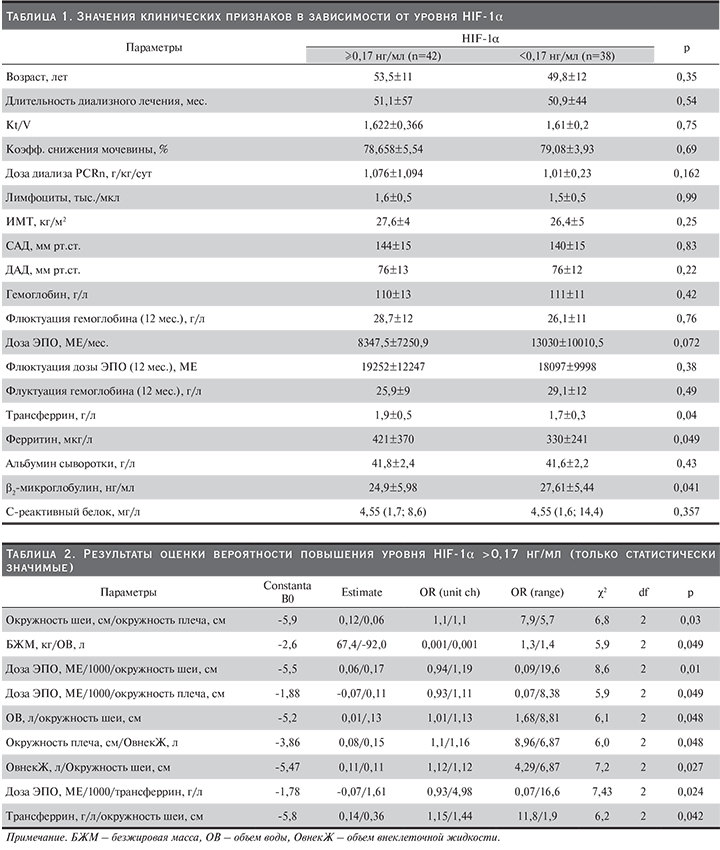
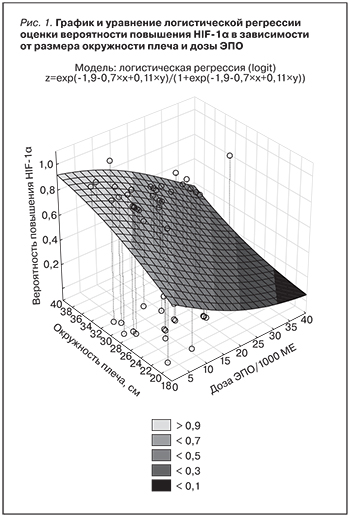
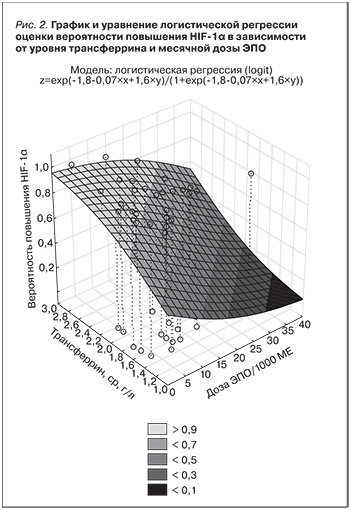
При проведении логистического регрессионного анализа были обнаружены факторы, отразившие повышенный уровень HIF-1α (табл. 2, рис. 1, 2).
Отмечается прямая зависимость уменьшения вероятности повышения уровня HIF-1α от месячной дозы ЭПО, обратная – от параметров феррокинетики (уровень сывороточного трансферрина). Также обнаружена связь некоторых антропометрических параметров, в частности окружностей плеча, шеи, с повышением уровня исследуемого биомаркера, что может быть применимо в комплексной оценке параметра.
 Обсуждение
Обсуждение
Отсутствие значимого влияния анемии на уровень HIF-1α может иметь несколько причин. Во-первых, в исследовании принимали участие пациенты с высокой флуктуацией длительности анамнеза ХБП, который нередко определяет выраженность нарушений эритропоэза. Во-вторых, на протяжении значительного промежутка времени пациентам уже проводилась заместительная терапия эритропоэз-стимулирующими агентами. И в этом аспекте значение имеет не только применяемый класс препаратов ЭПО. Обмен железа также нарушается при ХБП, ключевыми агентами обозначены гепсидин и ферропортин [8].
Ранее подтверждалось развитие жирового гепатоза при активации HIF [10], что наряду с высокой чувствительностью гепатоцитов к гипоксии может обусловливать повышение уровня АЛТ в группе с высоким уровнем HIF-1α. Также следует отметить влияние другой изоформы, HIF-3α, на обменные процессы в жировой ткани [7].
Зависимость повышения HIF-1α от антропометрических показателей, таких так окружность плеча и шеи, может быть обусловлена изменением компонентного состава тела в рамках развития белково-энергетической недостаточности преимущественно за счет увеличения абсолютного количества жировой и уменьшения мышечной ткани. Несмотря на отсутствие достоверных различий в содержании жировой ткани по результатам биоимпедансометрии (18,5±8,5;18,6±9,6; p=0,30), следует учитывать особенности нутритивного статуса, сопутствующего коморбидного фона в развитии данного состояния, а также возможность развития миостеатоза.
Выявленные особенности тканевого компартмента, а также их вклад в повышение уровня HIF-1α требуют дополнительного изучения. Однако с учетом доступности метода биоимпедансометрии его применение пациентами с патологией почек остается обоснованным.
Выводы
В ходе исследования продемонстрирована связь антропометрических данных и показателей феррокинетики с повышенным уровнем HIF-1α. В связи с этим определение этого биомаркера у пациентов с ХБП, получающих терапию гемодиализом, может играть важную роль в своевременной диагностике анемии, ее коррекции и иметь прогностическое значение. Требуется дальнейшее изучение межмолекулярных взаимодействий HIF-фактора, в частности его субъединиц, с целью уточнения патогенетических механизмов его обмена в клетке.



