Внастоящее время фармакотерапия коморбидных состояний является одной из наиболее актуальных проблем рациональной фармакотерапии. Это обусловлено в т. ч. одновременным назначением нескольких лекарственных препаратов (ЛП), множественностью их фармакологических эффектов, взаимодействием ЛП, проявляющих синергизм или антагонизм фармакологического действия, низкой приверженностью пациентов терапии, что требует обязательного контроля ее эффективности и безопасности.
Сочетание заболеваний сердечно-сосудистой системы, различных метаболических нарушений, патологии гепатобилиарной системы является наиболее частым в клинике практикующего врача. Атеросклероз, тромбоз и гипертония – наиболее распространенные патофизиологические процессы в сердечно-сосудистой системе, а метаболический синдром (МС) – это сочетание метаболических, гормональных и клинических нарушений, являющихся факторами риска развития сердечно-сосудистых заболеваний, в основе которых лежит инсулинорезистентность и компенсаторная гиперинсулинемия в сочетании с ожирением и жировым гепатозом.
ВОЗ установлено более 300 факторов риска (ФР), связанных с развитием ИБС и инсультом. В настоящее время во всех популяциях значимы четыре категории ФР:
- основные модифицируемые: повышенное АД, нарушенный липидный профиль, курение, гиподинамия, ожирение;
- другие модифицируемые: злоупотребление алкоголем, лекарственными средствами; психоэмоциональные дисфункции, социальный статус;
- немодифицируемые: возраст, национальность, наследственность, пол;
- «новые»: гипергомоцистеинемия, воспаление, нарушение свертывания крови.
Повышенные уровни атерогенных липидов и липопротеидов холестерина – липопротеидов низкой плотности (ЛПНП), триглицеридов, и низкий уровень липопротеидов высокой плотности (ЛПВП) в плазме крови относятся к важнейшим ФР развития атеросклероза и его осложнений.
Еще в 1989 г. было показано, что существенной составляющей метаболических нарушений – «смертельного квартета» – является абдоминальное ожирение. Распространенность этого симптомокомплекса приобретает характер эпидемии и в некоторых странах, в т. ч. и в России, достигает 25–35 % среди взрослого населения. В связи с этим в 2007 г. стартовал Национальный многоцентровой проект (Russian National Health Survey) по выявлению 20 ведущих факторов кардиоваскулярного риска во взрослой популяции (в возрасте 30–69 лет) [21] Российской Федерации (РФ).
В одномоментное исследование путем случайной выборки включены 15 тыс. человек из 7 городов РФ, что позволяет говорить о репрезентативности национальной выборки. Определяются уровни АД, ЧСС, показатели липидного спектра крови, гликемический статус, инсулинорезистентность (HOMA-IR – Homeostasis Model Assessment of Insulin Resistance), уровень С-реактивного протеина и мочевой кислоты. Результаты исследования позволят изучить структуру факторов кардиоваскулярного риска в нашей стране, их распространенность, сочетания и взаимосвязи. Это поможет в дальнейшем создать регистр и планировать профилактические мероприятия в масштабе регионов и страны в целом.
Изучение распространенности традиционных и новых факторов риска, в т. ч. МС, в случайной выборке взрослого населения было целью одномоментного популяционного исследования ПРИМА (М.Н. Мамедов и соавт., 2007). Оно проведено на 30 терапевтических участках Чебоксар (60 респондентов на каждом участке). Всего в исследовании приняли участие 1800 человек (749 мужчин и 1051 женщина) в возрасте 30–69 лет. Исследование показало, что в России доминирующими компонентами МС являются артериальная гипертензия (АГ) и абдоминальное ожирение, а 50 % больных МС имеют сочетание АГ, абдоминального ожирения и дислипидемии. Среди наиболее распространенных сопутствующих заболеваний в исследовании ПРИМА следует выделить холецистит и другие заболевания печени, варикозную болезнь вен нижних конечностей, заболевания простаты, щитовидной железы и др. В настоящее время МС ассоциируется со многими другими соматическими заболеваниями, поэтому его часто называют междисциплинарной патологией. Так как МС представляет собой комплекс различных патологических состояний (абдоминальное ожирение, АГ, дислипидемия, нарушение толерантности к глюкозе или сахарный диабет – СД), то и лечение таких пациентов должно быть обязательно комплексным [11].
Одним из ассоциированных с МС заболеваний является неалкогольная жировая болезнь печени (НАЖБП), протекающая в виде стеатоза печени и неалкогольного стеатогепатита (НАСГ) [23].
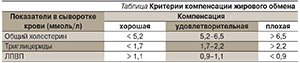
Европейская группа по изучению ИНСД (инсулиннезависимого сахарного диабета) разработала критерии степени компенсации жирового обмена (табл. 1) [24].
Стойкая гиперлипидемия, гиперхолестеринемия и гипертриглицеридемия являются ведущими звеньями формирования сочетанного поражения сердечно-сосудистой и гепато-билиарной систем [25].
 Кроме того, при СД и НАЖБП развитие дислипидемии также закреплено на уровне печени. Высокие концентрации свободных жирных кислот стимулируют липогенез в клетках печени с чрезмерным образованием триглицеридов и синтезом липопротеидов очень низкой плотности (ЛПОНП).
Кроме того, при СД и НАЖБП развитие дислипидемии также закреплено на уровне печени. Высокие концентрации свободных жирных кислот стимулируют липогенез в клетках печени с чрезмерным образованием триглицеридов и синтезом липопротеидов очень низкой плотности (ЛПОНП).
В результате формируется атерогенная дислипидемия с повышением уровня триглицеридов, мелких плотных ЛПНП и снижением антиатерогенных ЛПВП [18, 19].
Фармакотерапия с рациональным применением ЛП, обладающих этиотропным и патогенетическим механизмами действий, является ведущим фактором при определении стратегии терапевтических мероприятий. Препараты, содержащие эссенциальные фосфолипиды (ЭФЛ), восстанавливают структуру и функции клеточных мембран и обеспечивают торможение процесса деструкции клеток, поэтому их использование при метаболических нарушениях, в т. ч. при вовлечении в патологический процесс печени, является патогенетически обоснованным [2, 6].
К концу 2001 г. было выполнено 106 экспериментов с 30 различными типами моделей на 7 различных видах животных. Такими моделями были главным образом химическая и лекарственная интоксикации, например хроническая интоксикация тетрахлоридом углерода, постоянное применение этанола или органических растворителей, а также парацетамола, тетрациклина и индометацина [12]. Оценив действие ЭФЛ в этих фармакологических экспериментах (исследования in vivo), были сделаны следующие выводы. При изучении электронно-микроскопических признаков выявлены нормальные или в основном нормализованные структуры мембран и органелл. Микроскопические признаки показали уменьшение или отсутствие жировой дистрофии клеток печени либо уменьшение или отсутствие некроза гепатоцитов. Были выявлены довольно значимые улучшения биохимических показателей: влияние на окисление липидов, активность трансаминаз, метаболизм гепатоцита, холинэстеразу и на сывороточные липиды. Было отмечено усиление регенерации клеток печени и уменьшение образования соединительной ткани, что особенно важно для клинициста [13].
В отличие от других гепатопротекторов в отношении эффективности ЭФЛ имеется достаточная доказательная база. Так, к концу 2010 г. были опубликованы результаты 189 клинических испытаний, включивших более 12 тыс. больных. Среди этих исследований было выполнено 18 двойных слепых исследований; 136 исследований, проведенных с целью оценки
3 групп критериев (субъективных, клинических и биохимических); 42 исследования, дополнительно оценивавших гистологические признаки; 4 исследования, в которых были использованы дополнительно ко всем перечисленным выше критериям электронно-микроскопические признаки, 15 исследований были выполнены с участием детей. Продолжительность лечения составила от нескольких недель при внутривенном введении до 5 лет при пероральном приеме. Основные показания к лечению ЭФЛ: острый вирусный гепатит, хронический гепатит, жировая дистрофия печени, токсическое повреждение печени и цирроз печени [7].
Для понимания механизма защитного действия фосфолипидов (ФЛ) следует учитывать, что они являются главными компонентами клеточных мембран и мембран клеточных органелл. Все клеточные мембраны имеют универсальное строение и в среднем на 65 % состоят из ФЛ. ЭФЛ вместе с холестерином обусловливают текучесть мембран, при этом, чем выше уровень ЭФЛ, тем выше мембранная текучесть [1]. Попадая в организм, фосфатидилхолин восстанавливает целостность мембран пораженных клеток печени и активирует расположенные в мембране фосфолипидзависимые ферменты, тем самым нормализуя проницаемость и усиливая дезинтоксикационный и экскреторный потенциал клеток печени. ФЛ создают достаточно стойкие двуслойные мембранные структуры, в то же время обладающие необходимой текучестью и обеспечивающие нормальную работу белковых мембранных структур [8, 20].
ЭФЛ, применяемые в медицинской практике (экзогенные ФЛ), по своему строению близки эндогенным ФЛ, однако превосходят их по действию благодаря высокому содержанию полиненасыщенных жирных кислот (> 70 %) [21]: восстанавливают структуры мембран гепатоцитов и ингибируют перекисное окисление липидов.
Исследования последних лет продемонстрировали положительный эффект ЭФЛ, направленный на коррекцию жирового обмена и окисления ЛПНП. Так, в клинических исследованиях получены положительные результаты использования ЭФЛ для уменьшения уровня гиперхолестеринемии и гипертриглицеридемии у больных СД [15, 16]. Обнадеживающие результаты были получены при применении ЭФЛ больными ишемической болезнью сердца (ИБС) на фоне инсулинозависимого СД, а также пациентами с ИБС при некорригируемой диете [14,17].
Нормализующее влияние ЭФЛ на состав клеточных мембран проявляется снижением вязкости мембран, улучшением функции рецепторов, в т. ч. инсулиновых; увеличением активности липопротеинлипазы, повышающей внутрисосудистое расщепление хиломикронов и ЛПОНП, и наконец увеличением активности лецитин-холестеринацилтрансферазы, участвующей в эстерификации холестерина в составе ЛПВП [23].
Биосинтез эндогенных ФЛ наиболее интенсивно происходит в печени, легочной ткани, стенке кишечника, половых железах и молочной железе. Необходимо отметить, что эти органы являются местом наибольшего повреждения при оксидативном стрессе. Взаимопревращение ФЛ (фосфатидилсерин → в фосфатидилэтаноламин → в фосфатидилхолин) создает возможность обновления ФЛ и осуществляется путем декарбоксилирования и метилирования. Синтез фосфатидилхолина происходит из фосфатидилэтаноламина путем последовательных реакций метилирования. Это означает, что для синтеза необходимы метильные группы, следовательно, донаторы метильных групп, такие как метионин, могут способствовать усилению реакций синтеза ФЛ.
Метионин является классическим донатором подвижных метильных групп, необходимых для синтеза холина. В то же время метионин – незаменимая аминокислота, которая не синтезируется в организме человека и поступает в составе белков пищи, являясь жизненно необходимой [9, 10].
Увеличение содержания холина способствует увеличению синтеза эндогенных ФЛ и уменьшению отложения в печени нейтрального жира. Недостаточность холина и метионина ведет к развитию жирового перерождения печени у экспериментальных животных. Не имеется строгих доказательств развития холиновой недостаточности у человека, вероятно, не только потому, что холин хорошо синтезируется в организме при наличии доноров метильных групп, но и потому, что многие пищевые продукты содержат значительное количество холина [26].
Метионин участвует в обмене серосодержащих аминокислот, в синтезе адреналина, креатинина и других биологически активных соединений, преобразует действие гормонов, витаминов (В12, аскорбиновой, фолиевой кислот), ферментов, белков, участвует в реакциях переметилирования, дезаминирования, декарбоксилирования [27].
 Метионин и ФЛ усиливают действие друг друга, являясь источником эндогенных и экзогенных ФЛ, а следовательно, улучшают функциональное состояние клеток печени и оказывают гепатопротекторный эффект. Кроме того, метионинзависимое метилирование ФЛ усиливает поляризацию мембран, вызывает непрерывный переход ФЛ с внутренней части бислоя мембран на внешний, что увеличивает текучесть мембран гепатоцитов – ключевой фактор регуляции образования желчи. Нарушение транссульфурирования метионина приводит к дефициту глутатиона – эндогенного пептида, выполняющего роль важнейшего внутриклеточного детоксицирующего агента. Недостаточность глутатиона снижает устойчивость печени к повреждающему действию свободных радикалов, других гепатотоксичных воздействий. Когда количество новообразованных свободных радикалов превышает нейтрализующую способность глутатиона, повреждаются клетки печени, при этом применение метионина способствует ликвидации дефицита глутатиона. Метионин, являясь активным участником II фазы метаболического процесса, необходим для обезвреживания ксенобиотиков [3].
Метионин и ФЛ усиливают действие друг друга, являясь источником эндогенных и экзогенных ФЛ, а следовательно, улучшают функциональное состояние клеток печени и оказывают гепатопротекторный эффект. Кроме того, метионинзависимое метилирование ФЛ усиливает поляризацию мембран, вызывает непрерывный переход ФЛ с внутренней части бислоя мембран на внешний, что увеличивает текучесть мембран гепатоцитов – ключевой фактор регуляции образования желчи. Нарушение транссульфурирования метионина приводит к дефициту глутатиона – эндогенного пептида, выполняющего роль важнейшего внутриклеточного детоксицирующего агента. Недостаточность глутатиона снижает устойчивость печени к повреждающему действию свободных радикалов, других гепатотоксичных воздействий. Когда количество новообразованных свободных радикалов превышает нейтрализующую способность глутатиона, повреждаются клетки печени, при этом применение метионина способствует ликвидации дефицита глутатиона. Метионин, являясь активным участником II фазы метаболического процесса, необходим для обезвреживания ксенобиотиков [3].
Особенностью архитектоники печени является образование гепатоцитами ацинусов, разделенных на три функциональные зоны, ось которых формируется веточками воротной вены, печеночной артерии и желчным протоком. Клетки третьей зоны ответственны за метаболизм и выведение ЛП. Расположенные в околоцентральной области вокруг терминальной печеночной вены и наиболее удаленные от печеночной артерии, эти клетки получают меньшее количество кислорода, а следовательно, воздействие гепатотоксичных препаратов усугубляет этот процесс и приводит к некрозу гепатоцитов третьей зоны [4]. Применение препаратов, которые содержат ЭФЛ, являющиеся источником структурных элементов клеточных мембран, оказывает в этих условиях подавляющий эффект на первичные или вторичные механизмы развития патологического процесса [5, 8].
Анализ литературных источников позволяет сделать важный в практическом плане вывод: назначение ФЛ необходимо выполнять одновременно с коферментами – участниками перечисленных выше реакций.
Одним из таких ЛП является Эслидин® – комбинированный препарат, содержащий в своем составе в качестве активных компонентов ЭФЛ липоид ППЛ-400 300 мг (в пересчете на 100 %-ное содержание полиненасыщенных ФЛ из соевого лецитина – фракция PPL) и метионин 100 мг.
В РФ Эслидин® разрешен к медицинскому применению с 2008 г. в качестве гепатопротекторного средства. Препарат обладает многофункциональной активностью, благодаря которой он применяется в гепатологии при жировой дистрофии печени различной этиологии; гепатите и циррозе печени; токсическом поражении печени алкогольной, наркотической и лекарственной этиологии; вторичных нарушениях функции гепатоцитов.
Эффективность и безопасность препарата при НАСГ были изучены в клиническом исследовании. НАСГ – самостоятельное заболевание, для которого характерно повышение активности ферментов печени в крови и морфологические изменения в биоптатах печени, подобные изменениям при алкогольном гепатите; однако пациенты с НАСГ не употребляют алкоголь в количествах, способных вызывать повреждение печени.
В исследовании приняли участие 80 пациентов (27 мужчин, 53 женщины) в возрасте от 21 до 66 лет, средний возраст – 45,5 + 10,4 года (M ± SD), с верифицированным диагнозом неалкогольной болезни печени. Не включали пациентов, принимавших гепатотоксичные препараты, имевших маркеры вирусных гепатитов в сыворотке крови, больных циррозом печени, пациентов с НАСГ в стадии фиброза.
Исследование эффективности и безопасности Эслидина по сравнению с Эссенциале форте Н было проведено на кафедре госпитальной терапии РГМУ (Москва) и кафедре госпитальной терапии КГМУ (Казань).
Включенными в исследование пациентами были в основном (67 %) женщины в возрасте незначительно старше 40 лет; большинство (86,25 %) пациентов страдали избыточной массой тела или ожирением. У 42 (52,50 %) пациентов был повышен уровень липидов крови. У 6 (7,5 %) человек в анамнезе был СД 2 типа. Основными проявлениями НАСГ были умеренная гепатомегалия и двух-, трехкратное увеличение уровня трансаминаз.
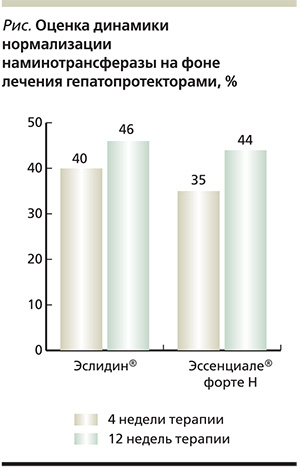
Проведенное клиническое сравнительное исследование эффективности и переносимости препаратов Эслидин® и Эссенциале форте Н при 12-недельном применении больными НАСГ показало, что применение препарата Эслидин® в терапии НАСГ вызывает клинико-лабораторное улучшение, включая снижение уровня трансаминаз (см. рисунок). Также было отмечено уменьшение размеров печени при гепатомегалии, снижение частоты выявления болевого и астенического синдромов, улучшение качества жизни пациентов, сопоставимые с препаратом сравнения.
На фоне терапии Эслидином® положительные результаты терапии были зафиксированы у 92,5 % пациентов, что, несомненно, является выраженным фармакодинамическим эффектом. В группе сравнения положительный эффект отмечен у 67,5 % пациентов.
Важным положительным моментом исследования следует считать отсутствие влияния исследуемого препарата Эслидин® на электролитный состав крови.
Отсутствие значимых побочных эффектов, аллергических реакций и статистически достоверных изменений клинических параметров крови и мочи у пациентов обеих групп за время наблюдения свидетельствует о хорошей переносимости и безопасности исследуемых препаратов.
Фармакотерапия коморбидных состояний требует курсового применения ЛП различных фармакотерапевтических групп, часто – назначения пяти и более ЛП одновременно, что приводит к развитию нежелательных лекарственных реакций и полипрагмазии. Врачи общей практики отмечают значительное увеличение гепатотоксического действия ЛП различных фармакологических групп (салицилатов, антибиотиков, диуретиков, антиаритмических, противотуберкулезных и др.). Необходимо отметить отсутствие строгих морфологических или специфических клинических критериев, позволяющих выделить особенности воздействия различных ЛП, что обусловливает необходимость исключения лекарственного поражения печени при любых изменениях печеночных проб. При этом защитное действие комбинации ФЛ с метионином обусловлено в т. ч. процессами метилирования токсичных промежуточных продуктов на уровне II фазы детоксикации ксенобиотиков, а также предупреждением снижения уровня внутриклеточного глутатиона и повышением концентрации тиолов в реакциях транссульфурирования. Это способствует предотвращению накопления токсичных метаболитов, что особенно важно при лекарственных поражениях печени.
Все вышеизложенное убедительно демонстрирует, что комбинация ФЛ с метионином имеет ряд особенностей и преимуществ перед имеющимися в арсенале практикующего врача ЛП, содержащими в качестве активного вещества ЭФЛ.
С учетом комплексного состава Эслидина, важной роли метионина во всех детоксицирующих процессах в организме применение препарата актуально для больных не только с метаболическими нарушениями, но и при токсических поражениях печени – алкогольном, наркотическом, лекарственном. Жировая дистрофия печени требует адекватной коррекции, поэтому в состав комплексной терапии МС, СД целесообразно дополнительно включать антиоксиданты и гепатопротекторы. Таким образом, применение Эслидина в качестве гепатопротектора при различных метаболических нарушениях является обоснованным с точки зрения механизмов патогенеза данной патологии. Важным фактором является отсутствие выраженной токсичности у препаратов этой группы и небольшое число побочных эффектов даже при грубом поражении паренхимы печени.
В лечении МС, гиперлипидемий, атеросклероза, ожирения, НАСГ в последние годы достигнут большой прогресс. Совершен ряд фундаментальных открытий, позволивших разработать принципиально новые фармакологические подходы к лечению данных состояний. При этом возрастает роль препаратов, которые обладают достоверным гепатопротекторным действием, повышают безопасность проводимой фармакотерапии.
К их числу относится комплексный препарат Экслидин®, содержащий ЭФЛ и метионин, что положительно влияет на ведущие метаболические процессы в организме, способствует уменьшению воспалительного процесса, замедлению развития фиброза, улучшению прогноза больных с коморбидной патологией, улучшению качества жизни пациентов.



