В2015 г. ВОЗ представила Доклад о старении и здоровье, согласно которому в мире неуклонно увеличивается доля пожилого населения, и в большинстве ситуаций ожидаемая продолжительность жизни составляет 60 лет и более [1, 2]. Происходящее закономерно диктует важность модификации национальных систем здравоохранения для их адаптации к потребностям лиц старших возрастных групп, а также определяет необходимость разработки на основании доказательной базы данных специализированных рекомендаций по социально значимым заболеваниям у лиц пожилого возраста [1].
Одной из глобальных проблем XXI в. стала нарастающая повсеместная распространенность сахарного диабета (СД), при этом старшая возрастная группа населения оказывается в зоне высокого риска по этому заболеванию. Так, по официальным данным, в 2010 г. в Корее и США каждый 4-й житель ≥65 лет страдал СД [3]. По результатам первого национального эпидемиологического кросс-секционного исследования NATION, проведенного на территории Российской Федерации с сентября 2013 по февраль 2015 г., у лиц в возрасте 65–69 лет отмечена наиболее высокая частота развития СД 2 типа (СД2) и его распространенность, приблизившаяся к 14% [4]. Очевидно, что у пожилых пациентов клиническая ситуация в подавляющем большинстве случаев не ограничивается рамками гипергликемии и ее микрососудистых осложнений. Для больных старших возрастных групп характерны высокая распространенность заболеваний сердечно-сосудистой системы, склонность к возникновению депрессий и снижению когнитивных функций, тенденция к развитию мышечной слабости, остеопении, повышению рисков падений и переломов и в целом – полиморбидность [3–9].
Важнейшей социально-экономической проблемой остается высокая сердечно-сосудистая заболеваемость и смертность пациентов с СД2, несмотря на разработанный и активно внедряемый в последние десятилетия комплексный подход к контролю над заболеванием, включивший коррекцию не только гипергликемии, но и других факторов кардиоваскулярного риска, таких как дислипидемия и артериальная гипертензия. Согласно данным E.W. Gregg и соавт., в настоящее время сердечно-сосудистые риски для этой категории больных все еще выше общепопуляционных: относительный риск (ОР) составляет 1,8 (95% доверительный интервал [ДИ] – 1,3–2,3) для острого инфаркта миокарда и 1,5 (95% ДИ – 1,1–2,0) – для инсульта [10]. Неблагоприятный вклад в сердечно-сосудистую заболеваемость и смертность может вносить увеличение частоты гипогликемий, возникающих как потенциальная «плата» за интенсивный гликемический контроль [11–13] или как нежелательный эффект от применения определенных групп сахароснижающих препаратов [14]. При этом результатами крупных клинических исследований подтверждается также и самостоятельное значение возраста как фактора риска гипогликемий у пациентов старших возрастных групп с СД2 [15–17], что обусловлено снижением чувствительности к распознаванию вегетативных и нейрогликопенических симптомов [18, 19]. Очевидно, что для пожилых больных СД2 минимизация риска гипогликемий рассматривается как важнейший критерий безопасности проводимой терапии.
Таким образом, в настоящее время ряд крупных медицинских сообществ, включая Международную федерацию сахарного диабета (IDF), Японское общество геронтологов (JGS), Американскую диабетологическую ассоциацию (ADA) и Американское общество геронтологов (AGS), а также Российскую ассоциацию эндокринологов (РАЭ), выражают единое мнение в отношении необходимости максимальной безопасности проводимой сахароснижающей терапии (ССТ) с установкой индивидуальных целей, исходя из конкретной клинической ситуации [7, 8, 20, 21] (табл. 1).

Сочетание доказанной эффективности и безопасности, а также отсутствие значимого влияния на вес и приемлемая стоимость позволяют метформину при нормальной переносимости и отсутствии известных противопоказаний оставаться на первой линии ССТ, в т.ч. у пациентов старших возрастных групп [8, 12, 21]. Однако случаи непереносимости метформина или наличия противопоказаний к его применению, необходимость оптимизации гликемического контроля определяют потребность в новых терапевтических решениях. Начало XXI в. ознаменовалось появлением принципиально нового класса сахароснижающих препаратов с уникальным механизмом действия и оптимальным сочетанием безопасности, эффективности и переносимости – группы ингибиторов дипептидилпептидазы 4-го типа (ДПП-4) [22]. Одним из ее представителей является алоглиптин (Випидия, компания Takeda).
Применение алоглиптина в пожилом и старческом возрасте
В плане применения данного препарата для пациентов старших возрастных групп особый интерес представляет проведенный R.E. Pratley и соавт. обобщенный анализ серии клинических исследований. Целью работы стала сравнительная оценка эффективности и безопасности терапии алоглиптином для лиц старше и моложе 65 лет [19]. В анализ вошли 6 рандомизированных двойных слепых плацебо-контролируемых исследований, в которых алоглиптин применялся пациентами с СД2 в возрасте от 18 до 80 лет. Из 6 изучаемых работ 1 относилась ко II, 5 – к III фазам клинических испытаний, при этом основные критерии включения в них были в целом сопоставимыми (табл. 2).
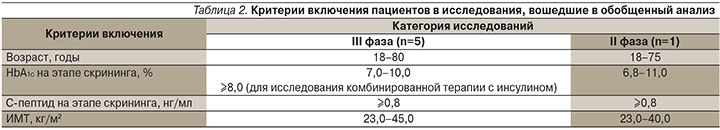
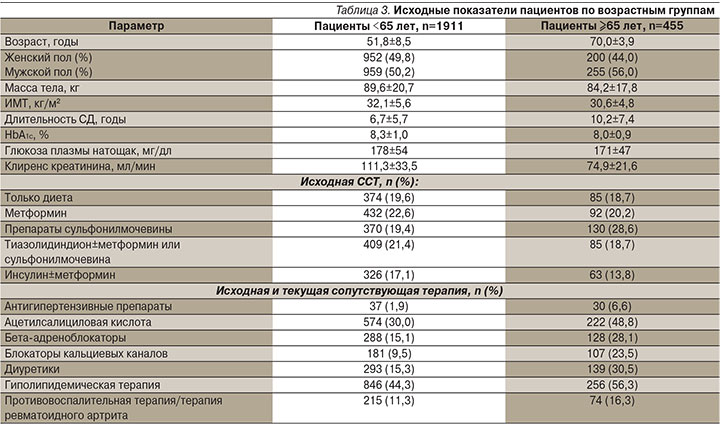
Всего в 6 исследованиях приняли участие 2366 больных СД2, из них 1911 пациентов были моложе 65 лет и 455 относились к категории ≥65 лет. В целом пациенты обеих возрастных групп были сопоставимыми по исходным характеристикам за исключением большей длительности СД и меньших исходных значений массы тела, индекса массы тела (ИМТ) и клиренса креатинина у пожилых больных (табл. 3).
В обеих возрастных группах преобладали пациенты белой расы (более 70%). Исходно и на протяжении исследования в отношении пациентов старшей возрастной группы ожидаемо чаще применялись различные классы сопутствующей терапии.
В исследованиях III фазы продолжительностью по 26 недель алоглиптин применялся в дозах 12,5 или 25 мг/сут в качестве монотерапии (1 работа) или в комбинации с исходной ССТ (метформин, глибенкламид, пиоглитазон или инсулин) по сравнению с плацебо. В 12-недельном плацебо-контролируемом исследовании II фазы оценивалась монотерапия алоглиптином в дозах 6,25, 12,5, 25, 50 или 100 мг/сут.
Эффективность терапии оценивалась по динамике значений гликированного гемоглобина и глюкозы плазмы натощак (ГПН), дополнительно анализировались масса тела и показатели липидного профиля. Безопасность терапии оценивалась по частоте развития гипогликемий, нежелательных явлений и изменениям артериального давления.
Бо́льшее число пациентов старшей возрастной группы по сравнению с лицами моложе 65 лет благополучно завершили все этапы исследования: 150 (85,7%) против 552 (73,9%) человек из рандомизированных в группу алоглиптина 12,5 мг/сут и 142 (81,1%) против 547 (74,4%) человек из рандомизированных в группу алоглиптина 25 мг/сут. При этом необходимость назначения дополнительной ССТ в связи с сохраняющимися неудовлетворительными показателями гликемии у пожилых больных возникала достоверно реже: 12 (6,9%) против 102 (13,7%) человек группы алоглиптина 12,5 мг/сут и 12 (6,9%) против 97 (13,2%) – группы алоглиптина 25 мг/сут.
В обеих возрастных группах терапия алоглиптином достоверно улучшала гликемический контроль по сравнению с плацебо (р<0,001). Степень снижения НbА1с у пациентов моложе и старше 65 лет, получавших алоглиптин в дозах 12,5 или 25 мг/сут, статистически значимо не различалась, хотя в абсолютных цифрах выраженность снижения была больше у лиц старшего возраста. Аналогическая закономерность, но без достоверных различий по возрастным группам (р>0,05) наблюдалась и по показателям ГПН у пациентов, принимавших алоглиптин 12,5 или 25 мг/сут. В целом значимо бо́льшее число пациентов старшего возраста, рандомизированных в группу алоглиптина, смогли достичь к 26-й неделе терапии уровня НbА1с ≤7,0% (табл. 4).
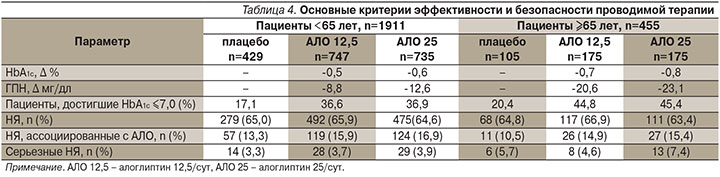
В целом в обеих возрастных группах пациентов, получавших алоглиптин 12,5 или 25 мг в сутки, за период 26-недельной терапии частота возникновения гипогликемий была ≤8,3%, при этом подавляющим большинством (около 80%) из этих больных алоглиптин применялся в комбинации с глибуридом или инсулином. Интересным представляется факт, что бо́льшая частота гипогликемий у пациентов старше 65 лет была зарегистрирована в подгруппе плацебо. Это позволило R.E. Pratley и соавт. сделать вывод о том, что добавление алоглиптина к исходной ССТ пожилых пациентов ассоциировалось с улучшением гликемического контроля без достоверного повышения риска гипогликемий.
Нежелательные явления (НЯ), регистрировавшиеся во всех анализируемых клинических исследованиях, достоверно не различались между возрастными группами и различными вариантами терапии по структуре и частоте, которая варьировалась от 63,4 до 66,9% (табл. 4). Аналогичным образом не было значимых различий в отношении НЯ, ассоциированных, по мнению исследователей, с приемом алоглиптина. В целом наиболее частыми НЯ являлись инфекции мочевыводящих и дыхательных путей, назофарингит, головная боль и диарея. Серьезные НЯ у пожилых пациентов развивались несколько чаще, чем у лиц моложе 65 лет, однако данная закономерность отмечена в равной степени в подгруппе как алоглиптина, так и плацебо, что, наиболее вероятно, отражает вклад полиморбидности в данное явление.
При этом лишь в двух случаях, по мнению исследователей, серьезные НЯ могли быть связаны с применением алоглиптина. Значения массы тела, показателей липидного профиля и артериального давления, а также клиренса креатинина не продемонстрировали существенной динамики к 26-й неделе лечения и значимо не различались между разными возрастными категориями больных и группами терапии.
Таким образом, по итогам обобщенного анализа R.E. Pratley и соавт. пришли к заключению, что применение алоглиптина пациентами пожилого возраста характеризуется сопоставимой с более молодыми пациентами эффективностью при сохранении сходного благоприятного профиля безопасности.
Отдельного внимания заслуживает 52-недельное рандомизированное двойное слепое активно контролируемое исследование J. Rosenstock и соавт. по сравнению эффективности и безопасности алоглиптина 25 мг/сут (n=222) и глипизида 5–10 мг/сут (n=219) в качестве монотерапии пациентов 65–90 лет с неудовлетворительным контролем гликемии (среднее значение HbA1с – 7,5%) на фоне диеты. Итоги работы продемонстрировали равноценную эффективность изучавшихся режимов ССТ (∆ HbA1с к концу наблюдения составила -0,42% в группе алоглиптина и -0,33% в группе глипизида), но преимущество алоглиптина в отношении безопасности в связи с меньшей частотой развития гипогликемий (5,4 против 26,0%) и динамики массы тела: применение алоглиптина ассоциировалось с умеренным снижением массы тела (-0,62 кг), в то время как на фоне глипизида отмечено небольшое ее увеличение (+0,6 кг; р<0,001) [23].
Алоглиптин и кардиоваскулярная безопасность
Многофакторный генез СД2 и прогрессирующий характер заболевания определяют долгосрочность и комплексность ССТ, что наряду с пролонгированной эффективностью диктует необходимость уверенности в безопасности проводимой терапии в отдаленной перспективе, в т.ч. относительно кардиоваскулярных событий, распространенность и социально-экономическая значимость которых у пациентов пожилого возраста чрезвычайно высоки. Согласно современным требованиям (регламент FDA, 2008; регламент EMA, 2012), безопасный кардиологический профиль лекарственного средства является необходимым условием для возможности его применения данной категорией больных [24].
В связи с этим пристального внимания заслуживает крупное многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование кардиоваскулярной безопасности алоглиптина для больных СД2 – EXAMINE (Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care), завершившееся в 2013 г. [26].
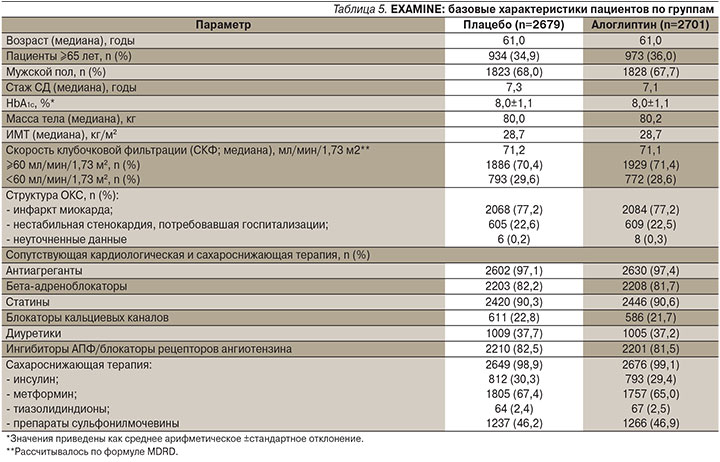
Особенностью дизайна EXAMINE было участие больных СД2 с очень высоким сердечно-сосудистым риском: в исследование включены лица с диабетом старше 18 лет, перенесшие острый коронарный синдром (ОКС – острый инфаркт миокарда или госпитализация по причине нестабильной стенокардии) за 15–90 дней до рандомизации и получавшие любую ССТ, за исключением аналогов глюкагоноподобного пептида-1 и ингибиторов ДПП-4. В исследование были рандомизированы 5380 человек, длительность наблюдения достигла 40 месяцев (медиана – 18 месяцев), медиана продолжительности приема алоглиптина составила 533 дня (интерквартильный размах – 280–751 день). К исходной ССТ в двойном слепом режиме добавлен алоглиптин (n=2 701) или плацебо (n=2679), при этом кардиоваскулярную терапию обе группы продолжали получать в соответствии с локальными рекомендациями. По исходным параметрам – таким, как пол, этническая принадлежность, возраст, длительность СД, факторы сердечно-сосудистого риска и соотношение форм ОКС, состояние азотвыделительной функции почек, а также по сопутствующей ССТ и кардиальной терапии группы достоверно не различались (р >0,05) (табл. 5).
Принимая во внимание почечный путь элиминации, доза алоглиптина, равно как и плацебо, корректировалась в период исследования: 6,25 мг/сут – при СКФ (формула MDRD) <30 мл/мин/1,73 м2; 12,5 мг/сут – при СКФ 30–60 мл/мин/1,73 м2; 25 мг/сут – при СКФ ≥60 мл/мин/1,73 м2.
Наряду с достоверной эффективностью алоглиптина в отношении гликемического контроля (∆ НbА1с по сравнению с исходным -0,33 против +0,03% для алоглиптина и плацебо соответственно; р <0,001), результаты EXAMINE продемонстрировали его кардиологическую безопасность для больных СД2 с очень высоким риском сердечно-сосудистых заболеваний: частота развития событий первичной конечной точки (смерть от кардиоваскулярных причин, нефатальный инфаркт миокарда, нефатальный инсульт) в группе алоглиптина составила 11,3% (305 событий) и была сопоставимой с таковой в группе плацебо – 11,8% (316 событий) при ОР – 0,96 с верхней границей одностороннего ДИ – 1,16. Анализ комбинации событий первичной конечной точки и экстренной реваскуляризации в связи с нестабильной стенокардией (основная вторичная конечная точка) также не показал достоверных различий между группами алоглиптина и плацебо (12,7 и 13,4% соответственно, ОР – 0,95, верхний предел одностороннего ДИ – 1,14). Результаты подгруппового анализа данных больных СД2 с недавно перенесенным ОКС без декомпенсированной сердечной недостаточности, а также с сердечной недостаточностью в анамнезе и/или с повышенным уровнем мозгового натрийуретического пептида показали, что кумулятивная частота смерти от сердечно-сосудистых причин и госпитализаций по поводу сердечной недостаточности в группе алоглиптина была сопоставимой с таковой в группе плацебо (ОР – 0,98; 95% ДИ – 0,82–1,21). Таким образом, результаты EXAMINE продемонстрировали высокую кардиологическую безопасность алоглиптина для больных СД2, недавно перенесших ОКС, т.е. у пациентов с очень высоким кардиоваскулярным риском. И хотя в данной масштабной работе не проводилось отдельного подгруппового анализа для пациентов пожилого и старческого возраста, необходимо отметить, что более 30% выборки было представлено лицами старше 65 лет [25].
Алоглиптин и межлекарственные взаимодействия
В контексте ССТ у пожилых больных СД2 феномен полиморбидности и ассоциированная с ним полипрагмазия приобретают особое звучание. Широкий спектр сопутствующей терапии пациентов старших возрастных групп требует от клинициста очень взвешенного и осторожного подхода к выбору сахароснижающего препарата, в т.ч. с учетом возможных фармакокинетических взаимодействий. Результаты проведенных исследований свидетельствуют, что алоглиптин не оказывает клинически значимого влияния на фармакокинетику метформина, глибенкламида, толбутамида, пиоглитазона, циметидина, аторвастатина, гемфиброзила, дигоксина, варфарина, флуконазола, кетоконазола, циклоспорина, мидазолама, этинилэстрадиола, норэтиндрона, декстрометорфана, фенсофенадина, в связи с чем коррекции дозы указанных препаратов при их сочетанном применении не требуется [26]. Для алоглиптина, кроме того, характерны быстрое и практически полное всасывание, отсутствие значимого влияния приема пищи на время достижения и величину максимальной концентрации препарата в плазме, незначительное связывание с белками плазмы, минимальная склонность к аккумуляции, а также продолжительность действия, позволяющая назначать препарат 1 раз в сутки, что в совокупности обеспечивает благоприятный фармакокинетический профиль препарата. Это, без сомнения, создает для пожилого пациента дополнительные преимущества [27, 28].
Алоглиптин и риски переломов
Нарушение метаболизма костной ткани, развивающееся при СД2, ассоциируется с остеопорозом. Несмотря на отсутствие значимого снижения минеральной плотности костной ткани, а нередко и ее повышение, у пациентов с СД2 риск переломов практически вдвое выше общепопуляционного [29]. Не менее значимы для развития остеопороза при СД2 и традиционные факторы риска, одним из которых является возраст: старение ассоциируется с увеличением частоты падений, гиподинамией, снижением почечной функции и нередко – необходимостью проведения лекарственной терапии, неблагоприятно влияющей на метаболизм костной ткани [30]. Тяжелые социально-экономические последствия остеопороза и его осложнений определяют необходимость разработки комплексного подхода к его лечению и профилактике, в т.ч. выбор предельно щадящей в отношении костного метаболизма медикаментозной терапии сопутствующей патологии. Характер влияния терапии алоглиптином на риск переломов у пациентов с СД2 был продемонстрирован в мета-анализе J. Fu и соавт. [31]. В работу вошли 7 клинических исследований с применением алоглиптина продолжительностью от 26 недель до 40 месяцев. Средний возраст участников варьировался от 53,5 до 69,9 года, средний уровень НbА1с составил 7,6–8,6%.
В группы активного лечения (алоглиптин 12,5 или 25 мг/сут) были включены 6972 пациента, в группы контроля (плацебо и/или пиоглитазон, глипизид, метформин) – 5113 больных. По итогам анализа было зарегистрировано 53 перелома в основной группе и 61 – в группе контроля, при этом ОР развития перелома составил 0,79 (95% ДИ – 0,55–1,14; р>0,05). Таким образом, результаты данной работы показали отсутствие влияния терапии алоглиптином на риск развития переломов у пациентов с СД2.
Заключение
В начале третьего тысячелетия с развитием научно-технического прогресса и значительным увеличением ожидаемой продолжительности жизни лавинообразно нарастает распространенность СД2, в т.ч. среди лиц старших возрастных групп, причем кардиоваскулярная патология остается одной из лидирующих причин смерти. Закономерно повышаются требования к ССТ, которая должна быть патогенетически обоснованной и удобной в применении, устойчиво эффективной и безопасной по гликемическому и кардиологическому профилю, обладать хорошей переносимостью и быть нейтральной относительно массы тела. В условиях высокой распространенности полиморбидности и полипрагмазии дополнительным преимуществом препарата может быть минимальная склонность к межлекарственным взаимодействиям и неблагоприятным негликемическим эффектам Алоглиптин, прошедший серию крупных клинических испытаний, включивших в общей сложности более 14 тыс. больных СД2, в т.ч. пожилых пациентов и лиц с очень высоким сердечно-сосудистым риском, вполне удовлетворяет приведенным требованиям и может быть рекомендован как надежное средство в борьбе с СД2.



