Введение
Антигистаминные препараты (АГП) имеют более чем 70-летнюю историю применения в медицине. Вначале были синтезированы Н1-блокаторы (H1R) и т.н. АГП 1-го поколения, которые до сих пор находят применение – главным образом благодаря их парентеральной форме при острых аллергических реакциях. За это время было открыто еще несколько типов гистаминовых рецепторов, среди которых, возможно, рецепторы 4-го типа могут играть более значимую роль в индукции зуда, чем H1R.
По сравнению с классическими АГП первого поколения на сегодня именно антагонисты H1R 2-го поколения являются препаратом выбора. Хотя их фармакологические эффекты и показания к применению аналогичны, АГП 2-го поколения имеют меньше побочных эффектов из-за высокой селективности к периферическим H1R [1]. Это обусловливает их безопасность и отсутствие седативного эффекта, м-холиноблокирующего действия, взаимодействия с цитохромом Р-450 печени и влияния на интервал QT [2, 3].
Если использование АГП с позиций доказательной медицины обоснованно в лечении крапивницы (острой, хронической), в т.ч. увеличенными дозами, то в контексте лечения других заболеваний они не являются препаратом первого выбора [1–3]. Тем не менее противозудное действие АГП – основное показание к их назначению при различных аллергических состояниях у детей и взрослых, а также некоторых инфекциях кожи [1–4]. Как показывает анализ последних научных публикаций, область применения АГП в педиатрической практике расширилась: в качестве дополнительной терапии их рекомендуют назначать при синдроме аллергического энтероколита, индуцированного пищевыми белками; гастроинтестинальной форме пищевой аллергии, а также при аллергии к белкам коровьего молока [3–6].
Несмотря на то что данные об эффективности системных АГП при зуде у детей раннего возраста ограничены, среди АГП 1-го поколения диметиндена малеат одобрен к применению в отношении детей с 1-го месяца жизни. Это связано с высокой безопасностью препарата: минимальным мускариновым и седативным эффектами и отсутствием кардиотоксичности [5].
Данный обзор дает представление об основных показаниях к назначению АГП детям, в т.ч. раннего возраста.
Противозудный эффект АГП
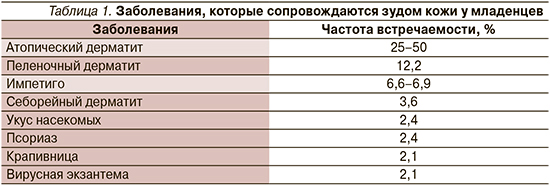
Заболевания, при которых допускается назначение АГП, у детей встречаются с разной частотой в зависимости от возрастных групп (табл. 1) [https://www-mdpi-com.translate. goog/2227-9059/9/8/919/htm?_x_tr_ sl=en&_x_tr_tl=ru&_x_tr_hl=ru – B78biomedicines-09-00919]. Как правило, это прежде всего различные дерматологические заболевания, а также острые неанафилактические аллергические реакции на пищу и лекарства, которые могут протекать в т.ч. с кожными проявлениями (крапивница, отек Квинке и т.п.).
Острая крапивница и аллергические реакции
Крапивница – внезапное появление зудящих волдырей, которые обычно исчезают в течение 24 часов, может быть острой (уртикарии сохраняются до 6 недель) и хронической (продолжительностью более 6 недель). Нередко у детей младшего возраста причиной крапивницы являются вирусные инфекции (если она не индуцирована участием IgE-опосредованных механизмов, например, как при пищевой аллергии) [6].
Анафилаксия – острый полисистемный синдром, который может быть опасен для жизни и требует срочного лечения. Различают разные степени тяжести анафилаксии, причем одним из ее главных проявлений является крапивница. Чаще всего анафилаксия опосредуется участием иммуноглобулина Е (IgE), когда внезапно тучные клетки высвобождают массу гистамина, а затем лейкотриенов (ЛтC4, ЛтD4 и ЛтE4). Как IgE, так и не-IgE активация тучных клеток и базофилов запускает каскад, который приводит к продукции других воспалительных и вазоактивных веществ: триптазы, гепарина, простагландинов (ПГD2, ПГF2), цитокинов (например, фактора некроза опухоли α – ФНО-α), фактора активации тромбоцитов и т.п. Эти вещества поражают многие органы и системы, однако тяжелые гипотензивные реакции, которые встречаются реже, могут быть опосредованы не-IgE-опосредованными механизмами тоже [7].
В целом, по заключению экспертов Европейской академии аллергологии и клинической иммунологии (EAACI – European Academy of Allergy and Clinical Immunology), диагноз анафилаксии высоковероятен при наличии таких основных критериев, как быстрота развития реакции (несколько минут – 2 часа) и вовлечение одного или нескольких органов и систем: кожи, дыхательных путей, желудочно-кишечного тракта, сердечно-сосудистой и нервной систем [8]. Следует отметить, что у младенцев симптомы анафилаксии могут быть едва различимыми и чаще всего проявляются рвотой, слюнотечением, бледностью и зудом кожи.
В случаях легкой анафилактической реакции, связанной, например, с пищевым продуктом, раннее введение перорального АГП (еще на догоспитальном этапе) может помочь контролировать реакцию и в дальнейшем снижать прогрессирование анафилаксии [4]. Несомненно, при лечении анафилаксии препаратом 1-й линии является адреналин, который вводят внутримышечно в передне-боковую область бедра (0,15 или 0,3 мл в зависимости от массы тела), тогда как АГП и глюкокортикостероиды вводят уже после адреналина. Применение Н1-блокаторов (клемастин, хлоропирамин, дифенгидрамин и др.) возможно только на фоне полной стабилизации гемодинамики и при наличии показаний. Рекомендуемые детям дозировки: для клемастина 0,1% 2 мл (2 мг) – 25 мкг/кг/сут внутримышечно (в/м), разделенных на 2 инъекции; хлоропирамина 2% 1 мл (20 мг) для внутривенного или в/м введения, лечение начинают с дозы 5 мг (0,25 мл) дифенгидрамина для ребенка с массой тела менее 35–40 кг 1 мг/кг, максимально – 50 мг [8].
Атопический дерматит
Атопический дерматит (АтД) почти в 50% случаев начинается в течение первых 6 месяцев жизни ребенка и часто проходит спонтанно, но может сохраняться и в зрелом возрасте. Как правило, кардинальными признаками данного хронического воспалительного заболевания являются сухость и зуд кожи.
Хотя зуд при АтД имеет сложный патогенез и связан с вовлечением многих медиаторов воспаления (цитокины: интерлейкин-4 [ИЛ-4, ИЛ-13, ИЛ-31, ИЛ-33] и тимический стромальный лимфопоэтин), нейротрофические факторы: фактор роста нервов, артемин), нейротрансмиттеры (ацетилхолин) и нейропептиды (вещество P), амины (гистамин, серотонин) также играют важную роль в поддержании цикла «царапины–кожный зуд». Кроме того, многие ингаляционные аллергены (пыльца, клещи домашней пыли, тараканы, Аspergillus spp., Рenicillium spp.) и некоторые пищевые продукты обладают протеазной активностью и способствуют поддержанию хронического воспаления в коже [9]. Доказано, что воздействие таких аллергенов окружающей среды, как пылевые клещи, пыльца, плесень, перхоть животных, может усугублять симптомы АтД и быть причиной его обострения [10].
Роль аллергии в иммунопатогенезе АтД точно не установлена, хотя он и описывается как аллергическое заболевание кожи. Возможно, аллергены являются триггером обострения заболевания и, скорее всего следствием текущего воспаления у генетически предрасположенных к атопии больных [10]. Действительно, около 80% больных АтД имеют повышенные уровни общего IgE в сыворотке крови и сенсибилизацию к нескольким антигенам, включая аллергены окружающей среды и микробы, колонизирующие кожу [11]. По данным C. Flohr et al., частота атопии среди детей с АтД колебалась от 47 до 75% в зависимости от возраста, когда был установлен диагноз заболевания и объем аллергологического обследования пациентов в амбулаторных или стационарных условиях [12]. Наиболее часто у детей встречается аллергия к белкам коровьего молока, яиц, пшеницы. Как показал недавний мета-анализ, уже в возрасте 3 месяцев у детей с АтД в 6 раз выше выявлялась сенсибилизация к пищевым аллергенам по сравнению с контрольной группой (отношение шансов=6,18; 95% доверительный интервал – 2,94–12,98; p<0,001) [13]. Кроме того, наиболее выраженная связь пищевой аллергии отмечалась при раннем начале АтД и особенно его тяжелом течении. Однако сывороточные уровни общего IgE не всегда коррелируют с тяжестью заболевания или коррелируют слабо [14]. О том, что IgE не является основной мишенью для лечения АтД, подтверждается отсутствием существенного терапевтического эффекта омализумаба. Также известно, что терапевтический ответ на дупилумаб не зависит от исходного уровня общего и/ или специфических IgE в сыворотке крови больных АтД [15].
Во многих национальных руководствах по АтД не рекомендовано без показаний регулярно использовать оральные АГП. Однако поскольку АГП 1-го поколения легко проникают через гематоэнцефалический барьер и тем самым оказывают седативный эффект, их часто используют для облегчения ночного зуда кожи, особенно у детей со средней и тяжелой формами АтД, сопровождающихся выраженным зудом. В руководстве по АтД, разработанном Национальным институтом здравоохранения Великобритании, детям со средним и тяжелым АтД, у которых отмечаются зуд кожи или крапивница, рекомендуется 1-месячный курс неседативных АГП [16]. Лечение может быть продолжено при успешном купировании симптомов заболевания до 3 месяцев и более. Детям с острым обострением атопического заболевания и нарушением сна рекомендовано назначение 7–14-дневного курса лечения уже АГП 1-го поколения [16]. В позиционном документе, разработанном европейскими дерматологами в 2007 г. (ETFAD – European Task force on Atopic Dermatitis), в целом АГП 1-го или 2-го поколений не рекомендуется использовать для лечения зуда при АтД, но их можно добавлять, если у пациента отмечается недостаточная эффективность стандартного лечения местными противовоспалительными препаратами (топические кортикостероиды и ингибиторы кальциневрина) на фоне увлажняющих средств [17].
Сегодня уже доказано, что лучший способ контролировать все аспекты АтД, включая зуд, – это увлажнение кожи, восстановление барьерной функции кожи и контроль кожного воспаления как в стадии обострения, так и с превентивной целью (проактивная противовоспалительная терапия) [17]. Это в свою очередь может приводить к предотвращению повторного обострения заболевания и уменьшению выраженности зуда кожи.
Одним из общих выводов недавно опубликованного Кокрановского обзора является отсутствие ясного ответа на вопрос: эффективны ли АГП в лечении АтД? [18]. Результаты метаанализа эксперты сочли ненадежными и предположили, что использование АГП следует изучать у пациентов с аллергической сопутствующей патологией, оцениваемой по сенсибилизации (известной как «атопическая» экзема).
Чесотка
Чесотка встречается в любом возрасте. Заболевание проявляется в виде папулезных высыпаний в области запястий, подмышечных складках, между пальцами и выраженным зудом кожи. У младенцев чаще отмечается поражение кожи лица и головы по сравнению с детьми старшего возраста и взрослыми. Сыпь может быть экзематозного характера, полиморфной (папулы, пузырьки, гнойные корочки, шелушение), нередко появляются пустулы в подошвенной области. Интересно отметить, что после успешного лечения у некоторых пациентов развиваются очень зудящие красновато-коричневые папулы без чесоточных клещей, т.н. постскабиозные гранулемы, которые поддаются лечению легкими местными кортикостероидами, в некоторых случаях достаточно использование эмолентов. Для купирования зуда кожи также дополнительно назначают АГП.
Ветряная оспа
Заболевание сопровождается повышением температуры, полиморфной сыпью (начиная от пятен и заканчивая везикулами, папулами, пустулами и корками), которые распространяются от кожи головы, слизистой оболочки полости рта до нижних конечностей. Для предотвращения вторичной инфекции кожи, особенно из-за выраженного зуда, показано назначение подсушивающих средств вместе с АГП, в тяжелых случаях – противовирусные препараты (ацикловир, фамцикловир или валацикловир). Описана эффективность диметиндена малеата в купировании зуда кожи у большинства таких детей [19]. С той же целью АГП показаны при кори и краснухе.
Есть относительно редко встречающиеся заболевания, которые клинически протекают с картиной тяжелого АтД и сопровождаются зудом кожи. Это такие наследственные заболевания, как генодерматозы (ихтиоз, синдром Нетертона), а также первичные иммунодефициты (например, синдром гипер-IgE).
Еще одна редкая патология – мастоцитоз, который у детей обычно проявляется мастоцитомой (одиночной) или пигментной крапивницей. Клинически для данного заболевания весьма характерен положительный признак Дарье: механическое раздражение кожи может приводить к покраснению кожи и образованию уртикарной сыпи и пузырей. Другие триггеры: экстремальная температура (жара, холод), физические нагрузки, пищевые продукты, лекарства и яд насекомых также способны вызывать дегрануляцию тучных клеток и в последующем зуд кожи. В таких случаях обоснованно назначение АГП. По сравнению со взрослыми у детей отмечается хороший прогноз заболевания.
Недавно описанный синдром – аллергический энтероколит, индуцированный пищевыми белками (FPIES – Food Protein Induced Enterocolitis Syndrome), может проявляться у новорожденных детей или в течение первого года жизни [20]. Описаны редкие случаи заболевания у младенцев, находящихся исключительно на грудном вскармливании. Различают острую и хроническую формы FPIES. Диагноз ставят на основании главного и трех или более малых критериев (табл. 2) [20]. Заболевание развивается чаще всего после приема коровьего молока или сои. В дальнейшем FPIES может трансформироваться в IgEопосредованную реакцию, что служит показанием к использованию АГП для контроля текущих симптомов наряду с исключением причинно-значимых продуктов.

По данным Т.Г. Маланичева и соавт., использование АГП, в частности диметиндена малеата, способствовало улучшению клинических проявлений пищевой аллергии к белкам коровьего молока у детей на фоне элиминации причинно-значимых аллергенов [21].
АГП, как правило, безопасны в использовании в детской практике. Однако для длительного применения показано использование АГП 2-го поколения.
Самым часто используемым АГП, лицензированным к применению в отношении детей в возрасте от 1 месяца, является диметиндена малеат. Его антигистаминный эффект начинает проявляться уже через 30 минут после приема внутрь и достигает максимальной выраженности в течение 5 часов. Препарат следует принимать не менее 3 раз в сутки. Рекомендованная суточная доза детям в возрасте от 1 месяца до 12 лет составляет 100 мкг/кг массы тела, или 2 капли на кг массы тела. Детям старше 12 лет и взрослым назначают 20–40 капель 3 раза в сутки. Противопоказано назначать препарат в следующих случаях: детям в возрасте до 1 месяца, особенно недоношенным, в I триместре беременности, в период лактации (грудного вскармливания). С осторожностью назначают препарат детям с эпилепсией, а также детям до 1 года, т.к. у них седативный эффект может сопровождаться эпизодами ночного апноэ.
Нельзя назначать диметиндена малеат взрослым, у которых диагностированы такие заболевания, как закрытоугольная глаукома, гиперплазия предстательной железы, бронхиальная астма. В любом возрасте прекращают прием АГП, если у больного отмечается повышенная чувствительность к его компонентам. Следует помнить, что макролидные антибиотики могут повышать концентрацию H(1)антигистаминов в плазме крови.
Имеющиеся на сегодня публикации подтверждают, что в будущем ученым предстоит более детально изучить эффективность и пользу использования АГП при других, кроме крапивницы, заболеваниях в сравнительных исследованиях.
Клинический случай
Самира М. 9 месяцев. Со слов мамы, у ребенка с 1-го месяца жизни появилась сухость кожи, в 5 месяцев присоединились высыпания на шее в виде покраснения и слабовыраженного зуда. Впервые обратились к аллергологу на консультацию в возрасте 8 месяцев с жалобами на единичные высыпания на ногах по типу пятен, сухость кожи, периодически отмечался зуд.
При опросе мама отрицала какиелибо острые аллергические реакции у ребенка на пищу (прикорм овощами, мясо, яйцо) и лекарства, но подозревала появление у нее насморка после контакта с кошкой.
На фоне применения дерматокосметических средств (очищение+ увлажнение кожи), короткого курса пимафукорта, а затем пимекролимуса у ребенка отмечена положительная динамика кожных проявлений. Повторно обратилась к аллергологу в 9 месяцев по направлению отоларинголога, который выявил бледность и отек слизистой оболочки носа. Мама отмечала явную ринорею при посещении дома бабушки в другом городе, у которой в квартире жила кошка, и улучшение у ребенка назальных симптомов (чихание, насморк) после приема диметиндена малеата.
Ребенок родился от 1-й беременности, протекавшей физиологически. Роды в срок естественным путем, оценка по шкале Апгар – 7–8 баллов. Масса при рождении – 4120 г, рост – 54 см. К груди приложен в первые 30 минут после родов, в дальнейшем физическое развитие по возрасту, прикорм с 5,5 месяца – овощное пюре (кабачок, морковь, картофель, цветная капуста). Вакцинирована по Национальному календарю. Аллергологический анамнез не отягощен. В связи с синусовой тахикардией (частота сердечных сокращений – 180) в 1 месяц ребенку проведена эхокардиография, при которой выявлен дефект межжелудочковой перегородки без клапанной патологии и перегрузки камер сердца. Физическое и психомоторное развитие ребенка по возрасту.
При первичном осмотре у аллерголога: кожные покровы сухие, на конечностях отмечаются единичные пятна с шелушением, на голове слабовыраженный себорейный дерматит. По внутренним органам патологические изменения не выявлены. Печень, селезенка при пальпации не увеличены. Стул регулярный. В общем анализе крови эозинофилия 6%; копрограмма и общий анализ мочи без патологии.
Определение уровней специфических IgЕ антител к пищевым и ингаляционным аллергенам по тест-системе Immulite показало повышение как общего IgЕ (56 МЕ/мл, референсное значение менее 15 МЕ/мл), так и специфических IgЕ антител к пищевым аллергенам (белок яиц – 34 МЕ/мл, желток – 2,6 МЕ/мл), а также к эпителию кошки (4,5 МЕ/мл, референсное значение менее 0,35 МЕ/мл). Сенсибилизации к смеси клещей домашней пыли, плесневым грибам, пшеничной муке и белкам коровьего молока не выявлено.
Таким образом, был выставлен диагноз «атопический дерматит, локальная форма легкой степени. Аллергический эпизодический ринит (контакт с кошкой)».
Аллергологом рекомендовано:
- продолжить наружную терапию кожи по принципу очищение+увлажнение кожи, затем противовоспалительная терапия (Элидел);
- диметиндена малеат 3–4 капли 3 раза в сутки 1 месяц;
- избегать контакта с причинно-значимыми аллергенами (в данном случае с домашним животным).
Хотя у ребенка была выявлена сенсибилизация на куриное яйцо, клинической значимости она не имела.
На момент последней консультации родители жалоб не предъявляют, состояние ребенка удовлетворительное, нервно-психическое и физическое развитие по возрасту. При осмотре кожные покровы чистые. У ребенка периодически отмечается чихание. В общем анализе крови патологических изменений не отмечено.
Обсуждение
У младенца с АтД клиническая картина возникла на фоне контакта с домашним животным, что подтверждают результаты лабораторных исследований и корреляция выявленной сенсибилизации с симптомами заболевания. По данным анамнеза, обострение ринита было тесно связано с посещением помещения, где находилась кошка. Интересно отметить, что у ребенка не отмечено наследственной отягощенности атопией.
На основе анамнеза болезни, обнаружения специфических IgE антител к эпителию кошки, эффективности АГП и хорошего клинического ответа на избегание контакта с подозреваемым аллергеном ребенку выставлен окончательный диагноз эпизодического аллергического ринита (АР).
Хорошо известно, что в амбулаторной практике бόльшую часть обращений к педиатру составляют дети с различными типами ринита. Особенно актуальна проблема ринитов у детей дошкольного возраста и в тех случаях, когда отоларингологи исключают у них аденоиды. Даже в последних версиях согласительных документов по АР отсутствуют данные об АР у детей до 2 лет, поскольку, как считают эксперты, ринит в этой популяции может отличаться от ринита у пациентов старшего возраста и не зависит от той же базы данных [22]. Такой же пробел касается вопросов диагностики и лечения бронхиальной астмы у детей до 5 лет.
В качестве дифференциальной диагностики чаще всего рассматривают острые вирусные инфекции верхних дыхательных путей, ларингофарингеальный рефлюкс, аденоиды. Помочь в подтверждении диагноза может аллергологическое обследование с помощью кожных проб или определения уровня специфических IgE в сыворотке крови [23].
За рубежом кожные пробы проводят в любом возрасте, в т.ч. младенцам. В российской практике есть ряд очень важных факторов, которые не позволяют считать результаты кожных проб достоверными. Во-первых, это техника тестирования скарификационным методом (чувствительность и специфичность прик-тестов более высока), во-вторых, отсутствие стандартизированных экстрактов аллергенов и, соответственно, существенные различия в их концентрации. Кроме того, в качестве стандартного аллергена для постановки кожных проб в России используют аллерген шерсти кошек, который представляет собой водно-солевой раствор белково-полисахаридных комплексов, выделенных из шерсти и перхоти животного. За рубежом с этой целью используют экстракт из эпителия кошки (собаки), а также перхоти этих животных.
Ранее мы установили, что диагностическая значимость аллергена из эпителия кошки (Allergopharma) была существенно выше, чем у аллергена шерсти кошки: в частности, при одновременной постановке кожных проб из этих двух экстрактов аллергенов положительные результаты на эпителий кошки получены у 55% больных бронхиальной астмой, тогда как сенсибилизация к шерсти кошки выявлена лишь в 11% случаев [24]. Корреляционный ранговый анализ не выявил корреляционно связь между этими двумя диагностическими тестами (р=0,262; р=0,153; р=0,153). Следовательно, такое различие следует учесть при диагностике больным сенсибилизацию к кошке.
Кроме того, кожные пробы имеют ряд противопоказаний (например, АтД, прием АГП и других препаратов, и т.п.).
Преимуществом использования in vitro-метода – определения уровня специфических IgE, является возможность тестирования к конкретным антигенам (в данном случае – эпителию кошки) вне зависимости от фазы заболевания и применения лекарственных средств. Что касается определения уровня общего IgE в сыворотке крови, то этот показатель имеет весьма ограниченную диагностическую ценность при диагностике АР, поскольку он может повышаться также при многих других заболеваниях [23].
В качестве лечения ребенку был назначен АГП, показанный при таких назальных симптомах, как чихание и зуд, а родителям рекомендовано исключить контакт с домашними животными.
С учетом возраста ребенка не показано использование интраназальных АГП и/или глюкокортикостероидных препаратов. Интересно отметить, что в США одобрено назначение монтелукаста для лечения симптомов круглогодичного АР у детей в возрасте 6 месяцев и взрослых, тогда как для сезонного АР – от 2 лет и старше. За рубежом используют также аллерген-иммунотерапию экстрактом эпителия кошки.



