Правомерно утверждать, что одним из определяющих факторов стабилизации кишечного гомеостаза является экологическая система тонкой и толстой кишки, которая включает достаточно сложно организованные микробные сообщества [1–6]. За последнее время широкое применение высокопроизводительных методов молекулярной микробиологии способствовали расширению наших знаний не только о качественном и количественном микробиоценозе кишечника, но и о системе его регуляции [3, 5–8].
В литературе эта система отмечена как принципиально новое направление и представлена двумя подсистемами: Quorum sensing, включающей сведения о внутрипопуляционных, межштаммовых, межвидовых взаимосвязях бактерий, их социального поведения, и Cross-talk – обмен информацией между микроорганизмами и клетками хозяина [7–9]. Материальными носителями сигнальной регуляторной системы считаются пептиды, аминокислоты, короткоцепочечные жирные кислоты, растительные, животные, микробные и другие лектины [3, 8–12]. Специфические сигнальные молекулы называются аутоиндукторами, а их роль подвергается дальнейшему анализу в научных исследованиях [10–14].
Первоначально заселившиеся бактерии, образовав мукозоассоциированные сообщества, располагаются в пристеночном слое слизи, ячейках гликокаликса, на базолатеральной поверхности энтеро- или колоноцитов и называются организационной (мукозной) структурой фекальной микробиоты. Последние сведения позволяют позиционировать мукозную флору как новый предиктор развития биопленок, покрывающих слизистую оболочку кишечника [15–17]. Несмотря на то что биопленки – это микроскопические структуры с толщиной от долей до десятков микрон, число колоний микрофлоры в них может достигать нескольких сот и даже тысяч, причем их толерантность к иммунной системе хозяина, антимикробным агентам и стрессам окружающей среды в десятки и сотни раз выше по сравнению с неиммобилизованными клетками. В настоящее время исследователи изучают тонкости механизма формирования биопленок. Существуют объективные доказательства того, что на первом этапе этого процесса происходит адгезия бактерий на клетках-мишенях. Механизмы адгезии включают как неспецифические, так и специфические взаимосвязи с участием специальных молекул - адгезинов [18, 19]. Для установления адгезивного контакта бактериальная клетка и клетка-мишень должны преодолеть электростатическое отталкивание, т.к. их поверхностные молекулы в физиологической ситуации несут отрицательный заряд. Однако наиболее важную роль играют взаимодействия между адгезинами и рецепторами. Чем более специфичны и прочны лиганд-рецепторные связи микрофлоры, тем труднее экзогенным бактериям имплантироваться в различных биотопах. Элементами, ответственными за специфическую адгезию, являются поверхностные структуры бактерий, содержащих гликолипиды, лектины, комплементарные соответствующим рецепторам слизи и мембран эпителиальных клеток. Своеобразие этих рецепторов детерминируется генетически у каждого индивидуума [18].
На втором этапе при устойчивой контаминации бактерии начинают образовывать экзополисахаридный окружающий матрикс (EPS – extracellular polymeric substance), состав которой варьируется в соответствии с тем, какие именно микроорганизмы в нем присутствуют, при этом доминируют полисахариды, белки, гликолипиды и бактериальная ДНК. Недавние исследования показали, что специфические характеристики EPS-биопленок, присущие одному виду бактерий, могут играть значительную роль в способности других видов фиксироваться и прикрепляться к уже существующей биопленке. Другое редчайшее качество полимикробных биопленок – наличие коллективного защитного эффекта. В качестве примера можно привести химическое явление, которое было обнаружено у антибиотикорезистентных бактерий. Они синтезируют и выпускают в окружающую среду небольшие охранные молекулы-энзимы или антибиотик-связывающие протеины, которые поглощаются соседними антибиотикочувствительными бактериями. Кроме того, имеются указания на то, что путем генетического обмена происходит формирование патогенных клонов со структурной модификацией бактериальной ДНК и вирулентными свойствами. Другими словами, изначально чувствительный к антибиотикам штамм может приобретать резистентные гены, что осложнит проведение любой антимикробной терапии и будет чревато негативными последствиями в длительной перспективе [19–22].
К основным факторам, контролирующим кишечную микрофлору, относится слизь [23–26]. Ультраструктура слизи представлена мукогликопротеиновыми полимерами, секретируемыми бокаловидными клетками эпителия. Состав и свойства слизи изменяются в зависимости от участка желудочно-кишечного тракта (ЖКТ) и находятся под контролем по крайней мере девяти генов (MUC 1, 2, 3, 4, 5ас, 5в, 6, 7, 8). Благодаря использованию лектиновых зондов ученые смогли выяснить структуру муцинов, оптимальную его концентрацию в слизистом слое различных участков ЖКТ. Было доказано, что слизь накапливает антимикробные вещества: иммуноглобулин А (IgA), лактоферрин, лактопероксидазу, лизоцим, а также обладает способностью связывать различные микроорганизмы посредством некоторых своих сахаров, которые имитируют бактериальные рецепторы. Недавно было показано, что в ответ на внедрение вирусов или потенциально опасных бактерий происходит гиперплазия бокаловидных клеток с прибавлением их числа и площади распространения, которые запускают различные профилактические механизмы действия. Уменьшение кислых и увеличение нейтральных муцинов в секрете приводят к повышению его вязкости и плотности. Этому способствует и возникновение между молекулами муцинов дисульфидных мостиков и водородных связей. Усиливается эффект гидрофобности с увеличением адгезивности [25]. Другими словами, в критических ситуациях физиологическая защита переходит в патологическую фазу с изменением физиолого-биохимических свойств слизистого слоя и адгезии. Например, при антибиотикоиндуцированной диарее, хронической идиопатической диарее, ряде воспалительных заболеваний кишечника было продемонстрировано изменение функции бокаловидных клеток, а также состава и толщины слизистого слоя [27].
В последнее время появляется все больше данных о факторах трилистника, которые представляют собой высокоактивные муцин-ассоциированные пептиды. Известно, что кишечный фактор трилистника практически полностью секретируется бокаловидными клетками, имеет четко выраженные противовоспалительное и антисекреторное действия, влияет на ключевые сигнальные пути в клетках хозяина, тем самым регулируя барьерную функцию плотных контактов, делая муциновый слой более вязким и плотным, уменьшая таким образом степень проницаемости для микробов. Как показано в эксперименте с моделью колита у крыс, экспрессия кишечного фактора трилистника в период активного воспаления существенно снижалась, при введении же в толстую кишку масляной кислоты достоверно восстанавливался его нормальный уровень. Исследования последовательных механизмов этого процесса пока не завершены, для более точного описания природы данной взаимосвязи требуется проведение дополнительных исследований.
Как показывают многолетние научные исследования, определенные виды фекальных бактерий питаются олигосахаридами муцинов, отрицательно влияя на целостность слизи, поэтому эпителию тонкой и толстой кишки приходится продуцировать гликопротеин быстрее, чем на него действуют бактерии, что позволяет поддерживать баланс между продукцией муцина и его уничтожением микрофлорой [28].
Текущие исследования свидетельствуют о том, что защитная стратегия является результатом сложного взаимодействия между микрофлорой тонкой и толстой кишки и эпителием кишечника, что бесспорно имеет позитивное значение. С одной стороны, микробиота индуцирует сигнал к ротации эпителиальных клеток и увеличение числа бокаловидных секреторных клеток. С другой – слизистая оболочка кишечника участвует в успешной доставке питательных веществ микроорганизмам, обеспечивая их жизнедеятельность и размножение [3, 10, 14, 16, 24]. При этом важной, но наиболее уязвимой составляющей эпителиального клеточного барьера является функциональная состоятельность клеточных контактов [29, 30]. К числу последних относятся плотные контакты, десмосомы и адгезионный контакт. Плотные, или замыкающие (zonula occludens), контакты – это участки, на которых мембраны двух соседних клеток тесно сближены и образуют барьер. Плотные контакты – это система ветвящихся полосок, каждая из которых состоит из многочисленных белков. Самые изученные из них – это клаудины и окклюдины. Плотные контакты выполняют три основные функции. Во-первых, механически цементируют клетки эпителия, во-вторых, обеспечивают барьер для латеральной диффузии белков, благодаря чему сохраняется полярность клеток эпителия. Это означает, что на апикальной поверхности локализованы одни белки, на базолатеральной – другие, соответственно, будут осуществляться противоположные транспортные процессы (экзо- или эндоцитоз). В-третьих, такое прочное соединение клеток приводит к тому, что большинство веществ транспортируется в организм через мембраны и цитоплазму клеток, минуя замыкающие межклеточные пространства [30].
Десмосома – еще один тип межклеточных контактов, обеспечивающих прочное соединение клеток. Со стороны цитоплазмы к десмосомам прикрепляются промежуточные филаменты, которые формируют в цитоплазме сеть, обладающую большой прочностью на разрыв. Десмосома состоит из белков клеточной адгезии семейства кадгеринов и соединительных (адапторных) белков, которые связывают их с промежуточными филаментами. Известные к настоящему времени белки клеточной адгезии – десмоглеин и десмоколлин, относятся к трансмембранным белкам, имеют по 5 внеклеточных доменов и являются кальцийсвязывающими. Между собой соединяются две одинаковые по строению молекулы белка, таким образом обеспечивается гомофильное объединение клеток.
Последний вид межклеточных контактов – простой неспециализированный (адгезионный) контакт, образуется за счет элементов гликокаликса трансмембранными гликопротеинами (кадгеринами) взаимодействующих мембран. Обращенные в сторону межклеточной щели молекулы кадгеринов связываются катионами кальция. Простые контакты не обеспечивают высокой прочности межклеточных взаимодействий, что благоприятствует транссудации высокомолекулярных субстанций.
Полученные данные позволяют сделать однозначный вывод об избирательной проницаемости кишечного эпителия, способного адаптироваться к текущим физиологическим потребностям [6, 24, 31–33]. Если же кишечный эпителий подвергается метаболическому стрессу, происходит дестабилизация белков цитоскелета, участвующих в формировании контактов, последние становятся несостоятельными, а кишечный барьер – проницаемым. Негативно воздействуют на снижение защитного потенциала кишечного барьера острая эндотоксемия, оксидантный стресс, тканевая гипоксия, провоспалительные цитокины, оксид азота, бактериальные токсины, протеолитические ферменты, массивная кровопотеря и другие патологические состояния [14, 29].
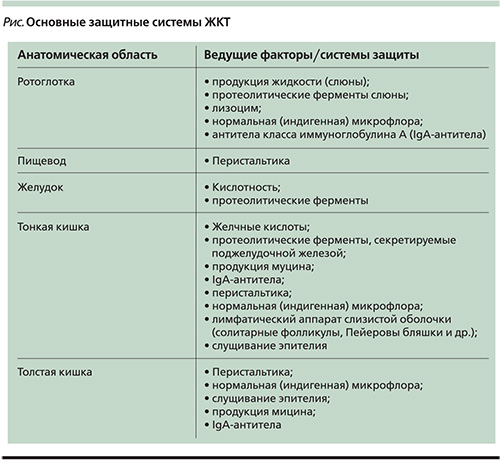
Существует много доводов в пользу теории о том, что эндогенный биоценоз пищеварительного тракта служит не только объектом воздействия активной клеточной массы, но и средством регуляции абиотических элементов [6, 10, 34, 35]. Как известно, к первично абиотическим факторам относятся конкретные уровни рН, степень анаэробиоза, желчные кислоты, панкреатические ферменты, наличие эндогенных и экзогенных (попавших с пищей) веществ, концентрация слизи и перистальтическая активность стенки органов (см. рисунок). Экологическое значение данных компонентов в свете кооперативного взаимодействия состоит в том, что вместе взятые, они образуют единую очень сложную микробную экосистему ЖКТ, постоянство которой служит основным определяющим фактором здоровья человека [11, 13]. Какие-либо отклонения в этой целостной системе приведут к нарушению ее функций.

Ученые единодушно признают, что в нарушениях фекальной экосистемы участвует много ключевых механизмов, представленных клеточными мишенями для разных биологических методов воздействия (селективная деконтаминация, энтеросорбция, пре- и пробиотики). Одним из практических подходов целенаправленного восстановления регуляторных систем является использование микроорганизмов, известных под названием «пробиотики» [1, 11, 36]. Эксперты Всемирной организации здравоохранения предложили следующую дефиницию: пробиотики – это живые микроорганизмы, которые при употреблении в адекватном количестве оказывают благоприятное (полезное) воздействие на микробиологический гомеостаз и состояние здоровья человека [37–39]. В последние годы с помощью экспериментальных работ на лабораторных животных и пилотных исследований на людях убедительно доказано, что типичными биологическими свойствами может обладать не только жизнеспособная, но и убитая бактериальная клетка (например, облучением), а также нежизнеспособные структурные компоненты бактерий (короткие ДНК-последовательности, пептидогликан, липотейхоевая кислота).
В связи с этим нет сомнений в том, что существует основание к расширению современного определения «пробиотик». Более того, в рамках концепции микробиологической терапии отечественные и зарубежные специалисты относят к пробиотикам пробиотические фармакологические препараты, микробиологические пищевые добавки, не имеющие статуса лечебных препаратов, и продукты функционального питания.
На сегодняшний день установлено, что в наличии имеется три направления клинических и моделирующих исследований, которые могут способствовать изучению биологического потенциала пробиотиков (табл. 1) [10, 37].
Усиление пробиотиками барьерной функции эпителия. Для лучшего понимания этих физиологических событий в качестве примера можно рассмотреть один из изученных и перспективных штаммов бифидобактерий – Bifidobacterium bifidum W23. Он выделен из кишечника здорового человека, не содержит лактозы, описан и запатентован. Установлено, что B. bifidum W23 относится к высокоадгезивным штаммам, обладающим отличным связыванием с эпителиальными клетками кишечника человека Caco-2 и HT-29 и, следовательно, имеет выраженную тенденцию к длительному персистированию в фекальной экосистеме [40]. Более того, с помощью технологии трансэпителиального электрического сопротивления (ТЭС) было доказано, что изучаемый штамм бифидобактерий имеет выраженную тенденцию к поддержанию целостности кишечного барьера. В эксперименте монослой клеток линии Caco-2, обладающих характеристиками клеток кишечных ворсинок, растили на фильтре. Сначала к клеткам Caco-2 добавляли исследуемый пробиотик, а затем в присутствии B. bifidum W23 – воспалительный стресс-фактор (сочетание фактора некроза опухоли α [ФНО-α] и интерлейкина-1β [ИЛ-1β]). Через 4 и 24 часа измеряли ТЭС монослоя. Результаты сравнивали с ТЭС монослоя клеток, которые подвергались только воздействию стресс-фактора, и с ТЭС монослоя, который не подвергался никаким воздействиям. Штамм B. bifidum W23 продемонстрировал выраженный протективный пробиотический эффект, при этом ранняя фаза ответа возникала умеренно быстро (через 4 часа) и проявлялась долгосрочно (в течение 24 часов) [40].
Было также показано, что штамм B. bifidum W23 может оказывать четко выраженное противовоспалительное действие. Исследования подтверждают, что пробиотик способен подавлять опосредованное кортиколиберином высвобождение биологически активных субстанций тучными клетками и таким образом снижать проницаемость эпителиального барьера, вызванную стрессом. Про кортиколиберин известно, что при стрессе происходит его высвобождение, он сначала воздействует на тучные, а затем на эпителиальные клетки. Кортиколиберин вызывает кратное увеличение медиаторов воспаления (фактора роста, различных цитокинов, β-гексозаминидазы), которые приводят к существенному снижению защитного потенциала плотных клеточных контактов [40].
Интересные данные были получены при использовании культуры Saccharomyces boulardii (Sb) на экспериментальный колит, индуцированный энтеропатогенными Escherichia coli. Показано, что Sb вследствие воздействия на один из путей трансдукции, связанный с контролем структуры плотного контакта, способствует сохранению целостности эпителиального барьера и сглаживает воспалительные последствия инфекции. Доказана также терапевтическая противовоспалительная активность Sb за счет снижения секреции ИЛ-8 и продукции ФНО-α, ограничения инфильтрации Т-хелперов-1 в воспаленную толстую кишку [41].
Есть сведения о том, что Streptococcus thermophillus и Lactobacillus acidophilus тормозили адгезию и инвазию энтероинвазивной E. сoli в клетках кишечного эпителия человека. На эпителиальных клетках, контактировавших с этими пробиотическими бактериями, наблюдали увеличение фосфорилирования актинина и окклюдина в области плотных клеточных соединений [42].
В модельных экспериментах на культуре клеток Caco-2 наблюдалось усиление или ослабление плотных клеточных контактов в ответ на введение бесклеточных супернатантов, различающихся по содержанию секретируемых компонентов. Установлено, что супернатант E. coli O157:H7 существенно увеличивал проницаемость клеток Caco-2, а секретируемые компоненты Bifidobacterium lactis значительно уменьшали ее [43].
В отношении другого штамма, Lactobacillus rhamnosus GG, выявлен профилактический цитокин-индуцированный апоптоз с помощью ингибирования активации проапоптатической р38/мутагенактивирующей протеинкиназы. С помощью L. rhamnosus (GG) и Lactobacillus plantarum было также продемонстрировано увеличение in vitro экспрессии генов муцина (MUC2, MUC3) в колоноцитах HT-29, способных препятствовать адгезии и инвазии патогенных бактерий [44].
Антимикробные эффекты пробиотиков. Помимо теоретических существуют доказательные позиции, свидетельствующие о том, что антисептические свойства пробиотиков связаны с продукцией антимикробных факторов: органических кислот, бактериоцинов и ингибиторных протеинов. Органические кислоты представляют собой «слабые кислоты», более 90% их молекул в просвете кишки находятся в анионной диссоциированной форме. Эти естественные метаболиты важны для регуляции адсорбции и метаболизма в толстой кишке. Как показали результаты экспериментальных работ, при некоторых физиологических и патологических состояниях они первоначально быстро проникают через мембрану условно-патогенных (патогенных) бактерий, которые колонизируют слизистую оболочку кишечника, изменяют внутриклеточную рН, снижают энергетический потенциал, аккумулируют токсические анионы, приводят к ультраструктурным дефектам бактериальной клетки, что в конечном итоге подавляет ее жизненные функции [45, 46]. Имеются доказательства, что ингибирующий эффект органических кислот напрямую зависит от показателя рН, при этом существуют данные о том, что при низких значениях более сильная антимикробная активность наблюдается у молочной и пропионовой кислот, при рН>4,5 – у уксусной кислоты [13, 46]. Известным фактом является потенциальная деятельность в отношении основных условно-патогенных микроорганизмов таких субстанций, как перекись водорода, диацетил и бактериоцины. При этом отмечено, что высокомолекулярные бактериоцины угнетают близкородственные виды бактерий, которые обитают в том же биотопе, а микроцины (низкомолекулярные метаболиты) имеют более широкий спектр антимикробной активности и, следовательно, более существенное бактериостатическое действие [47–50].
В последние годы появилось много клинических работ, изучающих участие оксида азота (NO) в развитии физиологических и патологических состояний. Важный положительный аспект таких исследований заключается прежде всего в том, что NO с доказанными свойствами ключевой сигнальной молекулой ЖКТ синтезируется не только клетками организма человека, но и некоторыми бактериями-комменсалами (E. coli, Lactobacillus) [51, 52]. Направленное цитотоксическое действие NO усиливается при ассоциации с кислой средой (бифидобактерии снижают рН до 5,0, лактобациллы – до 4,0). Именно в этих условиях образуются нитриты – высокотоксичные эндогенные метаболиты, нарушающие нормальное функционирование многих условно-патогенных и патогенных микроорганизмов, причем доказана способность ряда представителей нормальной микрофлоры находиться в резистентном состоянии к этим соединениям [53]. Особенность этих нитритов заключается также в том, что они потенцируют одновременный антибактериальный эффект перекиси водорода и молочной кислоты, которые образуются сахаролитическими бактериями [52]. Нейтрализация бактериальных вирулентных факторов доказана в отношении Sb. В результате применения Sb при антибиотикоассоциированной диарее уменьшался уровень NO-синтазы, вызывая ослабление синтеза NO из аргинина, и далее – стабилизацию вазодилатации, транспорта воды и электролитов, вторично смягчая негативные эффекты персистирующего воспалительного процесса при различных видах диареи [54].
Пробиотические механизмы иммуномодуляции. Особое место занимают исследования, изучающие возможности пробиотиков оказывать влияние на иммунологическое восстановление с помощью таких физиологических процессов, как повышение функциональной способности фагоцитирующих клеток и цитостатической активности макрофагов, стимуляция ассоциированной с кишечником лимфоидной ткани и воздействие на иммунокомпетентные Т- и В-клетки [13, 14, 38].
На сегодняшний день обсуждаются три пути физиологического иммунного ответа. Первый проявляется в том, что адгезия пробиотической бактерии к эпителиальным клеткам кишечного биотопа вызывает выделение цитокинов, улавливаемых дентритными клетками (Ds). При этом эпителиоциты кишечника играют решающую роль в обработке сигналов, которые действуют на общие сигнальные пути. Пассажа пробиотиков в просвете кишечника может быть достаточно для реализации межклеточных коммуникаций [55]. Второй путь также связан с механизмами клеточного воздействия и состоит в том, что М-клетки в фолликул-ассоциированном эпителии на поверхности Пейеровых бляшек обеспечивают доставку пробиотических бактерий в субэпителиальную область для последующего контакта с иммунными клетками (макрофагами, Ds). Там они распознаются рецепторами (TLR, CLR, NLR), что приводит к секреции ими цитокинов и экспрессии ко-стимуляторных молекул для Т-клеток [56]. Третий путь – связь микроорганизмов с выдвинутыми в просвет кишки отростками Ds, расположенными на собственной пластинке слизистой оболочки [56].
Особый интерес вызывает диалектика сложных отношений между структурной организацией комменсальной флоры кишечника и продукцией секреторных иммуноглобулинов. Объединенные данные показали, что стимуляция иммуноглобулинов сопровождается усилением экспрессии рецепторов адгезии и бактерицидной активности, благодаря чему формируется специфическая защита. Предполагается, что секреторные иммуноглобулины выполняют важную роль в осуществлении местной иммунологической реакции. Например, IgA1-антитела за счет тяжелых цепей, имеющих химическое сродство с мукозой, обеспечивают формирование монослоя иммуноглобулинов на поверхности слизистой оболочки. Другие Ig субкласса А2, не имея родства со слизистой оболочкой, мигрируют в просвет кишечника и создают первую линию иммунной защиты организма от инфекции. Следует отметить, что процесс специфической адгезии условно-патогенных и патогенных микроорганизмов к слизистой оболочке может блокироваться среди прочих факторов присутствием IgA и лизоцима, которые в свою очередь способствуют адгезии к рецепторам бифидобактерий и лактобацилл. Детальное изучение роли IgA в предотвращении колонизации слизистой оболочки посторонними бактериями установило, что 99% бифидобактерий и лактобацилл не покрыты секреторными иммуноглобулинами. Напротив, поверхности энтеробактерий, стафилококков, других условно-патогенных и сапрофитных микроорганизмов полностью выстланы IgA. Имеющаяся в распоряжении информация позволяет предположить, что в основе этого явления лежит феномен иммунологической толерантности к нормофлоре. Немаловажным преимуществом микрофлоры в развитии иммунного ответа следует считать в некотором роде ее универсальный иммуномодулирующий эффект, включающий как иммуностимуляцию, так и иммуносупрессию [57, 58].
Широко известно, что дрожжи Sb, имея в стенках своих клеток β-глюканы, могут выступать в роли модификаторов биологического ответа. Глюканы активизируют иммунную систему, связываясь со специфическими рецепторами на дендроцитах (дектин-1), а также с рецепторами на иммуноцитах (толл-подобные рецепторы, рецептор комплемента-3) [59, 60].
Согласно результатам последних экспериментальных исследований, пробиотики можно отнести к антиэндотоксиновым средствам. Убедительно показано, что бифидобактерии обладают эндотоксинсвязывающей способностью, снижают эндотоксинзависимую индукцию и высвобождение ИЛ-8 [61, 62]. Есть точка зрения, cогласно которой бактериальные липополисахариды и пептидогликаны, входящие в состав различных штаммов нормофлоры, оказывают иммунорегулирующее действие. Параллельно удалось установить, что ключевое значение антиэндотоксинового иммунитета заключается не в абсолютной защите организма от эндотоксина, а в ограничении его концентрации и биологической активности до уровня, необходимого для реализации физиологического функционирования иммунной системы [61].
В качестве положительного клинического примера можно привести результаты клинического исследования по изучению влияния Хилака форте на уровень эндотоксина грамотрицательных бактерий в плазме крови пациентов с микроэкологическими нарушениями кишечника, где удалось установить, что пробиотик метаболитного обладает эндотоксинсвязывающей способностью, снижая эндотоксинзависимую индукцию [61]. Прямое антитоксическое действие доказано у LGG, Sb, Lactobacillus reuteri [63].
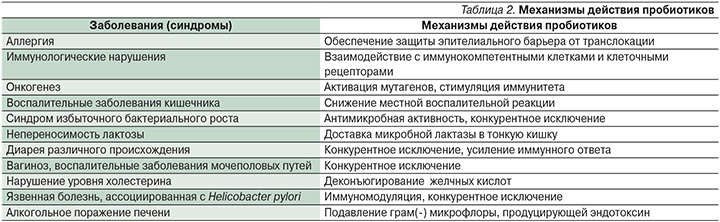
На сегодняшний день представлено множество работ, в которых механизмы действия пробиотиков детально обсуждены и систематизированы (табл. 2) [63].
Стало очевидным, что патогенетически обоснованным следует рассматривать назначение пробиотических препаратов при разных функциональных состояниях и заболеваниях, при этом диапазон их применения четко определен: острая фаза заболевания, периоды восстановления и профилактики. Целью такого терапевтического вмешательства является доказанная способность пробиотиков оказывать протективное действие на кишечный барьер, антагонистическое – на условно-патогенные микроорганизмы и стимулирующее – на иммунитет.



