Введение
Кампилобактериоз является одной из наиболее распространенных бактериальных кишечных инфекций во всем мире. Данные ученых Западной Европы, Австралии и Северной Америки свидетельствуют о том, что данное заболевание служит основной причиной острых энтероколитов с геморрагическими проявлениями в стуле («bloody diarrhea», гемоколиты) детей младшего возраста [1]. Ежегодный экономический ущерб от кампилобактериоза только в США составляет не менее 1,7 млрд долл. [2]. В нашей стране информация о заболеваемости данной инфекцией из-за трудности лабораторной диагностики собирается фрагментарно и не дает полного представления об истинных масштабах распространения данного заболевания.
Распространенность кампилобактериоза во многом обусловлена многообразием путей передачи инфекции: попадание кампилобактерий в организм человека происходит при употреблении некипяченой воды, прямом контакте с животными или при употреблении в пищу продуктов животного происхождения. Среди видов кампилобактерий, наиболее часто приводящих к заболеванию человека, выделяют Campylobacter jejuni и Campylobacter coli. Попадание данных микроорганизмов в кишечник приводит к поражению клеток слизистой оболочки пищеварительного тракта, и к запуску местного и системного воспалительных ответов.
В зависимости от дозы возбудителя, состояния пищеварительного тракта, а также особенностей иммунного реагирования ребенка инфекционный процесс может протекать как в виде легкой инфекции со скудными диспепсическими явлениями, так и в тяжелых формах с выраженными интоксикационным и диарейным синдромами. Смертность детей от данной инфекции сравнительно невысока и составляет менее 2,4 на 1000 всех случаев лабораторно подтвержденного заболевания [1].
Помимо «классических» форм кампилобактериоза, характеризующихся преимущественно симптомами острого гастроэнтерита, доказана возможность развития септицемии, пост-инфекционного артрита, синдрома Гиена–Барре и Миллера–Фишера [3]. Особого внимания заслуживают данные о частом развитии воспалительных заболеваний кишечника (неспецифический язвенный колит, болезнь Крона) а также функциональных расстройств желудочно-кишечного тракта после перенесенной инфекции.
Лечение кампилобактериоза основано на проведении комплекса лечебных мероприятий, включающих лечебно-охранительный режим, соблюдение диетических рекомендаций а также применение комбинированной медикаментозной этиотропной патогенетической (назначение пробиотиков, ферментных препаратов, сорбентов) и симптоматической терапии [4].
В рекомендациях американских и европейских обществ по лечению кишечных инфекций наибольшее внимание в терапии кампилобактериоза уделяется поддержанию надлежащей гидратации и коррекции нарушения содержания электролитов в крови [5]. Авторы также сходятся во мнении, будто в большинстве случаев даже при выделении из кала культуры Campylobacter spp. стоит воздерживаться от антибактериальной терапии, а также категорически избегать назначения средств, нарушающих моторику кишечника, особенно при наличии симптомов интоксикации.
Эффективность антибактериальной терапии кампилобактериоза была рассмотрена в нескольких крупных исследованиях. Так, по данным мета-анализа, включившего 11 работ, было показано, что антимикробная терапия уменьшает продолжительность диспепсических явлений на 1,3 дня (95% доверительный интерал [ДИ] – 0,6–2,0 дня) [6]. Также было установлено, что наибольшей эффективности в элиминации симптомов удается добиваться при применении препаратов в течение первых трех дней болезни.
Учитывая самоограничивающееся течение кампилобактериоза у большинства пациентов и ограниченную эффективность антимикробной терапии, лечение оправданно только в отношении пациентов с тяжелыми формами инфекции или высоким с риском осложнений. К клиническим симптомам, указывающим на тяжелое течение заболевания, относятся появление крови в стуле, длительная (более 3 суток) высокая лихорадка, а также длительное сохранение или рецидив клинических симптомов в течение одной недели [7].
В качестве препарата выбора большинство рекомендаций указывают азитромицин. Для взрослых пациентов в качестве альтернативной схемы возможно применение фторхинолонов. Оба антимикробных препарата обладают высокой эффективностью в отношении восприимчивых изолятов кампилобактерий. Стоит, однако, отметить, что, по данным нескольких исследовательских групп из Северной Америки и Азии, отмечается стремительный рост резистентности к фторхинолонам, значительно превышающий по скорости рост резистентности к мак-ролидам [8, 9]. Существуют, однако, данные о значительном росте резистентности также и к макролидным антибиотикам в Таиланде и Ирландии [10, 11].
Рациональная длительность применения антибактериальных препаратов составляет 5–7 дней. В ряде случаев при быстром полном разрешении симптомов заболевания в соответствии с рекомендациями американской ассоциации инфекционистов допустимо сокращение длительности приема препаратов до 3–4 дней.
Растущая заболеваемость кампилобактериозом, многообразие клинических форм заболевания, трудности своевременной диагностики инфекции на фоне растущей резистентности микроорганизма к ряду антибактериальных препаратов определяют необходимость оптимизации рациональной тактики лечения данного инфекционного заболевания.
Целью данного исследования стала оценка влияния этиотропной и патогенетической терапии на клинико-лабораторные параметры течения кампилобактериоза у детей.
Методы
В исследование были включены 90 пациентов в возрасте от 6 месяцев до 17 лет (средний возраст – 5,8±2,4 года) c диагнозом основного заболевания «кампилобактериоз», проходивших лечение в 2018–2019 гг. в отделении кишечных инфекции клиники ФГБУ ДНКЦИБ ФМБА. В исследование вошли 48 (53,3%) мальчиков и 42 (46,7%) девочки.
Оценивались клинические и лабораторные данные, полученные в ходе стационарного лечения пациентов, а также особенности эпидемиологического анамнеза и анамнеза жизни. Всем пациентам осуществляли стандартное лабораторное обследование, включившее оценку показателей гемограммы, общего анализа мочи, копрограммы, биохимический анализ крови. Все показатели оценивалась в динамике дважды: при поступлении в стационар, а также повторно на 5–7-е сутки лечения. По показаниям выполняли ультразвуковое исследование (УЗИ) органов брюшной полости и почек.
Подтверждение этиологии кампилобактериоза осуществляли с применением набора реагентов для выявления и дифференциации генетического материала микроорганизмов рода Shigella spp., Salmonella spp., Campylobacter spp., аденовирусов группы F, ротавирусов группы А, норовирусов 2-го генотипа и астровирусов в объектах окружающей среды и клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс® ОКИ скрин-FL» производства ИнтерЛабСервис (Москва). Помимо этого диагностику осуществляли культуральным методом – посев кала на специфические питательные среды для избирательного роста кампилобактерии.
Выделенные культуры кампилобактерий в последующем использовались для определения эффективности антибактериальных и пробиотических препаратов методом оценки зон задержки роста на чашке Петри с двуслойным агаром in vitro. Культивирование кампилобактерий осуществляли в микроаэрофильных условиях на среде кампилобакагар.
В ходе исследования у части пациентов было диагностировано сочетание кампилобактериоза с другими кишечными инфекциями. В проведенном исследовании для максимальной объективизации получаемых данных результаты анализировались как отдельно для пациентов с сочетанной и монокишечной инфекциями, так и совместно для всех вошедших в исследование пациентов.
Клиническое наблюдение за больными осуществлялось ежедневно. Проводили оценку тяжести симптомов острой кишечной инфекции (диарея, рвота, боли в животе, метеоризм), общих симптомов интоксикации (снижение активности, отсутствие аппетита, нарушение сна), выраженности лихорадочной реакции, наличия катаральных явлений со стороны верхних дыхательных путей и признаков эксикоза (снижение тургора, эластичности кожных покровов, появление сухости слизистых оболочек, наличие жажды и олигоурии).
Тяжесть состояния пациента оценивали на основании выраженности симптомов поражения желудочно-кишечного тракта, интоксикации и дегидратации с применением шкалы Везикари [12].
Все пациенты в условиях стационара получали комплексную терапию, включившую диетотерапию, регидратацию (инфузионная терапия глюкозо-солевыми растворами и пероральная регидратация низкоосмолярными растворами), применение сорбентов, пробиотиков, пребиотиков и ферментных препаратов. В ходе исследования было проведено сопоставление клинико-лабораторной эффективности применения различных антибактериальных и пробиотических препаратов при кампилобактериозе. Сопоставление эффектов пробиотиков проводилось относительно штаммов, применяемых при комплексной терапии кампилобактериоза: Saccharomyces boulardii, сочетание Lactobacillus rhamnosus и Bifidobacterium longum и сочетание B. longum и Enterococcus faecium.
В качестве положительного контроля применялся азитромицин, ингибирующий эффект азитромицина расценивался как 100%.
Статистическую обработку материала исследований проводили с помощью программы Statistica for Windows, v. 10 (StatSoft, США) с использованием параметрических и непараметрических критериев. Результаты считали достоверными при р<0,05. Для определения достоверности различий в двух сравниваемых выборках использовали t-критерий Стьюдента, ранговый U-критерий Вилкоксона, Манна–Уитни, а при сравнении 3 и более групп – ранговый дисперсионный анализ Краскела–Уоллиса. Сравнение частоты встречаемости признаков в группах и анализ таблиц сопряженности выполняли с помощью χ2-критерия Пирсона и точного метода Фишера.
Результаты
В ходе обследования у 60 (66,6%) пациентов был диагностирован кампилобактериоз в виде моноинфекции, у 30 (33,3%) имело место сочетание кампилобактериоза с другими энтеротропными возбудителями. У пациентов с сочетанной инфекцией наиболее часто выявлялись вирусные возбудители (n=18; 20,0%), среди которых превалировали ротавирусы (n=10; 11,1%). Среди бактериальных возбудителей наиболее часто отмечалось сочетанное инфицирование диарогенными эшерихиями (n=6; 6,7%)
При анализе возможных факторов передачи кампилобактериоза было установлено, что в большинстве случаев (n=24; 26,7%) заболевание можно было связать с употреблением в пищу мясных продуктов. Среди мясных продуктов наиболее часто имело место употребление мясных прикормов (n=9; 10%), курицы (n=5; 5,6%), колбасы и сосисок (n=4; 4,4%), свиного шашлыка (n=3; 3,3%). Родители только 3 (3,3%) человек отмечали употребление накануне заболевания молочных продуктов, 6 (6,6%) человек накануне заболевания отмечали посещение ресторанов быстрого питания.
Несколько неожиданно значимую долю исследуемой выборки пациентов (n=19; 21,1%) составили пациенты грудного возраста. Вероятно, данный феномен может быть объяснен тенденцией к раннему введению в рацион питания продуктов, которые могут быть фактором передачи кампилобактериоза. В той же группе отмечено наиболее тяжелое течение кампилобактериоза (Индекс Везикари – 16,8±2,1 балла у младших детей и 13,2±3,2 балла у детей старше года; p=0,03).
В большинстве случаев (n=66; 73,3%) кампилобактериоз протекал в среднетяжелой форме. Тяжелые формы были диагностированы у 24 (26,7%) пациентов. Тяжесть состояния у пациентов обусловливалась выраженностью интоксикационного синдрома, дегидратации, а также поздним поступлением пациента в стационар для лечения.
В клинической картине при кампилобактериозе у всех пациентов отмечалось сочетание диарейного и интоксикационного синдромов. В значительной доле случаев (n=57; 63,3%) у пациентов имело место появление крови в стуле. Длительность сохранения диареи в среднем составила 5,6±1,2 суток. На наличие абдоминальных болей жалобы предъявляли 47 детей. Наиболее часто боли локализовывались в области фланков живота, носили умеренный характер, купировались при применении спазмолитиков.
В ряде случаев (n=3; 3,3%) интенсивность и характер болей имитировали клинику острой хирургической патологии и потребовали осмотра хирурга.
Повышение температуры было зарегистрировано у 84 (93,3%) пациентов. Выраженность интоксикационного синдрома варьировалась в различных группах пациентов. В большинстве случаев лихорадка носила фебрильный характер (n=46; 51,1%) и сохранялась в течение 3,2±1,1 суток.
При оценке лабораторных показателей было установлено, что характерными признаками кампилобактериоза являются умеренный лейкоцитоз с палочкоядерным сдвигом нейтрофилов и колитический синдром в копрограмме. Обращало на себя внимание также частое (n=39; 43,3%) выявление высокого уровня С-реактивного белка (более 50 мг/л). Повышение данного параметра, более характерное для сальмонеллезов и шигеллезов, затрудняло диагностику кампилобактериоза и в ряде случаев служило основанием для назначения антибактериального препарата группы резерва.
Сопоставление особенностей клинического течения кампилобактериоза на фоне применения антибактериальных препаратов различных групп подтвердило высокую эффективность азитромицина при данной инфекции (см. таблицу).
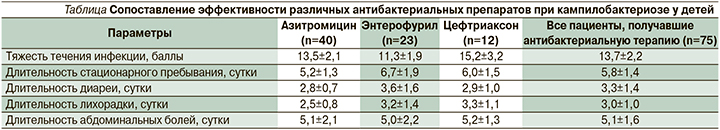
Применение азитромицина приводило к более быстрому купированию диарейного и интоксикационного синдромов по сравнению с энтерофурилом и цефтриаксоном. В то же время стоит отметить, что назначение цефтриаксона имело место до верификации возбудителя и осуществлялось пациентам с тяжелым течением кишечной инфекции (15,2±3,2 балла по шкале Везикари). После уточнения диагноза в ряде случаев (n=13) осуществлялась замена препарата на азитромицин. Нифуроксазид оказался эффективным в качестве этиотропного препарата для пациентов с нетяжелым (менее 15 баллов по шкале Везикари) течением кампилобактериоза. Стоит также отметить, что при применении нифуроксазида отмечалось более быстрое уменьшение выраженности абдоминальных болей. Одним из возможных объяснений данного феномена может быть наличие у азитромицина выраженной прокинетической активности, приводящей к стимуляции перистальтики кишечника и умеренному усилению болей в животе в первые часы приема.
Эффективность применения пробиотических препаратов в исследовании оценивалась in vitro на основании ингибирования роста культур кампилобактерий. Оценка клинических эффектов пробиотиков была затруднена в силу ограниченности выборки пациентов и преобладания эффектов антибактериальных препаратов в группах пациентов.
Сопоставление проводилось на четырех наиболее часто выделяемых у детей культурах кампилобактерий (три штамма Campylobacter coli и один Campylobacter jejuni). Все пробиотические штаммы продемонстрировали возможность ингибировать рост кампилобактерий in vitro. Сочетание L. rhamnosus и B. longum оказалось эффективным в отношении всех четырех штаммов кампилобактерии. Добавление данного штамма в культуру кампилобактерий приводило к ингибированию роста микроорганизма в пределах 40–60% по сравнению с контролем (добавление азитромицина). Ингибирующая активность других штаммов убывала в ряду S. boulardii, сочетание B. longum и E. faecium. Более того сочетание B. longum и E. faecium оказалось эффективным только в отношении 2 из 4, а S. boulardii в отношении 3 из 4 штаммов кампилобактерий.
Обсуждение
Данные, полученные в ходе исследования, позволяют расширить представления о современной роли кампилобактериоза в структуре диарейных заболеваний у детей. Несмотря на то что нами не было выявлено септических форм кампилобактериоза, а также жизнеугрожающих осложнений заболевания, регистрируемых другими исследователями [13], а все пациенты, вошедшие в группы исследования, на фоне проводимой терапии продемонстрировали отчетливую положительную динамику, существуют серьезные основания для пристального внимания именно к данной кишечной инфекции. Не менее чем в четверти случаев на момент поступления состояние пациентов при использовании стандартизированных шкал оценивалось как тяжелое и требовало проведения широкого комплекса лечебных мероприятий, включивших антибактериальную, гемостатическую, комплексную патогенетическую терапию и парентериальную регидратацию. Средняя продолжительность сохранения интоксикационного и диарейного синдромов составила соответственно более 3 и 5 дней. Инфекция протекала с лабораторными признаками системного воспаления и поражения толстой кишки. Особого внимания заслуживает отмечающаяся тенденция включения в инфекционный процесс детей грудного возраста, у которых заболевание протекает в наиболее тяжелых формах. Все это позволяет говорить о том, что кампилобактериоз является одним из широко распространенных и клинически значимых инфекционных заболеваний органов пищеварения у детей.
Говоря о подходах к этиотропной терапии кампилобактериоза, мы не выявили штаммов кампилобактерий, резистентных к воздействию азитромицина. В то же время эмпирическое применение цефалоспоринов 3-го поколения пациентами с тяжелыми формами кампилобактериоза не приводило к отчетливому клиническому улучшению и часто требовало коррекции этиотропной терапии. С учетом трудности диагностики кампилобактериоза, а также частого выявления в лабораторных параметрах выраженного лейкоцитоза и повышения уровня С-реактивного белка, сходных с течением шигеллезов и сальмонеллеза, выбор антибактериального препарата представляется трудной задачей для клинициста. Это позволяет говорить о необходимости дальнейшего повышения доступности молекулярно-генетических методов лабораторной диагностики кишечных инфекций, позволяющих быстро и эффективно диагностировать кампилобактериоз и, соответственно, корректировать выбор антибактериального препарата. Применение кишечных антисептиков, в частности нифуроксазида, вызывает положительные клинические эффекты при нетяжелых формах кампилобактериоза.
Назначение пробиотиков при кампилобактериозе остается вопросом, требующим активного дальнейшего изучения. На сегодняшний день применение препаратов данной группы рекомендовано большинством медицинских сообществ. По данным, полученным в ходе проведенного исследования, пробиотики обладают способностью ингибировать рост Campyllobacter spp. in vitro. Более того, действия, оказываемые на выделенные у детей штаммы кампилобактерий, сопоставимы с действием антибактериальных препаратов. Существуют серьезные ограничения, не позволяющие однозначно говорить о столь значимой эффективности пробиотиков при кампилобактериозе. В первую очередь стоит говорить о трудности доставки пробиотических штаммов в кишечник, а также сложности взаимодействия с микроорганизмами, уже находящимися в кишечнике, с учетом неблагоприятных свойств среды и воздействия антибактериальных препаратов. Было показано, что исследуемые пробиотические штаммы имеют значительные различия в ингибировании роста кампилобактерий in vitro. Одновременно с этим было выявлено наличие специфичности воздействия пробиотиков на конкретные штаммы кампилобактерий. Все это свидетельствует о необходимости дальнейшей оценки in vivo пробиотических штаммов, оказывающих наиболее сильное ингибирующее воздействие на кампилоабктерии in vitro.
Заключение
Таким образом, кампилобактериоз в настоящее время характеризуется сочетанием выраженного интоксикационного и диарейного синдромов, сопровождается лейкоцитозом, повышением уровня С-реактивного белка и воспалительными явлениями в копрограмме. В этиотропной терапии кампилобактериоза наибольшую эффективность имеют антибактериальные препараты группы макролидов.
Пробиотические препараты существенным образом оказывают влияние на рост кампилобактерий, в ряде случаев демонстрируя in vitro эффекты, сопоставимые с применением антибактериальных препаратов. Дополнительного изучения требует специфичность воздействия пробиотиков на определенные штаммы кампилобактерий, которое, как показывают данные исследования, может варьироваться в широком диапазоне.



