Применение антиконвульсантов в клинической практике всегда сопровождается сложностью подбора эффективных и безопасных доз, для чего рекомендуется проведение мониторинга концентраций – терапевтический лекарственный мониторинг (ТЛМ). Более 30 лет ТЛМ применяется для контроля за эффективностью и безопасностью антиконвульсантов: первоначально руководства по применению ТЛМ были разработаны в отдельных странах [1, 2], а в 2008 г. Международной лигой по эпилепсии были приняты международные практические рекомендации [3]. В них уровень доказанности для ТЛМ антиконвульсантов был определен как 2 (табл. 1). ТЛМ в настоящее время является реальным инструментом для персонализированной фармакотерапии. Для проведения ТЛМ в клинической практике учитываются специальные условия: широкая межиндивидуальная вариабельность фармакокинетики лекарственного препарата, тесная корреляция между концентрацией и токсическими эффектами или узкая терапевтическая широта лекарственного препарата, а также наличие доступного и валидированного метода определения концентрации. Эти условия имеют тесное приложение к использованию антиконвульсантов.
Для лечения различных клинических форм эпилепсии у взрослых и детей наиболее широко в клинической практике применяются два препарата: карбамазепин и вальпроевая кислота. Они имеют доказанную эффективность, но характеризуются узкой терапевтической широтой и высокой межиндивидуальной вариабельностью плазменной концентрации. К особенностям фармакокинетики карбамазепина относится аутоиндукция метаболизма в печени при длительном применении (преимущественно через цитохром Р450), что может изменять его эффективность и требует проведения ТЛМ. Вальпроевая кислота имеет концентрационно зависимую фармакокинетику, зависимую от степени насыщения связывания с белками плазмы крови и активности метаболизма в печени (50 % глюкуронизацией, 40 % β-оксидацией, 10 % цитохромом Р450), что также требует контроля над уровнем плазменной концентрации [4–6].
Показания к проведению ТЛМ антиконвульсантов [3, 7]:
- начало лечения по достижении равновесной концентрации (первые 72–96 часов);
- 1 раз в год для взрослых (1 раз в 6 месяцев для детей) с хорошей эффективностью и компла ентностью в отсутствие модификации фармакотерапии (изменений дозового режима, замены на другие лекарственные формы или препараты-генерики, добавления других препаратов);
- 1 раз в 3 месяца при модификации фармакотерапии, подозрения на лекарственные взаимодействия и изменения фармакокинетики препаратов (при заболеваниях печени или ЖКТ, беременности и пр.);
- недостаточная эффективность или изменение эффективности на фоне применения адекватных терапевтических дозировок препаратов;
- подозрение на интоксикацию или нежелательные лекарственные реакции;
- подозрение в некомплаентности пациентов.

Представляет интерес исследование концентраций антиконвульсантов в реальной практике лечения пациентов с эпилепсией.
Материал и методы
Данное исследование – ретроспективное по изучению ТЛМ антиконвульсантов в условиях реальной практики. Материалом исследования стали результаты ТЛМ у пациентов с эпилепсией, проведенные в лаборатории фармакокинетики на кафедре клинической фармакологии РНИМУ им. Н.И. Пирогова за 2009–2012 гг. Были отобраны результаты ТЛМ 614 пациентов, из которых 295 получали препараты вальпроевой кислоты и 319 – препараты карбамазепина. Препараты вальпроевой кислоты были представлены 9 торговыми наименованиями, 85 % из них относились к лекарственным формам с замедленным высвобождением. Но наиболее часто в клинической практике использовался Депакин хроно (61 %). Из препаратов карбамазепина применялись 5 торговых наименований, 65 % были представлены лекарственными формами с замедленным высвобождением; в половине случаев применялся Финлепсин ретард. Общая характеристика пациентов представлена в табл. 2.

Концентрация вальпроевой кислоты и карбамазепина определена с помощью высокоэффективной жидкостной хроматографии [8]. Исследовались 2 пробы крови при равновесном состоянии (steady state): перед приемом очередной разовой дозы препарата (Cmin) и через 2,0–2,5 часа после приема очередной дозы (Cmax). Терапевтический диапазон концентраций вальпроевой кислоты считали 50–150 мг/л [8]; концентрация выше 175 мг/л нейротоксична [4]. Терапевтический диапазон концентраций карбамазепина считали в пределах 4–12 мг/л для всех пациентов; при детальном индивидуальном анализе учтен диапазон при монотерапии карбамазепином 8–12 мг/л, при комбинированной терапии – 4–8 мг/л [8]; концентрация выше 15 мг/л токсична. Рассчитано отношение Cmax/Cmin для оценки степени флюктуации концентрации.
Результаты ТЛМ вальпроевой кислоты
Анализ концентраций вальпроевой кислоты во всей группе пациентов показал достижение средних значений Cmin и Cmax в терапевтическом диапазоне 66,4 %. Частота достижения терапевтического диапазона по уровню Cmax была высокой и составила 82,7 %. Среди пациентов, достигших терапевтического диапазона, частота монотерапии составила 55,6 %, в 44,4 % пациенты получали комбинированную терапию. Показатели Cmin и Cmax вальпроевой кислоты не зависели от количества принимаемых антиконвульсантов и были сопоставимыми как при монотерапии вальпроатами, так и при комбинации от 2 до 4 других препаратов, что свидетельствует о стабильности фармакокинетики препаратов вальпроевой кислоты и отсутствии фармакокинетических лекарственных взаимодействий с другими антиконвульсантами. Диапазон суточных доз, обеспечивавших терапевтические концентрации, составил 600–3000 мг: дозы 600–750 мг были только у 9 (4,5 %) человек, а дозы выше 2000 мг, которые превышали средние терапевтические, – у 20 (10 %), из них использовалась суточная доза 3000 мг.
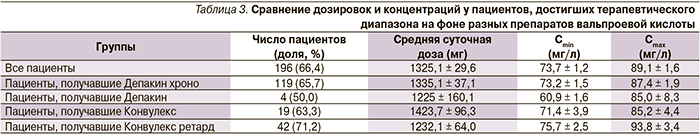
Частота достижения терапевтического диапазона концентраций вальпроевой кислоты зависела от препаратов и лекарственных форм (табл. 3). Так, применение Депакина хроно и Конвулекса ретард, обеспечивающих замедленное высвобождение вещества, сопровождалось более высокой частотой достижения терапевтического диапазона концентраций: 65,7 и 71,2 % соответственно. Причем Конвулекс ретард имел меньшее значение средней суточной дозы и более высокие показатели Cmax по сравнению с другими препаратами.
Анализ случаев недостижения терапевтического диапазона концентраций показал, что у 96 пациентов Cmin составила 35,3 ± 1,1 мг/л и у 48 из них уровень Cmax оставался 35,0 ± 1,6 мг/л, что меньше нижней границы диапазона (16,3 %). Средняя суточная доза вальпроатов, не обеспечившая терапевтический диапазон, составила 819,8 мг и не зависела от препарата или лекарственной формы и кратности приема. В то же время у 21 (43 %) из 48 пациентов с субтерапевтическими концентрациями вальпроевой кислоты суточная доза препаратов была в пределах средней терапевтической (более 1000 мг/сут). Необходимо отметить, что у 3 пациентов на фоне приема вальпроатов в дозах 500, 1000 и 1500 мг/сут в монотерапии, соответственно, уровень концентраций Cmax и Cmin оставался крайне низким – менее 11 мг/л, что может свидетельствовать о фармакогенетических нарушениях метаболизма вальпроевой кислоты (особенно UGT1А) [5, 9, 10]. Среди пациентов с субтерапевтической концентрацией вальпроевой кислоты частота комбинированной терапии составила 39,6 %, что существенно меньше, чем в группе достигших терапевтического диапазона, и не может объяснять низкие концентрации фармакокинетическими взаимодействиями с другими антиконвульсантами.
Случаи передозировки вальпроатов отмечены у 3 (1 %) пациентов на фоне приема Депакина хроно в дозах 1500 и 2400 мг/сут (Cmax достигла 160, 164 и 168,6 мг/л). Однако токсическая концентрация для ЦНС (выше 175 мг/л) не была достигнута ни в одном случае. Важно отметить, что диапазоны дозировок у пациентов с сверх- и терапевтическими концентрациями полностью совпали, а диапазоны дозировок у пациентов со сверх- и субтерапевтическими концентрациями не совпали совсем.
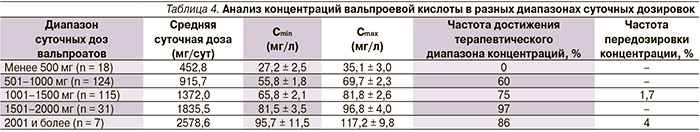
Результаты ТЛМ были дополнительно проанализированы с учетом средних терапевтических дозировок вальпроатов, рекомендованных к применению в клинической практике. Обычные начальные дозы препаратов не превышают 1000 мг/сут (из расчета 10–15 мг/кг для взрослых), в дальнейшем дозы титруются по клинической эффективности и в среднем составляют 1000–2000 мг/сут (из расчета 20–30 мг/кг). Соответственно, достижение терапевтического диапазона концентраций вальпроевой кислоты при использовании начальных дозировок отмечено только у 8 % пациентов, а в диапазоне средних терапевтических доз их доля возросла до 58 %. Более детальная характеристика результатов ТЛМ в разных диапазонах дозировок вальпроатов представлена в табл. 4. Из данных таблицы видно, что применение доз менее 500 мг/сут, которые применялись 6 % пациентов, не обеспечило терапевтического диапазона концентраций вальпроевой кислоты ни одному больному. В этих случаях проведение ТЛМ совершенно неоправданно, т.к. наблюдаются низкие концентрации вальпроевой кислоты – даже на фоне комбинированной терапии с другими антиконвульсантами (она применялась половиной этих пациентов). Применение вальпроатов в диапазоне доз 501–2000 мг/сут показало наилучший результат терапевтических концентраций для подавляющего большинства пациентов. Причем даже при дозах 501–1000 мг/сут, которые применялись 42 % пациентов, частота достижения терапевтического диапазона концентраций вальпроевой кислоты составила 60 %. Применение дозировок 1001–1500 мг/сут обеспечило достижение терапевтического диапазона концентраций 75 % пациентов. В то же время в этой группе у 2 женщин (31 и 38 лет) имела место передозировка: на фоне приема Депакина хроно в дозе 1500 мг/сут в комбинации с другими антиконвульсантами Cmax достигла 168,5 и 164 мг/л. Эти случаи могут объясняться фармакокинетическими взаимодействиями с другими препаратами, которые являются субстратами для тех же метаболизирующих ферментов печени, что и вальпроевая кислота, и изменяют их активность (ламотрижин – UGT, топирамат – β-оксидация и CYP2C19) [7]. Кроме того, возможны и фармакогенетические нарушения активности печеночных ферментов, участвующих в метаболизме вальпроевой кислоты, как причина развития передозировки даже на фоне средних терапевтических доз препаратов [5, 9].
Самая высокая частота достижения терапевтического диапазона концентраций отмечена в дозах 1501–2000 мг/сут и составила 97 %; только у 1 пациента при использовании Депакина хроно в дозе 1650 мг/сут в комбинации с Ламикталом Cmin оказалась ниже границы терапевтического диапазона (составила 35 мг/л), хотя Cmax достигла 59,7 мг/л. Более высокие дозы вальпроатов (более 2000 мг/сут) хотя и создают терапевтические концентрации вальпроевой кислоты (они были у всех пациентов данной группы), но повышают риск передозировки – у 1 пациента при использовании суточной дозы Депакина хроно 2400 мг в монотерапии Cmax превысила границу терапевтического диапазона (составила 160 мг/л). В этих клинических случаях, когда необходимо применение доз вальпроатов более 2000 мг, требуется проведение ТЛМ для контроля безопасности терапии.
Таким образом, проведенный анализ данных ТЛМ вальпроатов в рутинной клинической практике показал значимость этого метода для оптимизации фармакотерапии взрослых пациентов с эпилепсией. Выявлены случаи неоправданного назначения ТЛМ при использовании невысоких доз препаратов (до 500 мг/сут). Показан средний терапевтический диапазон дозировок в реальной практике, обеспечивающий терапевтический уровень концентраций вальпроевой кислоты, который не отличался для разных препаратов и лекарственных форм вальпроатов. Вместе с тем выявлены редкие случаи парадоксально низких значений концентраций даже при использовании средних суточных дозировок и редкие случаи передозировки даже при приеме невысоких дозировок вальпроатов, что оправдывает проведение ТЛМ на фоне фармакотерапии в терапевтических дозах 500–1500 мг/сут. При использовании доз вальпроатов более 2000 мг/сут проведение ТЛМ является необходимым для контроля над безопасностью фармакотерапии ввиду риска передозировки.
Результаты ТЛМ карбамазепина
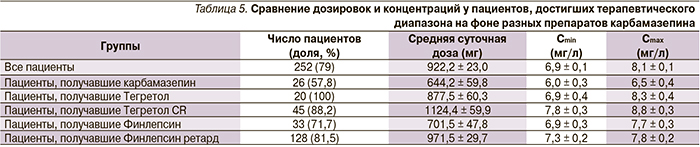
Анализ концентраций карбамазепина во всей группе пациентов показал достижение средних значений Cmin и Cmax в терапевтическом диапазоне при средней суточной дозе 881,5 мг. Частота достижения терапевтического диапазона концентраций в отличие от группы вальпроатов оказалась более высокой и составила 78,6 %, причем по показателю Cmax достигли терапевтического значения еще большее число пациентов – 86,5 %. Для достижения терапевтического диапазона концентраций пациентам требовались более высокие суточные дозы препаратов карбамазепина – 922,2 мг. Диапазон дозировок для пациентов с терапевтическими концентрациями был очень широким и составил 200–2000 мг/сут.
Важно отметить, что препараты карбамазепина короткого действия применялись в достоверно меньших дозировках (почти в 1,5 раза), чем лекарственные формы пролонгированного действия (Тегретол CR, Финлепсин ретард), соответственно, и средний уровень концентраций Cmin и Cmax был достоверно меньший.
В результате частота достижения терапевтического диапазона также была на 50 % больше для препаратов пролонгированного действия: 88,2 и 81,5 % для Тегретола CR и Финлепсина ретард против 57,8 и 71,7 % для карбамазепина и Финлепсина (табл. 5).
Доля пациентов, не достигших терапевтического диапазона концентраций по уровню Cmin и Cmax, в группе получавших препараты карбамазепина, составила 6,3 % (20 человек), причем субтерапевтическая концентрация Cmin имела место у 44 пациентов (13,8 %).
У подавляющего большинства (88,6 %) пациентов с субтерапевтическими концентрациями карбамазепина суточные дозы были в диапазоне 150–600 мг/сут, которые относятся к начальным и только в одном случае – 2000 мг/сут (см. ниже). Вместе с тем необходимо отметить, что диапазоны дозировок у пациентов с субтерапевтическими и терапевтическими концентрациями карбамазепина тесно пересекаются, что делает непрогнозируемыми концентрации и создает проблемы при индивидуальном подборе доз. В этой группе подавляющее большинство пациентов получали монотерапию (только 3 человека комбинацию двух препаратов), причем преимущественно препаратами короткого действия – 15,6 и 13,0 % на фоне приема карбамазепина и Финлепсина соответственно; в то же время на фоне приема Тегретола все пациенты достигли терапевтического диапазона. Среди пациентов, принимавших лекарственные формы пролонгированного действия, недостижение терапевтического диапазона концентраций наблюдалось существенно реже. Так, на фоне приема Финлепсина ретард (средняя доза – 576,7 мг/сут, диапазон доз – 150–2000 мг/сут) недостижение терапевтической концентрации по уровню Cmin отмечено у 15 (9,5 %) человек (средняя концентрация – 2,9 мг/л), при этом уровень Cmax у половины из них достиг терапевтического диапазона. На фоне приема Тегретола CR недостижение терапевтической концентрации наблюдалось только по уровню Cmin у 2 (3,9 %) пациентов в дозе 400 мг/сут (Cmin 3,4 и 3,8 мг/л), при этом уровень Cmax у всех пациентов достиг терапевтического диапазона (средняя Cmax – 9,1 мг/л).
Анализируя индивидуальные показатели пациентов с субтерапевтическими концентрациями, обращали внимание 4 особых случая с парадоксально низкими концентрациями карбамазепина: 1 пациент на фоне приема карбамазепина в дозе 600 мг/сут не показал накопления препарата в крови (Cmin и Cmax оказались равными 0), 2 пациента на фоне приема Финлепсина ретард 400 мг/сут имели крайне низкие концентрации карбамазепина (Cmin – 0,7 и 1,1, Cmax – 1,6 и 1,5 мг/л соответственно) и 1 пациент, несмотря на высокую дозу Финлепсина ретард 2000 мг/сут, имел субтерапевтические концентрации (Cmin 3,0 и Cmax 3,9 мг/л). Такие случаи могут объясняться фармакогенетическими нарушениями метаболизма карбамазепина (преимущественно CYP3A4 и CYP3A5) (11).
В одном фармакогенетическом исследовании 84 пациентов с эпилепсией, проведенном в Китае, было показано влияние полиморфизма CYP3A5 на метаболизм карбамазепина. Так, было выявлено, что 20,8 % были носителями CYP3A5’1 аллеля (генотипы АА или АG) и имели более низкие концентрации карбамазепина при использовании достоверно более высоких, чем носители CYP3A5’3 аллеля (генотип GG), доз препарата (512,5 против 441 мг/сут) [11]. Аналогичные результаты роли генетического полиморфизма CYP3A5 для карбамазепина выявили и другие авторы на других популяциях [12, 13].
Число случаев передозировки терапевтического диапазона карбамазепина наблюдалось у 4 (1,25 %) пациентов, причем все они произошли в случае монотерапии в диапазоне дозировок 800–1600 мг/сут (средняя – 1250 мг/сут). Вместе с тем передозировка по уровню Cmax имела место у 23 больных и составила 13,2 мг/л, но только у 2 пациентов концентрация превышала токсическую (более 15 мг/л). Таким образом, диапазон дозировок для пациентов с передозировкой полностью укладывался в диапазон доз пациентов с терапевтическими концентрациями карбамазепина, что делает дозы непредсказуемыми для развития токсичности.
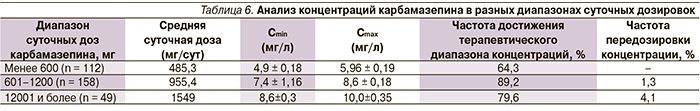
Результаты ТЛМ были дополнительно проанализированы с учетом средних терапевтических дозировок карбамазепина, применяемых в клинической практике. Обычно начальные дозы препаратов составляют до 600 мг/сут, которые в дальнейшем титруются по клинической эффективности и в среднем составляют 1000–2000 мг/сут. Соответственно, достижение терапевтического диапазона концентраций карбамазепина при использовании начальных дозировок (до 600 мг/сут) отмечено у 64,3 % пациентов, а при использовании более высоких дозировок (600 мг/сут и более) их доля возросла до 87 %. Более детальный анализ результатов ТЛМ в разных диапазонах дозировок карбамазепина представлен в табл. 6. Из данных таблицы видно, что наибольшая частота достижения терапевтических концентраций наблюдалась в диапазоне дозировок 601–1200 мг/сут, которые применялись 50 % пациентов. По мере наращивания доз карбамазепина увеличилась частота передозировки: в дозах менее 600 мг/сут передозировки не было отмечено, тогда как в дозах более 600 и 1200 мг/сут их частота составила уже 1,3 и 4,1 % соответственно, причем частота передозировки по уровню Cmax – 8,8 и 18,4 % соответственно.
Таким образом, результаты проведенного ТЛМ карбамазепина в реальной практике показали, что индивидуальное дозирование препаратов карбамазепина труднопредсказуемо по достижении терапевтического диапазона концентраций. Несмотря на более высокую частоту достижения терапевтических концентраций по сравнению с использованием вальпроатов, диапазоны дозировок карбамазепина, обеспечивающие терапевтические, суб- и сверхтерапевтические концентрации, практически совпадают и имеют слишком широкий диапазон (200–2000). Поэтому число случаев недостижения терапевтических концентраций было в 2,5 раза меньше, а число случаев передозировки – в 10 раз больше по сравнению с применением вальпроатов. Кроме того, для карбамазепина оказалось существенным применение в комбинации с другими антиконвульсантами, с которыми наблюдаются фармакокинетические взаимодействия.
Заключение
Результаты данной работы отражают реальную практику применения антиконвульсантов пациентами с эпилепсией и важны для практического применения ТЛМ. Известно, что в 20–25 % не удается достигать клинической эффективности терапии пациентам с эпилепсией; часто имеют место как нежелательные реакции со стороны нервной системы, так и другие токсические эффекты (например, гепатотоксичность). ТЛМ является важным инструментом персонифицированного подхода к фармакотерапии антиконвульсантами в связи с наличием выраженной концентрационно зависимой эффективностью и безопасностью/токсичностью. ТЛМ позволяет объективизировать терапевтический уровень концентраций препаратов, контролировать безопасность, а также выявлять более сложные случаи, связанные с рефрактерностью к терапии, и проблемы фармакогенетического характера, требующие замены препаратов. Кроме того, в настоящее время имеется достаточно большой спектр препаратов и современных лекарственных форм вальпроевой кислоты и карбамазепина, созданных для оптимизации фармакотерапии пациентов с эпилепсией. Представляется важным понимание, насколько они в реальной практике улучшают результаты лечения и обеспечивают терапевтический диапазон концентраций. Повышение информированности специалистов о результатах ТЛМ в реальной практике имеет важное практическое значение для оптимизации фармакотерапии эпилепсии и способствует рациональному использованию ТЛМ.



