Введение
Иммунотерапия – метод воздействия на иммунную систему (ИС) с целью получения лечебного эффекта при различных заболеваниях. Являясь одним из самых старых методов системной противоопухолевой терапии, в последнее время она переживает новый подъем, связанный с разработкой ряда новых и перспективных подходов к лечению злокачественных опухолей. Открытие эффективных способов воздействия на иммунный синапс и внедрение в практику новых классов противоопухолевых препаратов, воздействующих на костимулирующие сигналы, – модуляторов иммунного синапса [1] позволило по-новому взглянуть на возможности иммунотерапии. В первую очередь речь идет об ингибиторах тормозных сигналов (immune checkpoint inhibitors), таких как CTLA-4 (ипилимумаб), PD-1 (ниволумаб, пембролизумаб) и PD-L1 (атезолизумаб, дурвалумаб). Именно с внедрением этих классов препаратов связаны значительные успехи в лечении диссеминированной меланомы кожи, в результате чего удалось не только существенно увеличить 2-летнюю общую выживаемость c 15 [2] до 64% [3], но и убедительно подтвердить возможность достижения длительных и стойких результатов после относительно короткого курса терапии [4]. Ингибиторы PD-1/PD-L1 позволили улучшить результаты терапии больных немелкоклеточным раком легкого без активирующих мутаций [5–7]. Достижения в лечении диссеминированных больных как при меланоме, так и при раке легкого были успешно транслированы в область адъювантной терапии этих заболеваний [8, 9]. Широкое и успешное применение модуляторов иммунного синапса при различных заболеваниях позволяет предполагать, что практически при любой злокачественной опухоли присутствует определенная группа пациентов, в отношении которых можно достичь длительного и стойкого эффекта, воздействуя на ИС пациента. Именно благодаря этому факту впервые в истории был зарегистрирован препарат для применения при любых опухолях, обладающих микросателлитной нестабильностью, вне зависимости от локализации первичной опухоли [10].
Современные представления о противоопухолевом иммунном ответе
Изучение взаимодействия опухоли и ИС началось практически с возникновения самого представления об иммунитете. Развитие и накопление знаний о различных компонентах ИС, изучение биологических свойств опухоли позволили сформировать современную концепцию взаимоотношений опухоли и ИС. На современном этапе выделяют три фазы взаимодействия опухоли и ИС [11]. На первой фазе (элиминации) ИС может уничтожить практически любую опухоль. Несмотря на происхождение опухоли из организма и общность многих антигенов, практически в любой опухоли присутствует значительное число неоантигенов. Даже в самой малоиммуногенной опухоли их обнаруживается около 100. В наиболее иммуногенных опухолях их число на несколько порядков выше [12]. Тем не менее изменчивость опухоли и селекция клонов под воздействием ИС позволяют злокачественным клеткам накапливать мутации и переходить к следующим фазам взаимодействия.
На второй фазе (равновесия) ИС может сдерживать опухолевый рост, но не в силах уничтожить все злокачественные клетки. Такое состояние равновесия, которое может длиться годами, фактически минимально необходимо для достижения противоопухолевого эффекта. Устойчивый переход к этому или предшествовавшему состоянию и служит целью всей иммунотерапии.
На третьей фазе (ускользания) опухоль приобретает механизмы эффективной защиты от ИС и, соответственно, способность к неограниченному росту. Интересно отметить, что на этой фазе сама ИС может поддерживать опухолевый рост, что было показано в ряде экспериментальных работ. Таким образом, в фазе ускользания опухоль приобретает некоторый контроль над ИС и становится ее регулятором, тогда как последняя подчас работает как необходимый фактор роста.
Основные свойства иммунотерапии
Описанные выше особенности взаимодействия опухоли и ИС во многом обусловливают основные принципы иммунотерапии. К ним могут быть отнесены универсальность, инертность, дуализм действия, а также комплексность направленного действия.
Универсальность действия иммунотерапевтических средств объясняется прежде всего тем, что ключевым действующим элементом всех препаратов данной группы является ИС, работа которой осуществляется на основе фиксированного перечня механизмов. Процесс развития иммунного ответа включает ряд важных этапов, представляющих собой мишени для терапевтических воздействий [13]. Первый этап характеризуется распознаванием и процессингом антигена, который осуществляется в антиген-презентирующих клетках. Именно на этом этапе происходит выбор тех эпитопов, которые могут быть распознаны ИС пациента и на которые как следствие может быть получен иммунный ответ. На втором этапе происходит передача информации о конкретном эпитопе эффекторным и регуляторным клеткам адаптивной ИС [14]. В этот момент осуществляется определение действия относительно данного антигена – элиминация или формирование толерантности. Эту задачу выполняют два типа поверхностных сигналов в особой временной структуре, формирующейся при межклеточных контактах иммунных клеток – иммунном синапсе. От результата этого взаимодействия зависят сила, эффективность и направленность иммунного ответа. На следующем этапе происходит процесс накопления эффекторных клеток и выполнение ими своих функций: продукция антител (В-клетки), осуществление цитотоксических реакций при взаимодействии с эпитопом при непосредственном контакте (Т-эффекторы) и регуляция процессов, происходящих в адаптивном и врожденном звеньях ИС при помощи цитокинов и межклеточных взаимодействий (Т-хелперы). Результат взаимодействия (уничтожение или сохранение эпитопа) определяется балансом провоспалительных и иммуносупрессирующих факторов в каждом из компартментов, в которых протекает вышеуказанный процесс (опухолевый очаг, перитуморальная зона, лимфатический узел или лимфоидноподобные структуры, кровь и лимфа), спектром поверхностных сигналов на клетке-мишени (включая регуляторные молекулы и антигенный спектр). Подобный процесс происходит при любом онкологическом заболевании. Соответственно, при воздействии на него с целью смещения баланса в сторону элиминации опухоли эффект будет зависеть не столько от самой опухоли, сколько от характера иммунологических отношений между опухолью и ИС конкретного больного.
Таким образом, считаем целесообразным объединение общих по механизму противоопухолевого действия противоопухолевых препаратов в следующие группы [1]:
- методы усиления презентации антигена (вакцины, генотерапия);
- методы модуляции активности иммунного синапса (ингибиторы CTLA-4, PD-1, PD-L1);
- методы воздействия на кинетику иммунных процессов (цитокины, неспецифические иммуномодуляторы);
- адаптивная терапия (клеточная, гуморальная);
- методы устранения иммуносупрессирующих факторов (например, эфферентная терапия);
- методы воздействия на опухоль с последующей активацией/индукцией иммунного ответа (виротерапия, физические методы, локальная терапия).

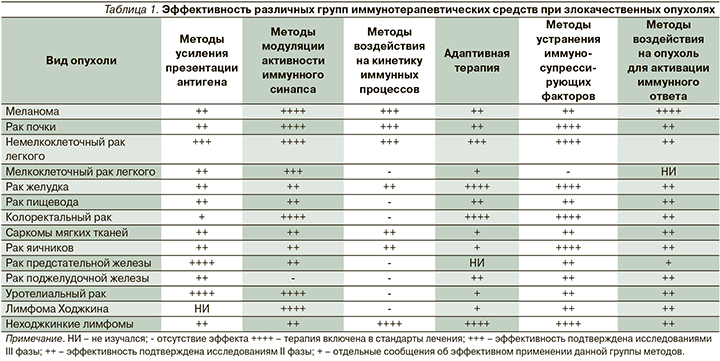
Эффективность применения этих подходов при разных злокачественных опухолях характеризуется особенностью механизма действия выбранной группы методов. Так, цитокины хорошо зарекомендовали себя при опухолях с высокой иммуногенностью, таких как меланома и рак почки, при которых впервые была доказана возможность излечения отдельных больных при применении коротких курсов иммунотерапии [15]. Вакцинотерапия изучалась при значительном количестве разных заболеваний и успела продемонстрировать возможность достижения длительных лечебных эффектов при минимальных нежелательных явлениях. Моноклональные антитела стали первой формой таргетной терапии, использующейся в настоящее время практически повсеместно. При этом иммунологический механизм действия составляет важную часть противоопухолевой активности [16]. Антиангиогенная терапия, активно внедрявшаяся в клиническую практику в первое десятилетие XXI в., также может рассматриваться как иммунотерапия. Это основывается как на форме самих препаратов (моноклональные антитела), так и на известных иммунокорригирующих влияниях этой группы лекарственных средств. Сам по себе VEGF является одним из важных иммуносупрессивных факторов, влияющих на эффективность противоопухолевого иммунного ответа [15]. Мультикиназные ингибиторы с антиангиогенной активностью оказывают существенное воздействие на иммунорегуляторные клетки, такие как миелоидные супрессивные клетки. Более того, наступление резистентности к такому лечению в значительной степени обусловлено потерей контроля над клетками ИС и над продукцией противовоспалительных цитокинов, таких как интерлейкин-8 (ИЛ-8), в опухолевом микроокружении [17]. Методы эфферентной терапии, направленные на устранение иммуносупрессирующих факторов из кровотока, также обладают умеренной противоопухолевой активностью и позволяют улучшать результаты применения стандартной противоопухолевой терапии [18]. Изучение как цитостатиков (например, препаратов платины), так и многих ингибиторов тирозинкиназ (например, ингибиторов BRAF) показало, что именно иммунологический компонент действия обеспечивает поддержание длительных эффектов терапии данными препаратами [19]. Успехи внутриопухолевого введения ряда препаратов, прежде всего виротерапии, при которой удавалось индуцировать системный иммунный ответ на локальное воздействие, убедительно демонстрируют активность данной стратегии иммунотерапии.
Краткий формат данной статьи не позволяет привести все примеры эффективности разных классов иммунотерапевтических средств при различных злокачественных опухолях. Для наглядности сведения об эффективности различных методов иммунотерапии при злокачественных опухолях представлены в табл. 1. Важным следствием такой универсальности является возможность распространения описываемых свойств иммунотерапии на различные заболевания, что позволяет лучше и более наглядно объяснять их.
Универсальностью действия объясняется также и относительная общность нежелательных явлений, развивающихся на фоне проведения иммунотерапии, о которых более подробно будет написано ниже.
Инертность действия объясняется, прежде всего, вышеописанным процессом развития иммунного ответа. Несмотря на то что от некоторых пациентов, как правило с предсуществующим иммунным ответом на опухоль-ассоциированные антигены, удается получить крайне быстрый ответ на лекарственное лечение, в большинстве случаев процесс активации ИС требует длительного времени – от нескольких недель до нескольких месяцев. Кроме того, феномен иммунологической памяти поддерживает и ускоряет развитие сходных иммунных ответных реакций. Данное утверждение справедливо в отношении как противоинфекционного, так и противоопухолевого иммунитета. Тот же фактор работает для иммуноопосредованных нежелательных явлений, особенно при повторных линиях иммунотерапии. Инертность действия ИС часто приводит к отсрочке в развитии как противоопухолевого эффекта, так и нежелательных явлений терапии (о которых будет сказано ниже). И если при мониторинге развития нежелательных явлений нужно лишь учитывать возможность отдаленных последствий, то при оценке ответа на терапию ситуация более сложная.

Необходимость оценки ответа на терапию происходит из ограниченной эффективности всех существующих методов лекарственного лечения злокачественных опухолей. При неэффективности терапии логично изменение лечебной тактики. Трудность оценки результатов лечения больных с отсутствием либо полного регресса, либо бурного прогрессирования процесса, а также потребность в сравнении результатов исследований различных противоопухолевых препаратов привели к идее разработки унифицированной системы оценки эффекта. Наиболее сложной частью оценки эффекта является зона отсутствия различий в результатах исследования. Действительно, измеряя один и тот же объект, мы можем получать не один и тот же результат, а диапазон значений. Такая вариабельность будет присутствовать при измерении и одним человеком, и различными исследователями. Ряд исследований, проведенных в данном направлении и обобщенных в работе S.H. Yoon et al. [20], показал, что ошибка измерений при использовании компьютерной томографии составляет от -30 до +25%. Исходя из подобных расчетов и их переложения на два измерения, были установлены границы стабилизации процесса, т.е. тех изменений, при которых нельзя отличить ошибку измерения от истинной динамики размеров очагов. Развитие систем оценки и стремление к однозначной интерпретации данных показали, что наиболее точная оценка возможна при уменьшении количества оцениваемых очагов до 5 и количества измерений до 1. Вместе с тем инертность ответа на иммунотерапию потребовала принципиального пересмотра некоторых положений данной оценки. В работе J. Wolchock et al. [21] впервые описаны нестандартные паттерны ответа на лечение, когда у небольшой части пациентов после временного увеличения размера и количества очагов позже наступал выраженный эффект без изменения режима терапии или вовсе без всякого лечения. Такой феномен был назван псевдопрогрессированием. Предложенная авторами система irRC пыталась учесть этот феномен, добавив новые очаги к ранее существовавшей массе и оценив показатель опухолевой нагрузки. Новых мелких очагов при этом был недостаточно для установления прогрессирования процесса. Такая система позволила успешно выявить группу больных среди пациентов с прогрессированием по системе RECIST, выживаемость которых приближалась к таковой пациентов со стабилизацией процесса и значимо отличалась от больных с прогрессированием. Дальнейшие исследования и развитие этой системы, равно как и адаптация системы RECIST к иммунотерапевтическим подходам, привели к независимому созданию нескольких новых систем оценки (рис. 1).
Необходимо отметить, что системы оценки частоты ответа на лечение созданы для единообразной оценки частоты объективных эффектов и обеспечения возможности непрямого сравнения разных исследований.
В клинической практике вопрос о наличии или отсутствии пользы от лечения гораздо более сложный. Практической разницы между увеличением опухолевой нагрузки на 19 или 21% не существует. Многим клиницистам известны случаи выраженного клинического прогрессирования, тогда как, по радиологическим данным, такого не случалось.
В противоположность, иногда даже значительное увеличение размеров очагов не сопровождается клинической симптоматикой и, скорее, отражает замедленный рост опухоли на фоне лечения. В нашей собственной практике наблюдался следующий клинический случай, хорошо иллюстрирующий данный тезис. Пациентке 33 лет с бифазной синовиальной саркомой после неэффективности 1-й линии лечения по схеме AI проведена 2-я линия терапии с использованием аутологичной ДК-вакцины, разработанной в НМИЦ онкологии им. Н.Н. Петрова. На фоне лечения отмечен неуклонный рост очагов: через 2 месяца +30%, через 12 месяцев +180%, однако общее состояние больной улучшалось, росла физическая активность. Лечение продолжалось до появления клинических признаков прогрессирования, которое случилось лишь через 2 года после выявления первых радиологических признаков прогрессирования процесса. Добавление к лечению стандартной терапии 3-й линии (дакарбазин+гемцитабин) позволило вновь вернуть контроль над заболеванием.
Гомеостатическая функция ИС и масса различных механизмов, обеспечивающих ее как на клеточном, так и на молекулярном уровне, приводят к многочисленным (комплексным) реакциям на одинаковые воздействия. Такая работа требует сложных систем обратной связи и возможности оказывать прямо противоположные воздействия для сохранения определенного состояния внутренней среды организма. Целенаправленно воздействуя на отдельные звенья ИС, мы, тем не менее, затрагиваем всю систему в разной степени. Таким образом, проявляется комплексность направленного действия ИС. Направление же воздействия подчас может быть противоположным. Так, попытки воздействия на опухоль с целью ее подавления могут приводить у некоторых больных к росту и повышению злокачественности опухоли. С другой стороны, даже высокоизбирательное воздействие на опухоль может приводить к развитию иммуноопосредованных нежелательных явлений. Этим проявляется дуализм действия ИС. Следствием этих свойств иммунотерапии является ряд важных особенностей действия иммуноонкологических препаратов. Это, в первую очередь, возможность развития самоподдерживающихся эффектов иммунотерапии, т.е. ее действие после окончания лечения, в т.ч. влияние на эффективность последующих методов лечения. Второй важной особенностью служит аддитивный характер действия препаратов. Третья особенность – развитие иммуноопосредованных нежелательных явлений (иНЯ) и гиперпрогрессирования опухолевого процесса.
Возможность достижения длительных и стойких эффектов терапии была впервые показана при применении высоких доз ИЛ-2 [15]. После краткого курса терапии – фактически двух пятидневных циклов с интервалом в 14 дней, удавалось достигать полного регресса у небольшой части пациентов – всего около 5%, однако эти эффекты сохранялись в течение длительного времени. По данным S. Rosenberg et al., у больных диссеминированной меланомой кожи и метастатическим раком почки, переживших без прогрессирования 3 года, вероятность развития в дальнейшем такого события была минимальной даже при наблюдении за больными более 20 лет. Похожие результаты были получены при терапии ипилимумабом метастатической меланомы. В пулированном анализе, проведенном D. Schadendorf et al. [4], после 4 введений препарата (занимающих 3 месяца) 20% пациентов удавалось достигать стойких эффектов.
И вновь в отсутствие прогрессирования в течение 3 лет кривая выживаемости вышла на плато и сохранялась почти неизменной при 10-летнем наблюдении. Высокое качество достигнутых эффектов подтверждается и при применении других модуляторов иммунного синапса при разных заболеваниях: пембролизумаба [22], ниволумаба [23], атезолизумаба [24], дурвалумаба [25]. Таким образом, успешная индукция противоопухолевого иммунного ответа способна поставить вопрос о возможности излечения некоторых видов распространенных опухолей.
Отсроченное действие иммунотерапии может проявляться и во влиянии предшествовавшего лечения на эффективность последующих режимов терапии. Наиболее наглядно исследование СheckMate 064 [26], в котором применение ниволумаба перед ипилимумабом оказалось более эффективным, чем обратная последовательность. В другом исследовании, NEMO, предшествовавшая таргетная терапия увеличивала эффективность применения MEK ингибитора биниметиниба у больных NRAS-мутированной меланомой кожи [27]. В наших собственных исследованиях применение ипилимумаба оказалось более эффективным для больных, ранее получавших несколько линий иммунотерапии. Применение в анамнезе вакцин увеличивало эффективность данного препарата почти в 2 раза: относительный риск смерти пациентов через 3 года в нашем исследовании составил 0,52 (р=0,049). Похожие данные были получены M. Lotem et al., где частота объективных ответов со стороны больных, получавших вакцинотерапию, возросла с 20 до 38%, медиана общей выживаемости увеличилась с 0 до 31 месяца, 3-летняя общая выживаемость – с 19 до 46% [28].
Возможность аддитивного действия иммуноонкологических препаратов показана для многих методов терапии. Известно, что моноклональные антитела увеличивают эффективность стандартных режимов терапии и являются общепризнанным стандартом лечения для таких заболеваний, как колоректальный рак, рак молочной железы, В-клеточные лимфомы, рак легкого, рак желудка, рак яичников и др. [15]. Сочетанное применение PD-1- и CTLA4-ингибиторов также превосходит монотерапию данными препаратами, по крайней мере для отдельных категорий пациентов [3]. Перспективным может быть сочетанное применение цитокинов и модуляторов иммунного синапса. Химиоиммунотерапия также показала свое превосходство над монохимиотерапией меланомы кожи [29]. Сочетание иммуноонкологических подходов и низкомолекулярных мультикиназных ингибиторов активно изучается в настоящее время. Эффективность иммунотерапии в качестве адъювантного лечения меланомы кожи [9] и рака легкого [8] подчеркивает возможность широкого использования аддитивных свойств имунотерапевтических подходов. Таким образом, включение иммунотерапевтических методов в качестве компонента комплексного лечения злокачественных опухолей представляется оправданной стратегией.
К сожалению, дуализм действия иммунотерапии приводит и к ряду нежелательных последствий. Под иНЯ понимается нежелательное явление, обусловленное избыточной активацией иммунной системы и не являющееся основной целью применения метода иммунотерапии. Феномен гиперпрогрессирования в подобном контексте обычно не рассматривается, однако полностью соответствует данному определению.
Примеры гиперпрогрессирования при различных методах иммунотерапии известны уже давно. Нами были описаны примеры таких реакций в ответ на терапию ИЛ-2 больного меланомой кожи [30]. В обзоре Q. Wang et al. суммированы данные по феномену гиперпрогрессирования при применении ингибиторов PD-1 и CTLA-4 [31]. Если рассматривать результаты всех современных исследований по иммунотерапии, то очевидно, что существует значительная группа больных, ускоренно прогрессирующих на иммунотерапевтическом лечении. Наиболее наглядно это наблюдается при применении PD-1-ингибиторов больными уротелиальным раком, где в течение первых 3 месяцев эффективность лечения значительно уступает химиотерапии, а на фазе длительного наблюдения значительно ее превосходит [32]. Несмотря на отдельные успешные попытки выделить группу больных с потенциальным гиперпрогрессированием на фоне терапии, этот вопрос до сих пор остается окончательно не решенным и требует от врача большого внимания и учета многочисленного количества факторов, таких как состояние больного, скорость роста опухоли, ее агрессивность, распространенность процесса, и многих других для принятия решения о начале терапии иммуноонкологическими препаратами.
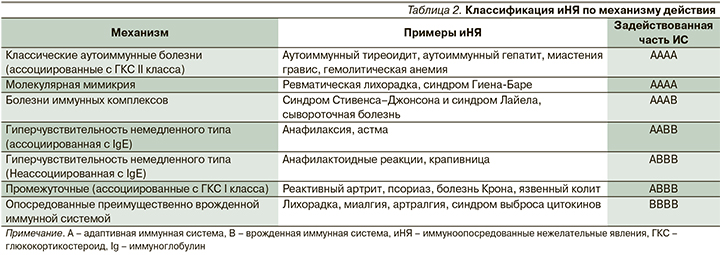
Собственно, иНЯ иммуноонкологических препаратов могут затронуть практически любой орган и систему. Вместе с тем, наиболее частыми среди этих нежелательных явлений являются общие симптомы (лихорадка, слабость, миалгии), поражения кожи (сыпи) и кишечника (дирея, колит). На сегодняшний день считается общепризнанным тот факт, что многие подобные иНЯ не учитываются врачами и их частота, даже в контролируемых исследованиях, существенно занижена [33]. Механизм развития подобных нежелательных явлений весьма различен. Однако, благодаря универсальности действия иммунотерапии клинические проявления отдельных нежелательных явлений весьма схожи при разных методах лечения. Если применить классификацию иНЯ, разработанную для вакцин [34], к иммуноонкологическим препаратам, можно выделить ряд схожих по механизму действия группы иНЯ (табл. 2).
Общность механизмов развития иНЯ позволяет разработать эффективные алгоритмы контроля над ними. Обобщенные рекомендации по контролю над иНЯ были разработаны группой экспертов под эгидой RUSSCO в 2017 г. [35]. Данные рекомендации базируются на ряде общих принципов, позволяющих управлять подобными НЯ.
Первый принцип – это ступенчатая терапия. Начальная ступень выбирается исходя из тяжести развившегося иНЯ, переход на более высокие ступени осуществляется при неэффективности проводимой терапии. Понижение терапии на более низкую ступень не осуществляется, отмена лечения происходит постепенно и медленно при условии значительного улучшения симптомов иНЯ. Данный принцип заимствован из алгоритмов лечения многих аутоиммунных болезней, где показал свою эффективность. Общность механизмов развития иНЯ и аутоимунных заболеваний дает основание для использования такого подхода.
Второй принцип – это применение иммуносупрессивных средств. За исключением симптоматической терапии при наименее тяжелых иНЯ и тех, что обусловлены в основном врожденной ИС, основу лечения таких побочных эффектов составляют глюкокортикостероиды. При этом могут использоваться любые препараты в эквивалентных дозах. Лишь при неэффективности такого подхода прибегают к более сильным иммуносупрессивным средствам, представляющим собой ингибиторы ИЛ-6 и фактора некроза опухолей (например, инфликсимаб) или (что значительно реже) цитостатики, такие как циклофосфамид или микофенолата мофетил. Алгоритмы применения подобной терапии индивидуализированы для ряда наиболее частых иНЯ.
Третьим принципом контроля за иНЯ является их независимость от дозы иммунотерапевтического средства. Так, лишь обусловленные выбросом цитокинов иНЯ дозозависимы и могут контролироваться путем снижения дозировки вызвавшего их препарата. Короткая полужизнь данных регуляторных молекул и гомеостатическая работа ИС позволяют успешно преодолевать эти иНЯ при своевременном вмешательстве. Подключение же клеточных механизмов при данных синдромах чревато развитием серьезных и плохо контролируемых осложнений, таких как синдром повышенной проницаемости капилляров. В остальных группах иНЯ, вызвавшее их иммунотерапевтическое средство, может являться лишь триггером или фактором, смещающим равновесное состояния системы в патологическую сторону. Поэтому при таких явлениях требуется более раннее и более интенсивное иммуносупрессивное воздействие, которое иногда само по себе вызывает осложнения, такие как инфекции, стероидные язвы, нарушения электролитного обмена, эндокринопатии и др. По этой причине, за исключением интерферона-альфа и блинатумомаба, дозы иммунотерапевтических средств не редуцируются в зависимости от развития иНЯ. Терапия либо продолжается в прежних дозах, либо полностью отменяется (в случае выраженного иНЯ или недостаточного контроля за ними).
Обобщенный алгоритм терапии иНЯ представлен на рис. 2.
Заключение
Иммунотерапия представляет собой наиболее перспективный метод лечения злокачественных опухолей, обладающий уникальными свойствами и особенностями. Их знание и использование при проведении терапии иммуноонкологическими препаратами позволят оптимизировать применение данной группы лекарственных средств и максимально обезопасить пациента от возможных нежелательных явлений, связанных с их применением.



