Введение
Ишемический инсульт является одной из ведущих причин инвалидизации мужчин трудоспособного возраста. Факторы риска, приводящие к инсульту, имеют гендерные и возрастные особенности. У мужчин в качестве одного из рисков рассматривается возрастное снижение уровней общего и свободного тестостерона. Этой проблеме посвящен ряд исследований. Однако по сравнению с такими распространенными факторами риска, как артериальная гипертензия, дислипидемия, фибрилляция предсердий, сахарный диабет и др., проблема возрастного приобретенного андрогено-дефицита у пациентов с инсультом изучена недостаточно.
Андрогенный дефицит – биохимический синдром, характеризующийся недостаточностью андрогенов в сыворотке крови, сопровождающейся или не сопровождающейся снижением чувствительности организма к андрогенам. Тестостерон наряду с андрогенными эффектами способен оказывать мощное анаболическое действие на различные ткани человека. Доказано, что тестостерон поддерживает мышечную массу, препятствует развитию ожирения и атеросклероза, укрепляет кости, стимулирует выработку эритроцитов, а также регулирует работу почек, печени, потовых и сальных желез. Биологическое действие тестостерона определяется не только его абсолютным уровнем в крови, но и уровнем чувствительности тканей, органов-мишеней и их ответной реакцией. Так, в отличие от здоровых мужчин содержание тестостерона в крови мужчин, страдающих различной соматической патологией, в аналогичном возрасте значительно ниже.
Следует отметить, что точный порог для определения «низкого» уровня тестостерона является предметом споров. Было предложено пороговое значение 10,4 нмоль/л, ниже которого можно рассматривать диагноз дефицита андрогенов [1]. Согласно имеющимся на сегодняшний день рекомендациям, мужчинам с общим уровнем тестостерона выше 12 нмоль/л, как правило, не требуется гормонзаместительная терапия, тогда как мужчинам с уровнем постоянно ниже 8 нмоль/л следует рассматривать возможность лечения тестостероном [2].
Установлено, что снижение уровня тестостерона в крови начинается с 35 лет, при этом концентрация общего тестостерона уменьшается на 0,8%, а свободного – на 2% в год. Клинические признаки дефицита андрогенов обычно проявляются после 40–45 лет, в возрасте 55 лет распространенность данного состояния в популяции мужчин может достигать 50% [3].
Это возрастное гормональное изменение мужского организма представляет интерес, поскольку приводит к прогрессированию различной соматической патологии. Доказано, что концентрации общего тестостерона имеют отрицательную корреляцию с систолическим артериальным давлением и массой миокарда левого желудочка [4]. Кроме того, более низкие концентрации тестостерона связаны с увеличением частоты метаболического синдрома и диабета 2 типа у мужчин среднего и старшего возраста [5, 6].
Снижение концентрации тестостерона характерно для больных сахарным диабетом [7]. При СД2, особенно у тучных пациентов, нередко наблюдается пониженное содержание свободного и общего тестостерона, не связанное с течением болезни. Андрогены могут непосредственно влиять на метаболизм глюкозы и развитие резистентности к инсулину независимо от эффектов ожирения [7, 8].
Выявлена обратная корреляция между концентрацией тестостерона и окружностью талии [9]. Положительная корреляция установлена между уровнем тестостерона и ЛПВП, отрицательная – между содержанием в сыворотке тестостерона и общего холестерина, ЛПНП [10].
Есть такие данные: более низкие уровни тестостерона связаны с толщиной комплекса интима-медиа сонных артерий, заболеванием периферических артерий нижних конечностей и атеросклерозом аорты [11, 12].
В исследованиях показана связь низкого уровня тестостерона и риском развития коронарной патологии, включая инфаркт миокарда [7], а у больных острым инфарктом миокарда низкие значения тестостерона ассоциируются с худшим прогнозом заболевания [13].
В ряде исследований получена прямая достоверная связь между низким уровнем тестостерона у мужчин и риском развития инсульта [7, 14].
Мета-анализ 5 исследований, включивших 7752 пациента с инсультом, у которых в анамнезе был инсульт или транзиторная ишемическая атака, показал, что метаболический синдром может быть важным предиктором повторного инсульта. В структуре метаболических нарушений рассматривался и низкий уровень тестостерона у мужчин. Сила связи всех метаболических нарушений и инсульта была выше, чем у отдельных компонентов метаболического синдрома (повышенное артериальное давление, повышенный уровень триглицеридов, холестерина, липопротеинов низкой плотности, ожирение, приобретенный андрогенодефицит). Среди рассмотренных компонентов метаболического синдрома повышенная гликемия была наиболее сильным предиктором повторного инсульта [15]
Однако неясно, являются ли более низкие уровни тестостерона независимым предиктором заболеваемости и смертности от сердечно-сосудистых заболеваний. В ряде исследований мужчин среднего и пожилого возраста низкие концентрации общего или свободного тестостерона были связаны с более высокой общей смертностью и смертностью от сердечно-сосудистых, онкологических и респираторных причин [16, 17]. Однако в других исследованиях сообщалось об отрицательных или противоречивых результатах [18]. Возможно, что низкий уровень тестостерона может быть маркером, а не причиной последующего ухудшения состояния здоровья у пожилых мужчин, что может объяснить его связь с общей смертностью, а не с заболеваемостью и смертностью из-за сердечно-сосудистых заболеваний. Существующие рандомизированные исследования терапии тестостероном у мужчин не были разработаны или рассчитаны на выявление связанных с лечением различий в сердечно-сосудистых исходах [19]. Таким образом, дополнительные данные, отвечающие на ключевой вопрос, являются ли более низкие концентрации тестостерона независимым значимым фактором риска сосудистых событий, могли бы иметь значение при планировании лечебных и профилактических мероприятий.
Проведено комплексное клинико-лабораторное исследование пациен-тов – мужчин среднего возраста с впервые возникшим полушарным ишемическим инсультом – с целью выявления у них распространенности приобретенного андрогенного дефицита и метаболического синдрома как значимых факторов риска инсульта.
Цель исследования: выявить распространенность приобретенного андрогенного дефицита и метаболического синдрома как значимых факторов риска инсульта у мужчин.
Методы
Под наблюдением находились 154 пациента (мужчины, средний возраст – 51,5+7,5 лет) с полушарным ишемическим инсультом, проходивших лечение на клинической базе кафедры неврологии, нейрохирургии и медицинской генетики ЛФ ФГАОУ ВО РНИМУ им. Н.М. Пирогова. Контрольную группу составили 90 мужчин, проходивших лечение в отделении травматологи, практически здоровых по результатам обследования, (средний возраст – 48,4±5,6 года).
Критерии включения в исследование: возраст 40–60 лет, впервые развившийся полушарный ишемический инсульт, подписание информированного согласия.
Критерии исключения: возраст старше 60 лет, онкологические заболевания, выраженные нарушения функции почек и печени, врожденная патология, сопровождающаяся гипогонадизмом.
Ишемический характер инсульта подтверждали клиническими критериями и данными нейровизуализации. Патогенетический вариант инсульта устанавливали на основании результатов лабораторных и инструментальных методов исследования. Для определения тяжести состояния, выраженности очагового неврологического дефицита и оценки динамики клинических показателей использовали балльную шкалу инсульта Национального института здоровья (NIHSS). Степень функционального восстановления определяли по модифицированной шкале Рэнкина. Кроме того, изучали распространенность и клинические характеристики синдрома возрастного дефицита андрогенов с использованием стандартной международной анкеты «Опросник симптомов старения мужчины» (AMS – Aging Male Screening). Вопросы анкеты позволяли выявлять психологические, соматические и сексуальные проблемы пациента. Симптомы дефицита андрогенов считали невыраженными при количестве баллов от 17 до 26, слабовыраженными – от 27 до 36, средней выраженности – от 37 до 49, выраженными – при сумме баллов более 50. Исследование андрогенного статуса включало клиническую оценку дефицита андрогенов и его лабораторное подтверждение. Для выявления метаболического синдрома у всех пациентов исследовали уровень артериального давления, индекс массы тела и уровень депрессии как одно из проявлений андрогенодефицита по шкале Бека. Все пациенты консультированы кардиологом и эндокринологом. Тщательно проанализирован анамнез времени появления первых клинических признаков андрогенного дефицита, давности и уровня артериальной гипертензии, сахарного диабета, повышения массы тела. Наблюдение за пациентами продолжалось на протяжении 2 лет с контрольными визитами/телефонными беседами раз в 6 месяцев.
Статистическую обработку полученных данных проводили с использованием пакета программ “IBM SPSS Statistics version 19”, программного обеспечения MS Excel 2019 (Microsoft) и программы GraphPad InStat3.1 Достоверными считали значения p<0,05. Для сравнительного анализа среднего уровня тестостерона у пациентов использовали однофакторный дисперсионный анализ. Достоверными считали значения p<0,05.
Результаты
При анализе патогенетических вариантов в соответствии с критериями TOAST у 38% пациентов диагностирован атеротромботический патогенетический вариант инсульта, у 21% – кардиоэмболический, у 23% – лакунарный, у 18% – инсульт неясной этиологии.
При анализе клинико-лабораторных данных установлено, что все пациенты имели атеросклеротическое поражение сосудов различной степени выраженности, подтвержденное ультразвуковыми методами исследования. У 99 (64%) пациентов имела место ишемическая болезнь сердца, подтвержденная данными электрокардиографии, заключением кардиолога, у 17 (11 %) – инфаркт миокарда в анамнезе. У 18% больных развитию инсульта предшествовали транзиторные ишемические атаки в том же сосудистом бассейне. Все пациенты страдали артериальной гипертензией не менее 5 лет. Более половины из них не получали адекватной гипотензивной терапии.
На момент развития ишемического инсульта клинические симптомы дефицита андрогенов, по данным анкеты AMS, отмечены практически у всех обследованных пациентов. Причем преобладали мужчины со средней (25%) и выраженной (57,6%) клинической симптоматикой приобретенного андрогенодефицита. В контрольной группе мужчин без инсульта клинические симптомы дефицита андрогенов, по данным анкеты AMS, выявлены менее, чем у четверти исследуемых, причем преобладали симптомы легкой недостаточности (рис. 1).
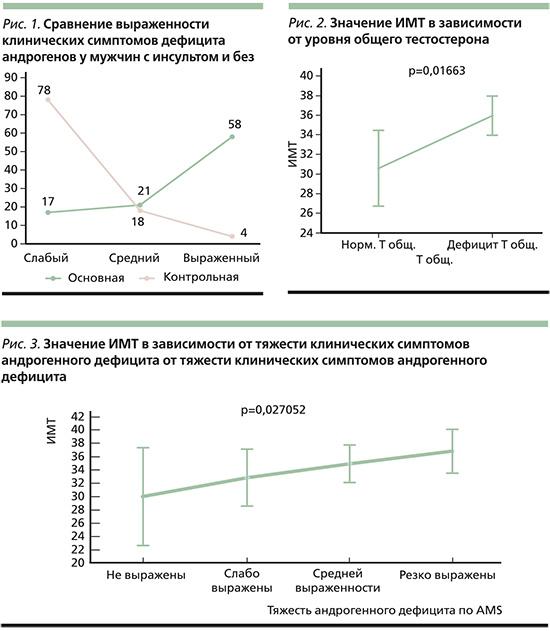
Лабораторно дефицит андрогенов выявлен у 102 из 154 мужчин, что составило 66,3%. При этом при нарастании тяжести клинических симптомов андрогенного дефицита, по данным анкеты AMS, процент лабораторного подтверждения синдрома возрастал.
Следует отметить, что дефицит андрогенов у пациентов с сахарным диабетом встречался в 2 раза чаще, чем у пациентов без него (50 против 26%). Дальнейший анализ проводили больным с симптомами андрогенодефицита.
Проанализированы показатели андрогенового статуса больных в зависимости от патогенетического варианта инсульта. При анализе результатов достоверных различий уровней общего и свободного тестостеронов в зависимости от патогенетического варианта инсульта выявлено не было. Следует отметить тенденцию к более низким показателям общего и свободного тестостерона у больных атеротромботическим патогенетическим вариантом инсульта. Что может отражать влияние низкого уровня тестостерона на риск развития эндотелиальной дисфункции и атеросклероза [20].
При анализе показателей артериального давления установлено, что на момент поступления в стационар средний уровень систолического АД (САД) у пациентов составил 167,8+7,2 мм рт.ст., диастолического (ДАД) 93,8+4,2 мм рт.ст., при этом в контрольной группе показатели САД – 132+5,2, ДАД – 78+6,4 мм рт.ст.
Во время визитов проводили контрольное взвешивание пациентов. Практически все из них имели превышение массы тела по сравнению с возрастной нормой. Индекс массы тела (ИМТ) вычисляли по формуле: ИМТ= ес (кг)/{рост (м)}2 значения которой соответствуют следующим параметрам: норма – 20,0–25,9; избыток массы тела – 26,0–27,9; ожирение I степени – 28,0–30,9; ожирение II степени – 31,0–35,9.
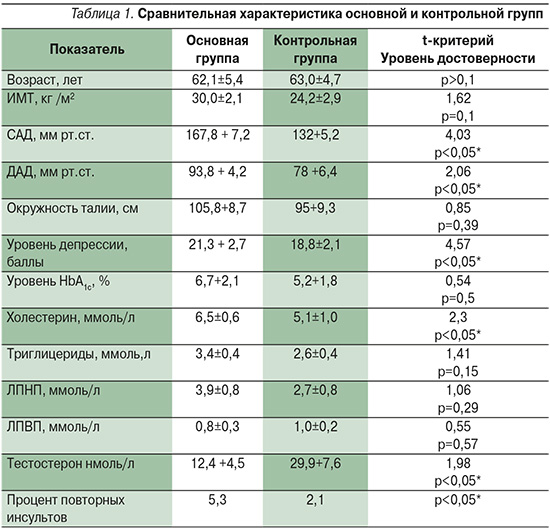
Индекс массы тела на момент поступления в основной группе составил 30,0+2,1 кг/м, в контрольной – 24,2+2,9 кг/м. При этом ИМТ напрямую зависел от уровня дефицита общего тестостерона. При нарастании дефицита тестостерона повышался индекс массы тела, соответственно, нарастал риск сосудистой патологии (рис. 2).
Помимо расчета ИМТ пациентам основной и контрольной групп измеряли объем талии, который составил 105,8±8,7 и 95±9,3 см соответственно.
Выраженная клиническая симптоматика андрогенного дефицита и низкий уровень Тс свободного сопровождались большим увеличением ИМТ (рис. 3).
У пациентов оценивали уровень депрессии как одного из клинических проявлений андрогенодефицита по клинической шкале Бека. На момент поступления в основной группе уровень депрессии по шкале Бека был равен 21,3+2,7 балла, в контрольной – 20,8+3,1.
Был проведен анализ уровня липидов сыворотки крови и гликированного гемоглобина (HbA1c).
Основные клинические и лабораторные показатели основной и контрольной групп представлены в табл. 1. Результаты проведенного исследования показали достоверное преобладание клинических признаков метаболического синдрома в группе пациентов с ишемическим инсультом и андрогенодефицитом по сравнению со здоровыми мужчинами одной возрастной категории.
Спустя 2 года наблюдения частота инсультов в основной и контрольной группах составила 5,3 и 2,1% соответственно.
Заключение
Таким образом, результаты проведенного исследования показывают, что дефицит андрогенов у мужчин среднего возраста входит в структуру метаболического синдрома наряду с такими компонентами, как артериальная гипертензия, нарушение толерантности к глюкозе, дислипидемия, ожирение, являющимися в свою очередь ведущими факторами риска ишемического инсульта [21].
Таким образом, наши данные подтверждают роль низкой концентрации тестостерона в развитии повышенного сердечно-сосудистого риска у мужчин среднего возраста и согласуются с данными литературы.
В качестве предполагаемых механизмов, с помощью которых низкие уровни тестостерона могут способствовать увеличению бремени сердечно-сосудистых заболеваний, рассматривают потерю полезных эффектов тестостерона на функцию эндотелия и обмен липидов. А также, поскольку тестостерон регулирует активность ренальной цистатионин-синтазы как один из возможных механизмов сосудистых нарушений при снижении уровня тестостерона рассматривается гипергомоцистеинемия с известными проатерогенными эффектами [22].
Необходимы дальнейшие исследования для проверки гипотезы о том, что гормонозаместительная терапия тестостероном-ундекоанатом пожилых мужчин может защитить от инсульта и ТИА.



