Обоснование
Системой, координирующей взаимодействие организма с внешней средой, является циркадианная система. Основной внутренний регулятор этой системы – мелатонин. Вырабатываясь в эпифизе и взаимодействуя со своими G-белковыми рецепторами MT-1 и MT-2, которые кодируются генами MTNR1A, MTNR1B и находятся в ряде центральных областей центральной нервной системы, медиально-базальном гипоталамусе, а также в жировой ткани, островках поджелудочной железы, печени, мелатонин рассматривается как регулятор сна и различных метаболических процессов [1]. С одной стороны, т.н. световая загрязненность, просмотр компьютеров и смартфонов перед сном и широкое распространение сменной работы нарушают физиологическую выработку мелатонина, приводя к нарушениям не только сна, но и различных видов обменов веществ [1]. Но, с другой стороны, наличие полиморфизмов генов, кодирующих мелатониновые рецепторы, также ассоциировано с повышением риска сахарного диабета 2 типа. Этот факт установлен в генетических исследованиях последних лет [2]. Влияние мелатонина и нарушения циркадианных ритмов также изучаются в связи с развитием различных заболеваний, в т.ч. рассеянного склероза (РС) [3]. Развитие гипергликемии, дислипидемии, инсомнии часто сопровождает применение глюкокортикостероидов (ГКС), требующееся при обострениях РС, что повышает риски метаболических нарушений в популяции пациентов [4, 5].
Цель исследования: установить ассоциацию однонуклеотидных полиморфизмов генов мелатониновых рецепторов MTNR1A (rs34532313), MTNR1B (rs10830963) с возникновением инсомнии, ее тяжестью, а также метаболическими нарушениями на фоне пульс-терапии ГКС у пациентов с РС.
Методы
Исследование проведено на базе клиники ФГБОУ ВО РостГМУ Минздрава РФ. Включены 80 пациентов с РС, которые наблюдались с момента поступления в неврологическое отделение до момента выписки. Оценивались метаболические параметры (липидограмма, глюкоза крови натощак), индекс тяжести инсомнии (ISI – Insomnia Severity Index), факт наличия бессонницы устанавливался при числе баллов по ISI более 10. Параметры оценены до старта ГКС-терапии, а также на фоне пульс-терапии. Проведено определение полиморфных вариантов гена MTNR1A (rs34532313) и MTNR1B (rs10830963).
Критерии включения в исследование: установленный диагноз РС, пульс-терапия ГКС по поводу основного заболевания. Критерии исключения: возраст <18 и >60 лет, наличие онкологической патологии на момент исследования, больные после оперативных вмешательств на органах желудочно-кишечного тракта, наркомания или алкоголизм, психические нарушения, а также отказ пациента от участия в исследовании.
Пациенты получали пульс-терапию метилпреднизолоном по поводу обострения РС. Генотипирование проводилось на базе кафедры генетики ЮФУ. Исследование выполнялось в период с августа 2021 по август 2022 г.
Выделение дизоксирибонуклеиновой кислоты (ДНК) выполнено из лейкоцитов периферической крови. Анализ полиморфизмов проводился с помощью полимеразной цепной реакции в режиме реального времени на амплификаторе RotorGene с использованием набора реагентов компании «Синтол».
Основными исходами исследования стали нарушение сна, гипергликемия и дислипидемия в результате применения ГКС.
Сформированы подгруппы сравнения в зависимости от генотипов MTNR1A (rs34532313) и MTNR1B (rs10830963), а также в зависимости от наличия полиморфного аллеля: пациенты с неизмененным генотипом и с мутантным аллелем описанных вариантов генов.
Получено одобрение локального этического комитета ФГБОУ ВО РостГМУ Минздрава России (протокол № 22 от 20.09.2020). Статистический анализ проводился с использованием программы StatTech v. 3.0.9 (ООО «Статтех», Россия).
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50).
Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (ДИ). В отсутствие нормального распределения количественные данные описывались с помощью медианы (Me), нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей.
Сравнение двух групп по количественному показателю, имевшему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение трех и более групп по количественному показателю, имевшему нормальное распределение, выполнялось с помощью однофакторного дисперсионного анализа, апостериорные сравнения проводились с помощью критерия Тьюки (при условии равенства дисперсий). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью χ2-критерия Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью χ2-критерия Пирсона.
При сравнении нормально распределенных количественных показателей, рассчитанных для двух связанных выборок, использовался парный t-критерий Стьюдента. При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовался критерий Уилкоксона. Сравнение бинарных показателей, характеризовавших 2 связанные совокупности, выполнялось с помощью теста МакНемара.
Результаты
В рамках пульс-терапии ГКС 80 пациентов (71,2% женщины) получали 4 (3–4) г метилпреднизолона. Средний возраст составил 36,26±10,03 года, продолжительность РС – 6 (2,75–10,00) лет, оценка степени инвалидизации по шкале Куртцке (EDSS) – 2,5 (2,00–3,12) года. Структура распределения генотипов и аллелей полиморфизмов MTNR1A (rs34532313) и MTNR1B (rs10830963) представлена в табл. 1.
Анализ динамики уровня общего холестерина в зависимости от полиморфного аллеля rs10830963 гена MTNR1B представлен в табл. 2.
Результаты динамики содержания липопротеидов низкой плотности (ЛПНП) до и после терапии ГКС в зависимости от носительства аллелей полиморфного варианта rs10830963 гена MTNR1B представлена в табл. 3.
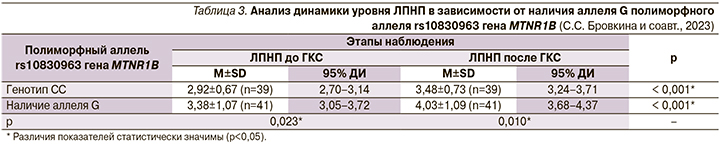
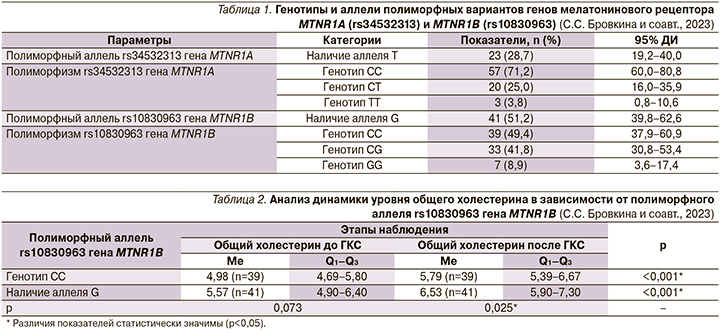
Сравнение показателя ЛПНП до и после ГКС в зависимости от генотипов rs10830963 гена MTNR1B (рис. 1). Анализ нарушения липидного обмена до ГКС в зависимости от полиморфного аллеля rs10830963 гена MTNR1B (рис. 2).
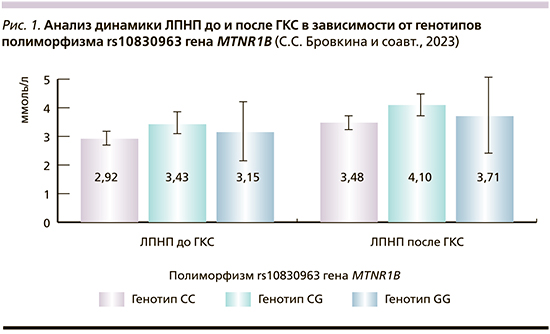
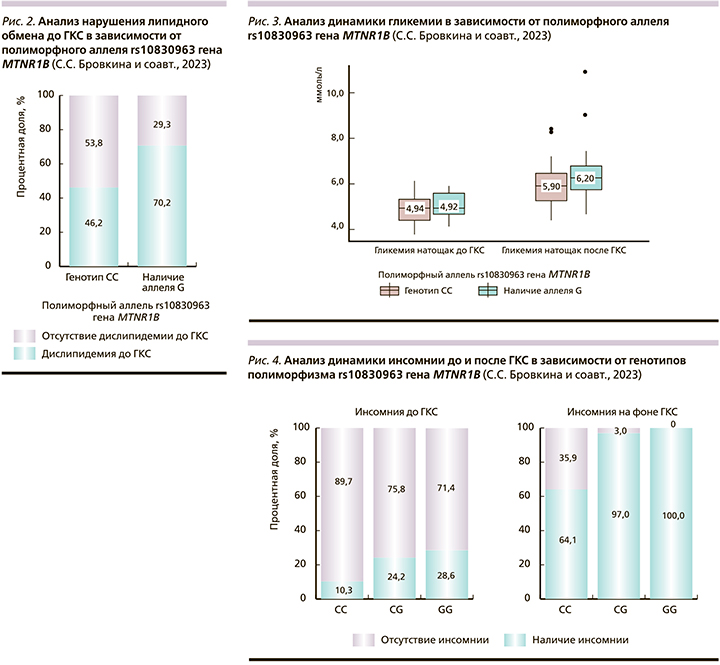
Статистически значимой ассоциации полиморфизма rs10830963 гена MTNR1B и значений гликемии выявлено не было (рис. 3). Анализ инсомнии до и после ГКС в зависимости от генотипов rs10830963 гена MTNR1B (рис. 4).
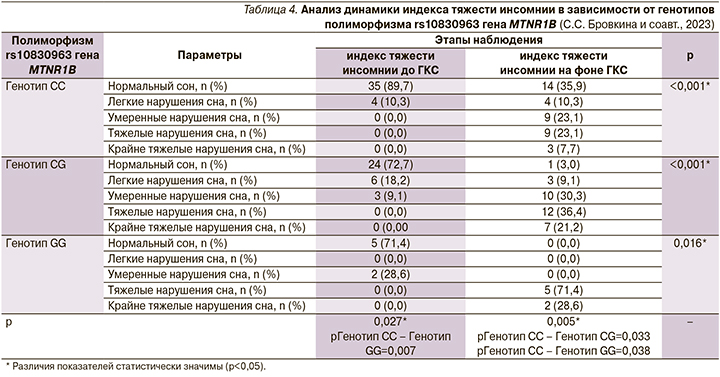
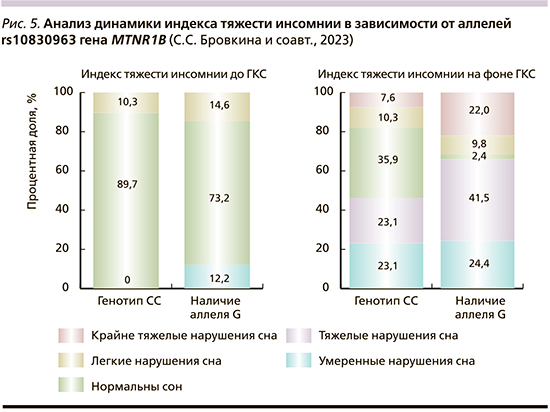
При анализе тяжести инсомнии в зависимости от генотипа rs10830963 гена MTNR1B выявлены значимые изменения как до ГКС, так и на фоне пульс-терапии (табл. 4). Также выполнен анализ тяжести нарушений сна до применения и на фоне ГКС в зависимости от аллельного состава rs10830963 гена MTNR1B (рис. 5).
Статистически значимых различий уровня глюкозы, показателей липидограммы, индекса тяжести инсомнии и возникновения бессонницы в группе пациентов – носителей rs34532313 гена MTNR1A выявлено не было.
Обсуждение
В ходе исследования выявлена статистически значимая разница показателей общего холестерина за счет фракции ЛПНП, а также индекса тяжести инсомнии и самого факта наличия бессонницы у носителей rs10830963 гена MTNR1B. Ассоциация rs34532313 гена MTNR1A с вышеперечисленными параметрами не подтвердилась. В связи с этим можно рассматривать анализ rs10830963 гена MTNR1B приоритетной мишенью при поиске возможных причин инсомнии и метаболических нарушений.
Анализ динамики уровня общего холестерина после применения ГКС показал, что пациенты, носители аллеля G rs10830963 гена MTNR1B, имели достоверно большие значения, чем носители неизмененного генотипа (p=0,025, используемый метод: U-критерий Манна–Уитни). Но при оценке уровня общего холестерина до и после ГКС в группах носителей генотипов CG, GG значимых различий найти не удалось (p=0,057, используемый метод: Критерий Краскела–Уоллиса).
При этом анализ уровня ЛПНП до и после применения ГКС также показал, что носители аллеля G имели большие значения ЛПНП как до ГКС (p=0,023), так и после пульс-терапии (p=0,010, используемый метод: t-критерий Стьюдента). При сравнении показателя ЛПНП в зависимости от генотипов rs10830963 гена MTNR1B также установлены существенные различия: носители CG и GG имели большие показатели (p=0,024, pГенотип CC –
Генотип CG=0,018, используемый метод: F-критерий Фишера).
При сопоставлении нарушения липидного обмена до применения ГКС в зависимости от полиморфного аллеля rs10830963 гена MTNR1B выявлены статистически значимые различия (p=0,026) (используемый метод: Хи-квадрат Пирсона). Шансы дислипидемии до применения ГКС в группе наличия аллеля G были выше в 2,819 раза по сравнению с группой генотипа СС, различия шансов были статистически значимыми (95% ДИ: 1,122–7,085). Связь аллеля G rs10830963 с более высокими показателями атерогенных фракций холестерина также показана ранее при богатой жирами диете [6].
Итак, можно рассматривать генотип СС rs10830963 гена MTNR1B защитным, а носительство аллеля G ассоциированным с большей выраженностью нарушений липидного обмена фоново и особенно после применения ГКС-терапии.
В исследованиях показана ассоциация rs10830963 гена MTNR1B с углеводным обменом и метаболическими нарушениями [7]. Полученные результаты не выявили значимых различий в уровне гликемии у носителей однонуклеотидных полиморфизмов, однако отмечена тенденция к большему значению уровня глюкозы после терапии ГКС у носителей аллеля G rs10830963 гена MTNR1B (p=0,450 до ГКС и p=0,146 после ГКС, соответственно, используемый метод U-критерий Манна–Уитни).
Инсомния на фоне применения ГКС чаще наблюдалась у обладателей генотипов CG и GG (p<0,001, pГенотип CC – Генотип CG=0,002, используемый метод: χ2-критерий Пирсона). При анализе индекса тяжести инсомнии более выраженные нарушения сна имели пациенты – носители CG и GG как до, так и после старта пульс-терапии (p=0,027, pГенотип CC – Генотип CG=0,007 и p=0,005, pГенотип CC – Генотип CG=0,033 pГенотип CC – Генотип GG=0,038 соответственно, используемый метод: χ2-критерий Пирсона). При анализе индекса тяжести инсомнии в зависимости от аллельного состава rs10830963 гена MTNR1B до применения ГКС не удалось установить статистически значимых различий (p=0,057), при этом на фоне ГКС-терапии носители аллеля G имели более тяжелые нарушения сна (p=0,002, используемый метод: Хи-квадрат Пирсона). Полученные результаты соотносятся с ранее выявленными ассоциациями [8], в связи с чем носительство аллеля G может быть рассмотрено как предиктор возникновения и тяжести нарушений сна у пациентов с РС.
Несмотря на применение соответствующих статистических критериев, нами не получены данные об ассоциации исследуемых однонуклеотидных полиморфизмов и углеводного обмена, широко описанной ранее [9]. Вероятно, расширение объема выборки могло бы повысить достоверность выявленной нами тенденции.
Заключение
Показаны значимые ассоциации носительства аллеля G rs10830963 гена MTNR1B среди пациентов с РС с вероятностью инсомнии и ее тяжестью до старта и на фоне ГКС-терапии. Также отмечена большая вероятность дислипидемии до старта ГКС-терапии, большие показатели общего холестерина за счет фракции ЛПНП, тенденция к большему уровню глюкозы натощак после ГКС-терапии носителей аллеля G. В связи с этим можно предположить протективное влияние генотипа CC rs10830963 в отношении метаболических нарушений. Выявленные ассоциации дают перспективу исследования влияния обмена мелатонина на метаболические отклонения и нарушения сна на фоне терапии ГКС и вне ее, а также выделение пациентов группы риска для более активных мер по коррекции нарушений.
Благодарности. Коллектив авторов выражает благодарность д.б.н., профессору Т.П. Шкурат, д.б.н., доценту Е.В. Машкиной за помощь в подготовке и проведении генетических анализов, а также к.м.н., врачу-неврологу О.Ю. Руденко за помощь в организации проведения исследования.



