1. Введение
Сердечно-сосудистые заболевания продолжают лидировать в структуре основных причин смертности как в Российской Федерации, так и за рубежом [1]. В соответствии с современными международными и российскими рекомендациями по диагностике и лечению дислипидемий для пациентов очень высокого сердечно-сосудистого риска (ОВССР)2 рекомендованы более низкие целевые уровни холестерина липопротеинов низкой плотности (ХС-ЛПНП <1,8 ммоль/л или снижение уровня ХС-ЛПНП на 50% и более от исходного значения) [2–4]. В связи с этим пациентам с ОВССР рекомендована терапия статинами в максимальных рекомендуемых или максимальных переносимых дозах, снижающих уровень ХС-ЛПНП до рекомендуемых целевых значений [5–9].
Ингибиторы ГМК-редуктазы (статины) являются ключевыми лекарственными средствами в первичной и вторичной профилактике атеросклероза с большой доказательной базой (CTT, 2010, NCEP IV, 2013) [4, 10]. Помимо липидснижающих эффектов статинов показано и прямое влияние терапии статинами на атеросклеротическую бляшку (АСБ), что было доказано в многочисленных «регрессионных» исследованиях с использованием инструментальных методов [11]. В этих работах результаты активной терапии статинами оценивались, как правило, через 12–24 месяца от начала терапии.
В международной научной литературе активно обсуждается необходимый и достаточный курс терапии статинами у больных высокого сердечно-сосудистого риска, который может приводить к регрессу АСБ в различных сосудистых бассейнах [12–22]. Значительное количество клинических исследований со статинами было посвящено изучению их эффекта на течение атеросклероза в сонных артериях (СА) [15–21]. Результаты этих исследований показали, что среднее время наступления регресса АСБ в СА составляет около 15 месяцев [15–21].
В настоящее время для диагностики и мониторирования течения атеросклероза СА все чаще используют новые неинвазивные методы исследования (магнитно-резонансная томография [МРТ] с высоким разрешением, трехмерное ультразвуковое исследование [3D-УЗИ]) [22–25].
Метод МРТ с высоким разрешением позволяет изучать влияние терапии статинами на морфологические характеристики стенок СА. Результаты исследований ORION (Outcome of Rosuvastatin treatment on Carotid Artery Atheroma: a Magnetic Resonance Imaging Observation), CHALLENGER (Carotid Plaque in Human for All Evaluations With Aggressive Rosuvastatin Therapy) с использованием МРТ высокого разрешения свидетельствуют о том, что терапия розувастатином может уменьшать некротическое липидное ядро атеромы через 24 месяца лечения [22, 23].
Помимо МРТ для анализа объемных показателей АСБ в сонных артериях используется 3D-УЗИ. В работах [24, 25] изучалось влияние гиполипидемической терапии (ГЛТ) на динамику объема АСБ в СА. В этих исследованиях получены отдельные предпосылки возможности стабилизации/регресса атером в СА на фоне терапии статинами в более короткие сроки – от 3 до 6 месяцев.

В мировой научной литературе к моменту планирования этой работы было недостаточно данных по изучению эффективности краткосрочной (менее 12 месяцев) интенсивной терапии статинами больных ОВССР с наличием атеросклероза в СА. Это стало обоснованием для планирования и проведения рандомизированного исследования «ФРЕГАТ» на базе лаборатории клинической липидологии отдела проблем атеросклероза НИИ клинической кардиологии им. А.Л. Мясникова Федерального государственного бюджетного учреждения «Российский кардиологический научно-производственный комплекс» Министерства здравоохранения РФ.
2. Материал и методы
Исследование «ФРЕГАТ» по дизайну было открытым рандомизированным проспективным, проведенным в параллельных группах. Продолжительность исследования составила 12 недель.
2.1. Критерии включения в исследование
В исследование были включены женщины и мужчины от 55 до 70 лет ОВССР с дислипидемией. Критериями включения в исследование стали: отсутствие достижения целевых уровней ХС-ЛПНП <1,8 ммоль/л при постоянной терапии статинами в течение не менее 3 месяцев и наличие одной и более АСБ в СА, суживающих просвет сосуда от 20 до 70%.
2.2. Критерии исключения из исследования
В исследование не включались пациенты с семейной гетерозиготной гиперхолестеринемией, наличием показаний к проведению операции на СА, принимавшие максимальные разрешенные дозы аторвастатина (80 мг/сут) или розувастатина (40 мг/сут), у которых активность АЛТ и АСТ была более чем на 20% выше верхнего предела нормы, активность креатинкиназы (КК) – более чем в 3 раза выше верхнего предела нормы. Кроме того, критериями исключения являлись любые другие состояния или заболевания, при которых участие больного в исследовании не рекомендовалось.

2.3. Дизайн исследования
В период отбора (1-й визит) пациенты проверялись на соответствие критериям включения/исключения. От всех больных было получено письменное информированное согласие на участие в исследовании, проведены физикальный осмотр, сбор анамнеза, были даны рекомендации по гиполипидемической диете, выполнен биохимический анализ крови и проведено дуплексное сканирование СА для определения наличия АСБ в СА и степени их стенозирования.
Пациент включался в исследование при соблюдении правил GСP – Good clinical practice (Качественной Клинической практики), если он/она дали письменное информированное согласие, соответствовал критериям включения и не имел критериев исключения. Рандомизация пациентов осуществлялась методом конвертов.
В рамках рандомизированного исследования было сформировано две группы по 40 пациентов в каждой: группа лечения розувастатином (Мертенил 40 мг/сут; компания Гедеон-Рихтер, Венгрия) и группа стандартной терапии статинами (симвастатин 20-40 мг/cут и другие статины в эквивалентных дозах). Пациентам в этих группах был проведен перерыв в терапии статинами в течение двух недель для оценки исходных показателей липидов (по согласованию с этическим комитетом ИКК им А. Л. Мясникова). На 2-м визите пациентам, отвечавшим критериям включения/исключения в исследование, была назначена терапия розувастатином 40 мг/сут (группа А) или возобновлена стандартная терапия статинами (группа Б), выполнен биохимический анализ крови (определение исходного уровня липидов) и проведено исходное 3D-УЗИ СА. Через 6 недель лечения больные были приглашены в клинику (3-й визит) для физикального осмотра и коррекции текущей сердечно-сосудистой терапии, оценки эффективности, переносимости и комплаентности ГЛТ и сердечно-сосудистой терапии. При удовлетворительной переносимости лечения пациентам была продолжена терапия вплоть до окончания исследования (4-й визит, 12-я неделя исследования), когда было проведено контрольное дуплексное сканирование и 3D-УЗИ СА. Основанием для исключения пациента из исследования послужили серьезное побочное явление, связанное с терапией розувастатином 40 мг/сут, отказ пациента от участия независимо от причин, серьезное сердечно-сосудистое осложнение, которое привело бы к изменению текущей сердечно-сосудистой терапии сроком более чем на 2 недели или отмене исследуемого препарата.
2.4. Метод трехмерного ультразвукового исследования сонных артерий
Пациентам, у которых по данным дуплексного сканирования были выявлены АСБ в СА, было проведено 3D-УЗИ СА на 2-м и 4-м визитах. 3D-УЗИ СА было проведено на ультразвуковой системе iU 22 (Philips, Нидерланды) с помощью линейного объемного датчика (VL13-5) со скоростью реконструкции в трехмерном режиме до 64 мегавоксел/с. Угол сканирования области интереса варьировался от 15 до 25˚ в зависимости от протяженности АСБ. Полученные УЗ-изображения были сохранены в формате DICOM. Трехмерные изображения обрабатывали на компьютерной рабочей станции с помощью полуавтоматического модуля программного обеспечения Philips Qlab-VPQ (модуля количественного анализа АСБ). Внутриоператорская воспроизводимость метода полуавтоматического измерения объема АСБ составила 3,1%. Объем АСБ рассчитывали для каждого сегмента СА. При наличии одной и более АСБ в разных сегментах рассчитывали суммарный объем АСБ (мм3). Для анализа учитывали параметр суммарного объема АСБ у одного пациента.

2.5. Статистический анализ
Статистический анализ проводился с использованием программы Statistica 7.0. Данные в работе представлены как медиана и интерквартильный размах. При сравнении данных двух визитов (2-го и 4-го) использовался непараметрический критерий Уилкоксона. Различия считались статистически значимыми при значениях p <0,05.
3. Результаты исследования
3.1. Характеристика исследуемых групп пациентов
В основную группу А были включены 40 больных, из них 7 женщин и 33 мужчины, средний возраст составил 61,5±3,5 года. В контрольную группу Б были включены 40 пациентов, из них 13 женщин и 27 мужчин, средний возраст составил 63,5±4,5 года. Индекс массы тела в обеих группах составил 28 кг/м2. Исходные данные до начала ГЛТ после перерыва в приеме статинов представлены в табл. 1. Группы были сопоставимыми возрасту, полу и индексу массе тела. Различия между группам по всем оцениваемым параметрам были недостоверными.
Значительное число пациентов (30 больных; 75%) в каждой из групп исследования перенесли инфаркт миокарда (ИМ). При этом 35 (88%) пациентов группы А и 38 (95%) больных группы Б имели в анамнезе операцию реваскуляризации миокарда – аортокоронарное шунтирование (АКШ) или транслюминальную баллонную ангиопластику (ТБА). Число больных с постинфарктным кардиосклерозом, перенесенным ишемическим инсультом, транзиторной ишемической атакой и реваскуляризацией миокарда достоверно не различалось между группами (табл. 1). Доля пациентов, страдавших артериальной гипертензии, составила 78% (31 человек) для группы А и 80% (32 человека) для группы Б. Сахарным диабетом 2 типа страдали 6 (15%) пациентов в группе А и 3 (8%) – в группе Б.
3.2. Исходные данные и динамика липидных показателей и уровня вч-СРБ пациентов, включенных в исследование
Липидный спектр и уровень высокочувствительного С-реактивного белка (вч-СРБ) пациентов исходно (через 2 недели после перерыва в гиполипидемической терапии, визит 2) в группах А и Б были сопоставимыми (табл. 2).
Средний уровень ХС-ЛПНП у больных группы А составил 3,98 ммоль/л [3,46; 4,55], группы Б – 3,69 ммоль/л [2,96; 4,26], различия между группами были недостоверными. Также достоверно не различались уровни ОХС, триглицеридов (ТГ), ХС-ЛПВП (липопротеинов высокой плотности), ХС-неЛПВП, ЛП (а), Апо А1, Апо В. Не различались и общие биохимические параметры, такие как АСаТ, АЛаТ, КК, глюкоза, креатинин, гликированный гемоглобин (HbA1c), вч-СРБ. Таким образом, при анализе исходных показателей ни по одному из них не было отмечено статистически значимых различий между группами (см. табл. 2).
На рис. 1 представлены липидные показатели через 12 недель ГЛТ в группе пациентов, принимавших розувастатин 40 мг/сут (группе А), и в группе стандартной терапии статинами (группа Б). Все показатели (кроме ХС-ЛПВП) достоверно снизились от исходного уровня. При этом большее снижение отмечено в основной группе А по сравнению с контрольной группой Б.
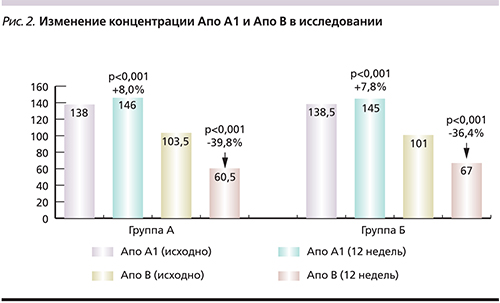
В группе А отмечено достоверное снижение уровней ОХС и ХС-ЛПНП: на 35,5% (p<0,001) и 47,9% (p<0,001) соответственно (рис. 1). Уровень ТГ в этой группе достоверно снизился на 21,1% (p<0,002). В группе Б снижение уровней ОХС и ХС-ЛПНП также было достоверным, составив 26,0% (p<0,001) и 36,3% (p<0,001) соответственно (рис. 1), уровень ТГ снизился на 8,2% (p<0,003). Достоверного изменения уровня ХС-ЛПВП в обеих группах после 12 недель ГЛТ выявлено не было. Таким образом, в группе А удалось достичь достоверно большего снижения ОХС (p<0,007), ХС-ЛПНП (p<0,002) и ТГ (p<0,003) по сравнению со стандартной терапией статинами.
При сравнении эффективности влияния краткосрочной интенсивной терапии розувастатином 40 мг/сут и стандартной терапии статинами на концентрацию апобелков установлено, что в группе А уровень Апо А1 достоверно повысился на 8,0% (p<0,001) от исходного уровня, а уровень Апо В достоверно снизился на 39,8% (p<0,001). В группе Б также отмечалась достоверная динамика: для Апо А1 – повышение уровня на 7,8% (p<0,001), для Апо В – снижение уровня на 36,4% (p<0,001). При этом достоверных различий между группами в повышении уровня Апо А1 и снижении уровня Апо В не отмечалось. Данные динамики концентрации апобелков за 12 недель ГЛТ представлены на рис. 2.
В ходе нашей работы ГЛТ была оценена по достижении рекомендуемого уровня ХС-ЛПНП для лиц ОВССР (<1, 8 ммоль/л или снижение на 50% от исходного уровня) за 12 недель применения.
В группе больных, принимавших розувастатин 40 мг/сут (группа А), было 26 (65%) пациентов, достигших целевых значений ХС-ЛПНП, в группе Б – всего 14 (35%; p<0,007).
Заслуживают внимания и данные об уровнях вч-СРБ. В обеих группах уровень вч-СРБ достоверно снизился через 12 недель терапии, но следует отметить, что более высокие значения этого параметра до терапии были в группе А (при этом в обеих группах средние значения не превышали верхних границ нормы). В группе интенсивной терапии (группа А) уровень вч-СРБ достоверно снизился на 36,4% – с 2,34 до 0,96 мг/л (p <0,001), в группе стандартной терапии (группа Б) он снизился на 17,1% – с 1,72 мг/дл до 0,97 мг/дл (p <0,02).
3.3. Исходные данные и динамика среднего значения объема АСБ у пациентов, включенных в исследование
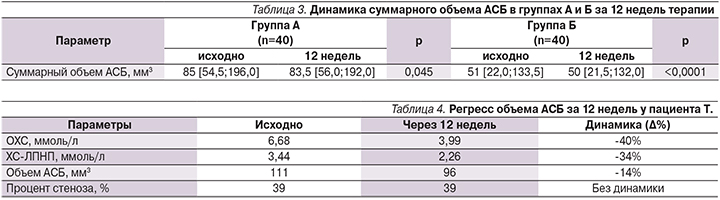
С помощью 3D-УЗИ был измерен объем атером в СА. Измерение объема атером производилось исходно и через 12 недель терапии статинами в обеих группах. При обследовании у пациентов группы А обнаружена 71 АСБ, у пациентов группы Б – 51 АСБ. В группе А суммарный объем АСБ был достоверно больше, чем в группе Б (85,0 [54,5;196,0] против 51,0 [22,0;133,5] мм³, p=0,027), что свидетельствует о более выраженном атеросклеротическом поражении СА в группе А. В обеих группах исследования отмечено небольшое, но достоверное уменьшение объема АСБ в СА (табл. 3).
По результатам нашего исследования, достоверных различий в динамике объема АСБ при краткосрочной интенсивной терапии розувастатином по сравнению с группой стандартной терапии статинами получено не было (p=0,272).
3.4. Клинический пример
Пациент Т. 68 лет. Диагноз: ишемическая болезнь сердца. Атеросклероз аорты, коронарных и брахиоцефальных артерий. Состояние после ТБА со стентированием передней нисходящей артерии. Дислипидемия.
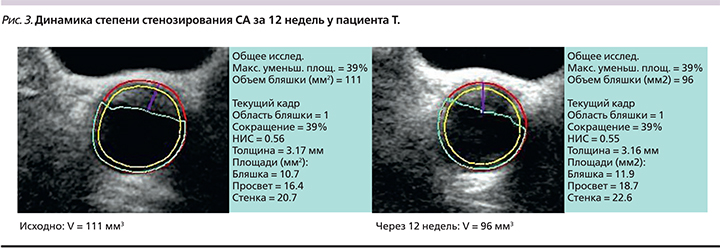
За 12 недель терапии статинами на фоне снижения уровня ХС-ЛПНП с 3,44 до 2,26 ммоль/л (-34%) объем АСБ по данным 3D-УЗИ уменьшился на 14% – с 111 до 96 мм3. Рекомендован-ный уровень ХС-ЛПНП (<1,8 ммоль/л или снижение на половину) для пациентов ОВССР не достигнут (табл. 4). При этом степень стенозирования СА осталась без динамики – 39% исходно и 39% через 12 недель (рис. 3).
Таким образом, результаты обследования пациента Т. свидетельствуют о большей чувствительности объемного параметра 3D-УЗИ по сравнению с изменением процента стенозирования сонной артерии при оценке эффективности терапии статинами.
4. Обсуждение
Согласно современным рекомендациям по диагностике и лечению дислипидемий, статины являются обязательным препаратом для пациентов ОВССР и должны приниматься неопределенно долго. В повседневной клинической практике врача эффективность ГЛТ удобно оценивать по лабораторным суррогатным конечным точкам (процент снижения ХС-ЛПНП и достижение целевых уровней других липидов), как правило, через 1, 3, 12 месяцев. Оценка по инструментальным конечным точкам проводится через 12–24 месяца от начала терапии статинами, это положение не отражено в современных рекомендациях по диагностике и лечению дислипидемий [3].
В нашей работе использовался один из самых изученных и эффективных в снижении ХС-ЛПНП на данный момент статин – розувастатин. Розувастатин является синтетическим статином IV генерации, который широко используется в клинической практике с начала 2000-х гг. [26–30].
Результаты нашей работы по оценке гиполипидемической эффективности розувастатина 40 мг/сут сопоставимы с данными других российских и зарубежных исследований [27, 31].
Продемонстрирована высокая липидснижающая эффективность розувастатина в дозе 40 мг/сут у 40 пациентов группы А, где отмечалось снижение среднего уровня ХС-ЛПНП на 43,1%. В группе Б, в которой проводилась стандартная терапия разными статинами в дозах 10–40 мг/сут, наблюдалось снижение среднего уровня ХС-ЛПНП на 33,6%. Ранее были опубликованы данные отечественного исследования о хорошем липидснижающем эффекте розувастатина (Мертенил 40 мг/сут), в котором удалось добиться дополнительного снижения уровня ХС-ЛПНП на 34,7% при переводе пациентов с текущей терапии другими статинами или розувастатином в дозе 10 мг/сут на лечение розувастатином 40 мг/сут в течение 24 недель (исследование «40×40») [27].
В этом исследовании также принимали участие пациенты ОВССР.
На фоне проводимой терапии рекомендованный целевой уровень ХС-ЛПНП для категории пациентов ОВССР был достигнут 65% больных в группе А, принимавших высокие дозы розувастатина, и 35% пациентов в группе Б, получавших стандартную терапию статинами.
Помимо снижения уровня ХС-ЛПНП и достижения рекомендуемых целевых значений липидов основной целью ГЛТ статинами является замедление прогрессирования или регресс атеросклероза и как результат этого – снижение количества сердечно-сосудистых осложнений и улучшение прогноза.
В нашей работе, по данным 3D-УЗИ, удалось достичь небольшого, но статистически достоверного уменьшения среднего объема атеромы в СА: в группе А – с 85,0 [54,5; 196,0] до 83,5 [56,0; 192,0] мм3 (p=0,045), в группе Б – с 51,0 [22,0; 133,5] до 50 [21,5;132,0] мм3 (p<0,0001). В то же время достоверных различий между группами в динамике объема атеромы получено не было.
В целом результаты нашей работы согласуются с мнением большинства авторов о том, что краткосрочная интенсивная терапия розувастатином и стандартная терапия статинами приводит к стабилизации атеросклеротического процесса в СА по данным 3D-УЗИ.
Доказательная база в отношении эффективности терапии статинами по валидированным инструментальным конечным точкам (повторная коронароангиография, внутрисосудистое УЗИ, толщина интимы-медии [ТИМ]) включает несколько десятков работ схожего дизайна, в которых изучалась возможность стабилизации и/или регресса атеросклероза в сонных коронарных артериях и в грудной аорте на той или иной терапии [11]. В этих исследованиях приняли участие более 3500 пациентов с гиперхолестеринеми-ей (средний возраст – 57 лет), с преобладанием пациентов мужского пола (63,3%) со средним исходным уровнем липидов: ХС-ЛПНП – 7,55 ммоль/л, ХС-ЛПВП – 1,72 ммоль/л. В работах, опубликованных до 2000-х гг., исследовалась терапия правастатином [12–14, 16], в последующих исследованиях использовались аторвастатин [16, 17] и симвастатин [16, 18-20] и лишь в одном исследовании (METEOR – Measuring Effects on Intima-Media Thickness: an Evaluation Of Rosuvastatin) [21] – розувастатин. В большинстве исследований применялись статины в максимальных дозах: правастатин – 40 мг/сут, аторвастатин – 80 мг/сут, симвастатин – 80 мг/сут, розувастатин – 40 мг/сут [12–16, 19–21], при использовании которых было достигнуто снижение уровня ХС-ЛПНП в среднем на 46,2%. В группах плацебо доcтоверного снижения среднего уровня ХС-ЛПНП выявлено не было [12–15].
В зарубежных исследованиях (ORION, СHALLENGER) оценивали влияние ГЛТ на динамику объема АСБ с использованием МРТ и с более длительным периодом наблюдения (12 месяцев) [22, 23].
В исследовании ORION оценка количественных и качественных характеристик АСБ производилась посредством МРТ. В этой работе было изучено влияние терапии розувастатином в дозах 5 и 40 мг/сут (24 месяцев) на объем и морфологию атером в СА. В исследование были включены 43 пациента с уровнем ХС-ЛПНП (от 2,6 до 6,5 ммоль/л) и наличием стеноза, сузившего просвет артерии от 16 до 79% по данным дуплексного сканирования СА. По результатам исследования не было выявлено значимых различий в объеме АСБ СА у больных, получавших терапию розувастатином в стандартной и высокой дозах в течение 24 месяцев, по сравнению с исходными значениями. В то же время на фоне терапии розувастатином отмечено уменьшение некротического липидного ядра на 35,5% по сравнению с исходными значениями (p=0,006) [22].
В другом исследовании, CHALLENGER (2009), в котором также использовался метод МРТ, были получены схожие результаты. Пятьдесят пациентов с гиперхолестеринемией (ХС-ЛПНП ≥120 мг/дл) и ТИМ сонных артерий ≥1,8 мм находились на терапии розувастатином в 5 мг/сут в течение 24 месяцев. Результаты этого исследования показали, что терапия розувастатином в дозе 5 мг/сут способствовала достоверному регрессу некротического ядра (LRNC) АСБ на 1,3% за 24 месяцев (р=0,0015), однако изменений в объеме атеромы выявлено не было [23].
Таким образом, по данным исследований [22, 23] не было выявлено достоверного регресса объема атеромы, однако было выявлено достоверное уменьшение некротического липидного ядра АСБ в СА.
В ряде исследований были получены достоверные результаты по стабилизации и регрессу атеросклероза в более короткие сроки (до 6 месяцев). В работе С. Ainsworth и соавт. (2005) были исследованы 38 пациентов с асимптомным атеросклерозом в СА (наличие АСБ, сузившей просвет сосуда менее чем на 60%). После рандомизации пациентам была назначена интенсивная терапия аторвастатином (80 мг/сут; n=17) или плацебо (n=21).
С помощью 3D-УЗИ через 3 месяца был оценен объем атеромы и выявлено, что в группе плацебо отмечено прогрессирование атеросклероза (увеличение объема атеромы на 16,81±74,1 мм³), тогда как в группе терапии аторвастатином объем атеромы уменьшился на 90,25±85,12 мм3 (p<0,0001) [24].
В другой работе (К. Yamada и соавт., 2009) получены данные по уменьшению объема АСБ за 6 месяцев лечения у 20 пациентов с бессимптомным атеросклерозом в СА (наличие АСБ, сузившей просвет сосуда менее чем на 60%). В этом исследовании больным была назначена терапия аторвастатином 20 мг/сут или плацебо. В группе пациентов, принимающих статин, относительный объем атеромы уменьшился с 58,4±25,6 до 47,8±23,5% (p<0,01), в группе плацебо не было выявлено достоверного уменьшения объема атеромы по данным УЗИ [25].
При назначении высоких доз статинов необходимо учитывать безопасность и переносимость такого рода лечения. В нашем исследовании достоверных изменений биохимических параметров крови и нежелательных явлений обнаружены не были. Ни в одном случае в двух группах уровни КК не достигли пятикратного повы-шения, а уровни АЛТ и АСТ – трехкратного превышения верхнего предела нормы, что могло потребовать отмены препарата. Также не было зафиксировано ни одного случая критического повышения уровня креатинина. Жалоб пациентов на мышечные боли, болезненные ощущения и тяжесть в печени не было. Это свидетельствует о хорошей переносимости и безопасности терапии статинами в двух группах.
5. Заключение
Результаты рандомизированного исследования «ФРЕГАТ» продемонстрировали хороший гиполипидемический эффект терапии статинами и возможность стабилизации атеросклероза в СА на фоне краткосрочный ГЛТ (12 недель) как в группе стандартной терапии статинами, так и в группе терапии розувастатином (Мертенил 40 мг/сут).
Наше исследование не выявило преимуществ краткосрочной интенсивной ГЛТ по влиянию на динамику объема атером в СА, что может быть связано с исходно более тяжелым атеросклеротическим процессом в группе терапии розувастатином или недостаточным сроком (3 месяца) воздействия розувастатином 40 мг/сут на течение атеросклероза в СА. Кроме того, при проведении новых исследований для достижения более убедительного снижения объема атером, вероятно, имеет смысл выбирать пациентов, ранее не получавших ГЛТ.
Вместе с тем, по данным последних Рекомендаций ESC (2016), пациенты ОВССР – основные кандидаты для проведения интенсивной терапии статинами в рамках вторичной профилактики атеросклероза [32, 33]. По мнению авторов, повышение средних доз статинов в рутинной клинической практике – основная задача профилактической кардиологии в РФ в ближайшее время. Это может способствовать дальнейшему снижению высокой сердечно-сосудистой смертности в нашей стране.



