Введение
Псориаз – генетически детерминированное хроническое заболевание кожи мультифакториальной природы с рецидивирующим течением, обусловленное иммуноопосредованным воспалением с частым поражением опорно-двигательного аппарата [1]. Распространенность псориаза составляет около 2% от популяции в целом во всем мире [2–4]. В актуализированных Клинических рекомендациях «Псориаз, 2020», разработанных общероссийской общественной организацией «Российское общество дерматовенерологов и косметологов» и одобренных Научно-практическим советом Минздрава РФ, в разделе 1.5 «Классификация заболевания или состояния (группы заболеваний или состояний)» указано, что в настоящее время принято выделять несколько клинических форм псориаза: обыкновенный (вульгарный, бляшечный), себорейный, каплевидный, пустулезный (генерализованный Цумбуша, псориаз ладоней и подошв Барбера, акродерматит стойкий, гнойный Аллопо), инверсный, псориатическая эритродермия, псориатический артрит (псориаз артропатический) [5]. По данной классификации поражение перианальной области (ПАО) является разновидностью клинических проявлений инверсного псориаза. Инверсный псориаз, также называемый интертригинозным псориазом, локализуется в области кожных складок. Наиболее часто поражаются паховые складки, за ними следуют подмышечные впадины, складки под молочными железами, ПАО, пупок и область заушных складок. Также могут быть вовлечены локтевые и подколенные ямки и межпальцевые промежутки [6]. Инверсный псориаз является типичным проявлением псориаза у детей в возрасте до 2 лет и обычно проявляется в виде интенсивной четко очерченной эритемы в области подгузника, называемой пеленочным псориазом [7, 8].
Распространенность инверсного псориаза варьирует во многих исследованиях: так, в китайской популяции инверсный псориаз встречается только у 3,2–7% пациентов, страдающих псориазом, а среди европейских пациентов встречаемость выше и составляет 12–36% случаев. Статистические данные разнятся и зависят от принятой в той или иной стране классификации, согласно которой аногенитальный псориаз может рассматриваться как разновидность инверсного псориаза или как отдельная клиническая форма. Соответственно, точную распространенность инверсного псориаза трудно оценить [9–13]. Высыпания могут появляться только в складках кожи или сочетаться с псориазом, локализованным на разгибательных участках [9, 11]. Распространенность изолированного аногенитального поражения может показаться низкой, но вовлечение аногенитальной области вместе с другими локализациями обнаруживается у 45% больных псориазом [14]. У 63% взрослых с псориазом хотя бы раз в жизни появляются псориатические поражения в области гениталий или ПАО [15].
Также из-за локализации псориатических поражений в ПАО пациенты часто не сообщают о своем заболевании, пока врач не спросит их об этом [16–18]. Патогенез инверсного псориаза не отличается от патогенеза бляшечного псориаза, но возможная роль грибковой и/или бактериальной колонизации складок как потенциального триггерного фактора все еще обсуждается [19].
Таким образом, псориаз в ПАО встречается довольно часто. Международная классификация болезней (МКБ) 10-го пересмотра (1994) не в полной мере отражает все клинические проявления псориаза, этой классификацией не всегда удобно пользоваться в практической деятельности. В России к 2024 г. планируется переход на Международную статистическую классификацию болезней и проблем, связанных со здоровьем, 11-го пересмотра [20]. Согласно МКБ 11-го пересмотра, классификация клинических форм псориаза включает аногенитальный псориаз (ЕА90.53). Важно отметить, что МКБ-11 – это не просто обновленная версия предыдущего варианта, она отражает современный взгляд мирового медицинского сообщества на классификацию болезней.
Клиника
Местные условия в ПАО, такие как тепло, влажность и трение, способствуют мацерации, трещинам, постоянному раздражению и отсутствию шелушения, что вызывает измененные клинические проявления псориаза по сравнению с классическими характеристиками. Псориатические поражения в ПАО клинически характеризуются четко очерченными, гладкими и не шелушащимися эритематозными пятнами (рис. 1, 2) [21]. Псориаз в ПАО может представлять собой исключительную локализацию псориаза или, что встречается чаще, сопровождаться классическими бляшечными проявлениями псориаза, локализованными в других участках кожного покрова [19]. В отличие от вульгарного псориаза (рис. 3, 4), шелушение обычно минимальное или отсутствует, а поверхность поражений выглядит влажной, гладкой и блестящей (рис. 1, 2) [15, 21]. У детей раннего возраста инверсный псориаз часто может проявляться в виде резко отграниченных, минимально возвышающихся эритематозных бляшек в области подгузника с типичным вовлечением паховых складок («пеленочный псориаз»). Заболевание сопровождается повышенной потливостью и болезненностью [22].
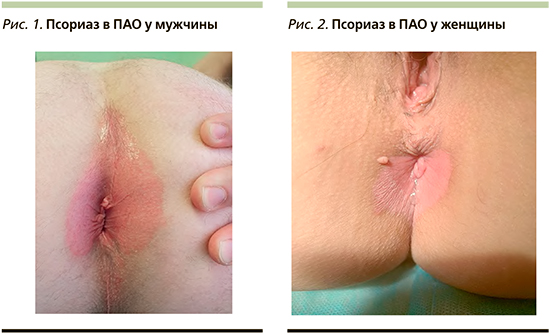
В связи с локализацией в складках при псориазе в ПАО очень часто возникают грибковые инфекции [23, 24]. Суперинфекция бактериями и грибками (особенно Candida spp.) часто встречается при аногенитальном псориазе, поскольку влажная кожа обеспечивает идеальную среду для роста микроорганизмов. С другой стороны, колонизация кожных складок бактериями и грибами может предрасполагать к обострению псориаза в ПАО и в области других складок [19].
Также было высказано предположение, согласно которому внезапное начало инверсного псориаза у взрослых может быть признаком ВИЧинфекции [25]. Перианальная локализация псориаза может приводить к изнурительным эмоциональным, физическим расстройствам и сексуальным дисфункциям, вызывать зуд, раздражение и болезненность. Инверсный псориаз связан с низким качеством жизни и значительным стрессом, даже если он поражает лишь небольшую часть площади кожного покрова [26, 27]. Хотя инверсный псориаз чаще встречается среди мужчин, тяжесть симптомов выше у женщин [28]. Как показано в исследовании с использованием специального инструмента для измерения бремени болезни (опросник «Бремя болезни при инверсном псориазе», IPBOD), для пациентов с локализацией псориаза в таких областях, как гениталии и перианальная зона, характерно чувство смущения и стыда [29]. Низкая осведомленность о возможности локализации инверсного псориаза в ПАО может приводить к ошибочной диагностике и нерациональному лечению, что впоследствии увеличивает риск самолечения и осложнений [15].
Дифференциальный диагноз
Из-за описанных выше особенностей псориатических очагов в ПАО дифференциальная диагностика с грибковыми и венерическими заболеваниями становится затруднительной, а торпидность к лечению выше, чем в других участках кожного покрова. Дифференциальный диагноз псориаза в ПАО включает любую эритематозную сыпь в области складок кожи, обычно определяемую как «интертриго» [30, 31]. Такие высыпания могут быть вызваны простым механическим трением, инфекционными заболеваниями, такими как грибковые и бактериальные инфекции, и некоторыми воспалительными заболеваниями кожи [32]. Постановка диагноза может быть затруднительной, особенно в случае нескольких или изолированных поражений, и часто требуются лабораторные исследования и/или биопсия для постановки окончательного диагноза.
Опрелости вследствие механического трения чаще возникают у лиц с избыточной массой тела и ожирением и/или у людей, занимающихся спортом (например, у бегунов или велосипедистов), и вызываются трением кожи о кожу или спортивный инвентарь. Другие триггерные факторы включают влажность, гипергидроз, плохую гигиену и использование одежды из шерсти и синтетических волокон. Клинически опрелости характеризуются эритемой, мацерацией, эрозиями [19].
Грибковые инфекции, вызванные как дерматофитами, так и Candida spp., очень часто встречаются в складках кожи и клинически характеризуются эритематозными пятнами. Наличие приподнятых, чешуйчатых, кольцевидных краев при дерматофитном микозе и периферических сателлитных папул и/или пустул при кандидозе может помочь дифференцировать эти состояния от псориаза в ПАО. Культуральные микологические исследования могут помочь в постановке правильного диагноза, хотя часто инверсный псориаз может сосуществовать с этими инфекциями [19].
Бактериальные инфекции также могут служить причиной опрелости, которая имитирует псориаз ПАО. Эритразма, вызываемая Corynebacterium minutissimum, проявляется красно-коричневыми пятнами с четко очерченными краями. Исследование в лучах лампы Вуда может помочь идентифицировать этот дерматоз, демонстрируя кораллово-красную флуоресценцию [33]. Другие бактерии часто могут осложнять опрелости, например, такие как Staphylococcus aureus, Streptococcus, Pseudomonas aeruginosa, Proteus mirabilis и Proteus vulgaris.
Себорейный дерматит складок проявляется эритематозными высыпаниями, часто с эрозиями и трещинами. Наличие желтоватых жирных чешуек может помочь отличить себорейный дерматит от инверсного псориаза, хотя чешуйки могут и отсутствовать [33]. Одновременное поражение типичных областей (лицо, ушные раковины, волосистая часть головы) способствует правильной диагностике.
Красный плоский лишай может поражать складки, что будет имитировать инверсный псориаз, но наличие сопутствующих типичных поражений кожи и/или слизистых оболочек и выявление сетки Уикхема укажет на правильный диагноз, который должен быть подтвержден гистологическим исследованием [19].
Простой и аллергический контактный дерматит часто встречается в области кожных складок. Он возникает в основном из-за контакта с дезодорантами, парфюмерией, ароматизированной туалетной бумагой и цветным синтетическим бельем и обычно характеризуется наличием нечетких эритематозных пятен и везикул. Аллергические тесты (патч-тесты) могут быть полезными для диагностики [19].
Другие кожные заболевания, которые могут проявляться интертригинозными пятнами и бляшками в области кожных складок, включают атопический дерматит, болезнь Дарье, болезнь ХейлиХейли, экстрамаммарную болезнь Педжета, синдром глюкагономы, энтеропатический акродерматит и лангергансоклеточный гистиоцитоз [21].
Наконец, в случае поражения слизистой оболочки анального канала в качестве дифференциальных диагнозов следует принимать во внимание плазмоклеточный мукозит Зоона и эритроплазию Кейра [34, 35].
Диагноз псориаза в ПАО обычно верифицируется клинически, и физикальное обследование должно включать осмотр всей поверхности кожного покрова, включая слизистые оболочки и волосистую часть головы, чтобы проверить наличие других областей, пораженных псориазом. Следует осматривать ногти и суставы на предмет любых изменений, указывающих на псориаз, и учитывать семейный анамнез для дальнейшего уточнения диагноза.
В некоторых случаях диагностика псориаза в ПАО может быть затруднена, особенно когда он проявляется как единственный симптом заболевания, что требует биопсии кожи. При гистологическом исследовании псориаз в ПАО представляет собой классическую картину бляшечного псориаза, состоящую из гиперплазии эпидермиса и удлинения сосочков дермы, с акантозом, паракератозом, редукцией зернистого слоя и в некоторых случаях – микроабсцессами Мунро и микропустулами Когоя. По сравнению с классическим бляшечным псориазом гиперплазия эпидермиса менее выражена, а спонгиоз встречается чаще [19].
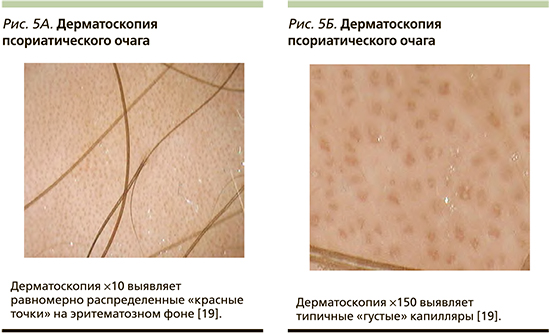
За последние годы дерматоскопия помогла существенно улучшить клиническую диагностику псориаза [36, 37]. В частности, дерматоскопия с малым увеличением (х10) показывает характерное присутствие беловатых чешуек и «красных точек», равномерно распределенных по всей бляшке на эритематозном фоне (рис. 5А) [19]. При большем увеличении (х100) красные точки выглядят как типичные гломерулярные скопления извитых капилляров (рис. 5Б), гистопатологически соответствующих типичной модификации микрососудистой архитектуры при псориазе, т.е. расширенным, удлиненным и извилистым капиллярным петлям в сосочках дермы [19, 38]. Дерматоскопия может помочь в диагностике псориаза, особенно при необычных анатомических локализациях и/или проявлениях, что подтверждается различными исследованиями [37, 39].
Другим неинвазивным методом, который, как сообщается, улучшает диагностику инверсного псориаза, является конфокальная микроскопия in vivo, в настоящее время используемая для оценки меланоцитарных поражений, опухолей кожи и некоторых воспалительных и инфекционных дерматозов [40]. В исследовании 10 пациентов с псориатическим баланитом, подтвержденным биопсией, конфокальная микроскопия выявила своеобразную картину, состоящую из увеличенных, неправильных, размытых и темных («без ободка») сосочков дермы, заполненных расширенными кровеносными сосудами и разделенных тонкими межсосочковыми гребнями [40]. Этот паттерн коррелирует с «красными точками»/«густыми капиллярами», наблюдаемыми при дерматоскопии. Конфокальная микроскопия в настоящее время доступна только в отдельных академических центрах из-за высокой себестоимости.
Лечение
К лечению псориаза ПАО следует подходить с особой осторожностью, поскольку кожа этой области намного тоньше и значительно более восприимчива к побочным эффектам некоторых методов лечения [41]. Хотя число клинических испытаний, демонстрирующих эффективность и безопасность терапии, ограничено, данные практики показывают, что инверсный псориаз можно успешно лечить как местными, так и системными препаратами, включая генно-инженерные биологические препараты [42].
Основная информация по способам лечения псориаза в ПАО представлена в таблице [19].

Первой линией при псориазе в ПАО остаются местные глюкокортикостероиды (ГКС) низкой и средней степени активности, местные ингибиторы кальциневрина (например, такролимус, пимекролимус) и местные аналоги витамина D (например, кальципотриол, кальцитриол). Хотя местные ГКС могут приводить к значительному клиническому улучшению и исчезновению поражений, их следует использовать с осторожностью, особенно при интертригинозных поражениях. Рекомендуется лечение псориаза в ПАО местными ГКС в течение короткого периода времени (2–4 недели). В настоящее время нет достаточных данных о безопасности лечения более 4 недель [41]. Хотя побочные эффекты местных ГКС препятствуют их использованию в течение длительных периодов времени (более 4 недель), исследования показали, что применение лечения в умеренных количествах и с интервалами приводит к долгосрочному эффекту даже на этих деликатных участках кожи [42].
Топические ингибиторы кальциневрина (ТИК) служат альтернативой для пациентов с псориазом в ПАО, которым требуется поддерживающая терапия в течение более длительного периода времени [42]. Хотя пациенты лучше реагируют на местные ГКС, ТИК можно использовать в течение более длительного времени с меньшим риском истончения кожи, хотя побочные эффекты ТИК могут включать ощущение жжения и легкий зуд.
Местные аналоги витамина D являются еще одной альтернативой местным ГКС при рассмотрении более длительного курса лечения, но они считаются менее эффективными и связаны с бόльшим количеством побочных эффектов по сравнению с ТИК [43].
Терапия второй линии включает местный ингибитор фосфодиэстеразы-4 (ФДЭ-4) (крисаборол, рофлумиласт – препараты не зарегистрированы в РФ) и лекарственные средства на основе дегтя для местного применения, которые, как было показано, уменьшают воспалительные реакции и частоту обострений при использовании в сочетании с местными ГКС низкой степени активности [44].
Местные ингибиторы ФДЭ-4 эффективны и хорошо переносятся при псориазе в ПАО. Клинические испытания показали успех в лечении инверсного псориаза с помощью ингибиторов ФДЭ-4, которые могут быть альтернативным методом терапии для пациентов, которые плохо реагируют на другие местные препараты первой линии, такие как ГКС или ТИК [44].
Несколько находящихся в разработке и проходящих клинические исследования препаратов для местного применения, таких как тапинароф и делгоцитиниб, показали перспективный потенциал в лечении псориаза. В настоящее время тапинароф рассматривается на предмет одобрения FDA (Food and Drug Administration) для лечения бляшечного псориаза. Два исследования II фазы продемонстрировали многообещающие результаты в отношении как безопасности, так и эффективности кремовой формы препарата тапинароф для взрослых пациентов с псориазом с поражением поверхности кожного покрова от 1 до 15% и преимущественно легкими и умеренными побочными эффектами [45, 46]. Делгоцитиниб является ингибитором янус-киназы, который воздействует на потенциальный механизм развития воспалительных и аутоиммунных заболеваний, и его мазевая форма была недавно одобрена в Японии для лечения атопического дерматита [47]. Необходимы более крупные проспективные исследования, чтобы подтвердить безопасность и эффективность этих лекарственных препаратов, которые могут стать альтернативой местным ГКС.
Генно-инженерные препараты для лечения псориаза, включая иксекизумаб, настоятельно рекомендуются пациентам с рефрактерным или среднетяжелым и тяжелым инверсным псориазом. Следует отметить, что иксекизумаб, ингибитор интерлейкина-17, в настоящее время включает данные об эффективности при инверсном псориазе в маркировку FDA для псориаза [48]. Во многих исследованиях сообщалось о терапевтической значимости иксекизумаба для облегчения симптомов и улучшения качества жизни пациентов с инверсным псориазом [48, 49]. Системная терапия (например, метотрексат, циклоспорин, ацитретин) также может быть рассмотрена для пациентов с рефрактерным или тяжелым инверсным псориазом [42].
Пероральные ингибиторы ФДЭ-4, такие как апремиласт, могут быть эффективной альтернативой лечению инверсного, перианального и аногенитального псориаза, когда другие методы лечения не помогают. В настоящее время проводится исследование III фазы (DISCREET), в котором изучается эффективность и безопасность апремиласта для пациентов с инверсным псориазом средней и тяжелой степеней [42]. Также сообщалось о случаях использования дапсона в качестве варианта лечения, показавшего высокую эффективность и полную ремиссию после 4 недель лечения [50].
Выводы
Псориаз в ПАО является нередкой клинической формой псориаза, требующей особого внимания. Распространенность инверсного псориаза достаточно высока, но об этих симптомах пациенты часто не сообщают из-за стигматизации и смущения. Иногда псориаз в ПАО трудно диагностировать из-за его клинического сходства с другими дерматозами, локализующимися в интертригинозных областях. Дерматоскопия представляет собой эффективный инструмент для расширенной неинвазивной диагностики. Лечение может быть достаточно сложным, т.к. интертригинозные области более подвержены побочным эффектам, вызванным традиционной местной терапией. Согласно консенсусу и недавнему систематическому обзору, наилучшей стратегией может быть чередование ТИК или аналога витамина D с короткими курсами топических ГКС. Рекомендации второй линии включают местные препараты каменноугольной смолы и местные ингибиторы ФДЭ-4 (например, крисаборол). Генно-инженерная биологическая терапия, в частности иксекизумаб, рекомендована при упорных или тяжелых случаях псориаза, учитывая локализованный характер заболевания. В недавнем согласованном заявлении Международного совета по псориазу признается, что псориаз особых локализаций, включая инверсный псориаз, считается одной из клинических форм, при которых пациенты могут получать системное лечение [42].
В настоящее время проводятся дополнительные исследования по использованию пероральных ингибиторов ФДЭ-4, местных средств, включая тапинароф и делгоцитиниб, и других системных методов лечения.



