Введение
На протяжении многих столетий человечество страдает от нарушений углеводного обмена. В XX в. был совершен большой шаг вперед – созданы препараты инсулина, подарившие жизнь многим пациентам, однако это не решило всех проблем сахарного диабета (СД). Со второй половины XX в. активно создавались различные сахароснижающие таблетированные препараты, часть из которых до настоящего времени успешно применяется, другие же были запрещены или используются весьма ограниченно.
В целом, несмотря на успехи фармацевтики, проблема неуклонного распространения СД на планете сохраняется. Прогноз Международной федерации диабета (IDF) на 2045 г. – 629 млн человек, что на 48% больше, чем в 2017 г. [1]. Социально-экономический груз, создаваемый осложнениями СД, нельзя недооценивать: ранняя инвалидизация, дорогостоящая реабилитация и преждевременные смерти – это последствия гипергликемии. Многие десятилетия именно данное состояние являлось «краеугольным камнем» терапии диабета. Однако в крупных многоцентровых исследованиях начала XXI в. было доказано, что одно лишь достижение нормогликемии не снижает количества сердечно-сосудистых событий, соответственно, и не продлевает жизнь пациентов с СД. В настоящее время стало очевидным, что механизмы развития сердечно-сосудистых осложнений гораздо сложнее. На современном этапе развития представлений о патогенезе СД определено 11 механизмов развития данной патологии и фокус внимания сместился от гипергликемии на β-клетки [2]. Именно восстановление работы островкового аппарата поджелудочной железы, нарушенной в условиях инсулинорезистентности (ИР), служит целью управления СД 2 типа (СД2). На данном пути совершаются лишь первые шаги, но уже достигнуты первые успехи – созданы препараты на основе гормонов-инкретинов. Осложняет ситуацию проблема «упущенного времени» – скрытого течения гипергликемии и как следствие – поздней диагностики, когда в β-клетках произошли необратимые изменения. Именно поэтому все чаще эндокринологи призывают к ранней комбинированной терапии, чтобы, «не теряя времени», воздействовать на большее количество патогенетических механизмов диабета [3]. Очевидно, что восстановление и поддержание функции β-клеток невозможны без решения проблемы ИР. Однако воздействие на данный механизм, который включает нарушение на трех уровнях – мышечная ткань, жировая ткань и печень, остается трудной задачей.
Определение ИР, ее роль и роль в развитии СД2
Развитие ИР происходит за много лет до начала гипергликемии и диагностики СД2. ИР определяется как клиническое состояние, при котором нормальный или повышенный уровень инсулина вызывает ослабленный биологический ответ, преимущественно заключающийся в нарушении утилизации глюкозы различными инсулинзависимыми тканями [4].
ИР представляет собой адаптационный механизм, необходимый человеку, когда периоды голода чередовались с периодами изобилия. Он позволяет сохранять запасы энергии в жировой ткани в неблагоприятных условиях. Для современного человека, проживающего в обществе «сверхпотребления», ИР приобрела патологическое значение [5].
Люди с ИР имеют дефекты генов на различных уровнях:
- субстрат рецептора инсулина типа 1 (IRS-1) и/или фосфатидилинозитол-3-киназа;
- пострецепторная передача сигнала: нарушение транслокации и синтеза глюкозного транспортера (ГЛЮТ)-4);
- экспрессия генов, обеспечивающих метаболизм глюкозы и липидов: глюкозо-6-фосфатдегидрогеназы, глюкокиназы, липопротеинлипазы, синтазы жирных кислот и др.
В условиях нарушения чувствительности к инсулину генетически дефектная β-клетка компенсаторно вырабатывает все большее количество инсулина, что с течением времени приводит к ее истощению и апоптозу, как следствие – к развитию клинической гипергликемии [6].
Кроме того, ИР и гиперинсулинемия (ГИ) в значительной степени ассоциируются с формированием сердечно-сосудистых заболеваний. Результаты клинических исследований подтверждают, что ИР и ГИ служат фактором риска развития атеросклероза и ишемической болезни сердца (ИБС) [7]. Имеются клинические доказательства того, что ГИ является независимым фактором риска развития ИБС для лиц без СД2. Данные R. Stout свидетельствуют: инсулин обладает атерогенным действием на стенки сосудов, вызывая пролиферацию миоцитов, активируя синтез липидов и пролиферацию фибробластов.
ИР мышечной ткани заключается в нарушении функции и уменьшении количества ГЛЮТ-4, что было показано в исследовании W.T. Garvey et al. [8]. Кроме того, важное значение имеет липотоксичность, которая развивается в результате накопления избытка свободных жирных кислот (СЖК), поступающих из жировой ткани. Повышение концентрации СЖК в плазме крови приводит к увеличению концентрации ацил-КоА и диацилглицерола в мышцах. Они активируют протеинкиназу С, что увеличивает фосфорилирование серина с последующим торможением фосфорилирования IRS-1. Прямой эффект длинноцепочечных жирных кислот на транспорт и фосфорилирование глюкозы также был продемонстрирован в мышцах: повышение их концентрации сопровождается ингибированием IRS-1 и ослаблением трансмембранного транспорта глюкозы [9].
ИР в печени обусловлена ингибирующим влиянием инсулина на глюконеогенез, в результате чего повышается продукция глюкозы гепатоцитами [10]. Дополнительно избыточное поступление СЖК из плазмы тормозит процессы транспорта и фосфорилирования глюкозы [11]. Повышение уровня СЖК вызывает резистентность к инсулину в печени путем ингибирования трансдукции сигнала инсулина. Кроме того, в исследовании G. Boden et al. показана способность СЖК подавлять ингибирующий эффект инсулина на гликогенолиз. У пациентов с СД2 увеличения концентрации СЖК в плазме сопровождаются повышением уровня глюкагона в крови и чувствительности печени к активации гликогенолиза [12].
ИР в жировой ткани представляет собой защитный механизм. При ожирении адипоциты накапливают избыток поступающих в организм СЖК, что сопровождается их гипертрофией, однако данный процесс не бесконечен и генетически обусловлен для большинства людей, в результате чего формируются гипоксия и местное воспаление, следствием которых являются нарушения жирового метаболизма. ИР и ГИ в данной ситуации активируют липопротеиновую липазу на поверхности адипоцитов, ведет к высвобождению СЖК в плазму, откуда они поступают в миоциты, гепатоциты и β-клетки [13].
Таким образом, замыкается «порочный круг» ИР, липотоксичности и дисфункции β-клеток.
Коррекция ИР
Основной причиной эпидемии СД2, с которой столкнулись в течение последних десятилетий развитые страны, может быть эпидемия ожирения. В многочисленных исследованиях показано, что снижение веса с помощью модификации образа жизни, фармакологической терапии или бариатрической хирургии увеличивает чувствительность к инсулину, снимает перегрузку в работе β-клеток и улучшает гликемию [14–16]. При снижении массы тела на 5% общая чувствительность к инсулину улучшается на 30%, а риск развития СД2 снижается почти на 58% [15].
Вмешательство в образ жизни служит эффективным подходом к улучшению чувствительности к инсулину и сохранению функции β-клеток, однако поддержание оптимальной массы тела является неустойчивым: например, после завершения исследования DPP у пациентов вес снова увеличился [17]. Поэтому одной лишь модификации образа жизни недостаточно для предотвращения СД2. По сравнению с диетой и физическими упражнениями фармакологические интервенции более успешны в борьбе против ИР, дисфункции β-клеток и прогрессирования СД2.
Несмотря на десятилетия изучения природы ИР, круг лекарственных препаратов, влияющих на нее, остается довольно ограниченным.
Метформин (1,1-диметилбигуанид) абсолютно заслуженно занимает место «золотого» стандарта в лечении СД2. Данный препарат прошел долгий и трудный путь исследований, запретов и наконец стал основой всех схем сахароснижающей терапии.
В основе его действия лежат два механизма: за сахароснижающий эффект отвечает высокоспецифичное ингибирование комплекса 1 митохондриальной дыхательной цепи, плейотропные эффекты обусловлены активацией АМФ-активируемой протеинкиназы. Основное «поле деятельности» метформина – это гепатоциты, где он взаимодействует с транспортером органического катиона-1. Ключевыми эффектами метформина являются подавление продукции глюкозы печенью, а также синтеза липидов и белков, замедление клеточного роста, стимуляция окисления глюкозы и жирных кислот [18]. Среди преимуществ метформина хотелось бы особо подчеркнуть его способность сочетаться с любыми другими сахароснижающими средствами. Именно комбинированная патогенетическая терапия СД2 в последние годы становится актуальной реальностью. В частности, сочетание метформина с ингибиторами дипептидилпептидазы-4 или агонистами глюкагоноподобного петида-1 – одна из самых выгодных комбинаций, блокирующая 10 из 11 известных патологических механизмов СД2, а при добавлении ингибиторов натрий-глюкозного котранспортера 2-го типа все эти 11 механизмов будут скорректированы [2]. Согласно последним данным Конгресса EASD 2019 г., инновационные препараты включены в первую линию терапии СД2, тем самым увеличивается вариативность и индивидуальность в лечении этого заболевания, и метформин постепенно уступает здесь первое место. Кроме того, практическим врачам хорошо известно, что часть пациентов плохо переносит прием метформина. В таких случаях способны помочь препараты группы тиазолидиндионов – агонистов γ-рецепторов, активируемых пролифераторами пероксисом (PPAR-γ).
Тиазолидиндионы появились в конце 1990-х гг. Механизм их действия заключается в связывании с PPAR-γ, которые представляют собой семейство транскрипционных факторов, отвечающих за экспрессию генов углеводного и липидного обменов в мышцах и жировой ткани. Данные рецепторы также встречаются в ядрах миоцитов и гепатоцитов. В жировой ткани тиазолидиндионы активируют дифференцировку преадипоцитов в адипоциты, увеличивают количество рецепторов к инсулину и транспортеров ГЛЮТ-1 и ГЛЮТ-4, тем самым снижая ИР. Дополнительно они уменьшают экспрессию гена лептина, опосредованно регулируя массу жировой ткани, снижают уровень СЖК и фактора некроза опухоли α, ингибируют секрецию инсулина β-клетками, повышают уровни адипонектина и оксида азота, уменьшают эндотелиальную дисфункцию. Оксид азота является сосудорасширяющей и антиатерогенной молекулой, дефицит которой способствует заметному увеличению скорости атерогенеза у пациентов с СД2 [19–21].
Благодаря плейотропному действию тиазолидиндион пиоглитазон в клинических исследованиях продемонстрировал способность замедлять прогрессирование нарушений углеводного обмена. В исследовании ACT NOW обнаружено, что данный препарат снижает риск развития диабета у лиц с ожирением и нарушенной толерантностью к глюкозе приблизительно на 70% [22]. Данный феномен парадоксален, т.к. широко известно неблагоприятное влияние на массу тела агонистов PPAR-γ. Еще более удивительно, что чем больше был индекс массы тела у пациентов, принимавших пиоглитазон, тем в большей степени снижался у них уровень гликированного гемоглобина (HbA1c) [23]. Однако побочные эффекты тиазолидиндионов не позволили данной группе препаратов вытеснить метформин с лидирующих позиций. В частности, на фоне приема тиазолидиндионов наблюдается некоторое увеличение частоты переломов костей у женщин в постменопаузе с диабетом [24]. У пациентов с СД2 в исследовании RPOactive на фоне приема пиоглитазона в ряде случаев развивалась хроническая сердечная недостаточность, хотя и без увеличения смертности [25]. В недавнем мета-анализе влияния пиоглитазона на эффективность вторичной профилактики сердечно-сосудистых заболеваний показано снижение риска рецидивов серьезных неблагоприятных сердечно-сосудистых событий (MACE) на 26%, инсульта на 19% и инфаркта миокарда на 23%. При этом у пациентов с клинически выраженными сосудистыми заболеваниями пиоглитазон не влиял на смертность от всех причин и увеличивал риск хронической сердечной недостаточности на 33% [26]. Данные исследований по сердечно-сосудистой безопасности «бросили тень» на группу тиазолидиндионов, однако они продолжают применяться в т.ч. в составе комбинированной терапии.
В рандомизированном двойном слепом 26-недельном исследовании 655 пациентам была назначена комбинация алоглиптин/пиоглитазон, что сопровождалось снижением уровня HbA1c на 0,96–1,7% и улучшением функции β-клеток: соотношение проинсулина и инсулина – 30 против 14% (р=0,006), индекс ИР HOMA-β – 67 против 16% (р=0,018) и HOMA-IR – 46 против 16% (р<0,001). Эффективность комбинации алоглиптин 25+пиоглитазон 30 мг превосходила таковую терапии одним алоглиптином [27].
В 2017 г. представлены результаты исследования M. Abdul-Ghani et al., в котором эффективность комбинации эксенатида и пиоглитазона сравнивалась с базис-болюсной инсулинотерапией. После 12 месяцев комбинированная терапия вызвала значительное снижение уровня HbA1c – с 10,0±0,6 до 6,1±0,1% по сравнению с 7,1±0,1% у пациентов, получавших терапию инсулином. В группе инсулинотерапии отмечены значительно большее увеличение массы тела и в 3 раза более высокая частота гипогликемий, чем у пациентов в группе комбинированной терапии [28]. Важно отметить, что комбинация пиоглитазона и инкретинов взаимодополняющая, при ее применении происходят улучшение утилизации глюкозы в периферических тканях; активация секреции инсулина и подавление глюкагона; коррекция «инкретинового эффекта»; замедление липолиза и снижение глюконеогенеза [29].
В РФ пиоглитазон, однако, применяется довольно ограниченно: например, по данным регистра СД2 в Москва в 2015 г. его применяли лишь 0,3% пациентов [30]. Тем не менее его использование может обсуждаться в рамках ранней комбинированной патогенетической терапии СД2.
Препарат Субетта
В РФ разработан комплексный лекарственный препарат Субетта [31], произведенный на основе антител к С-концевому фрагменту β-субъединицы рецептора инсулина и антител к эндотелиальной NO-синтазе путем многократного последовательного разведения исходных антител с параллельной внешней технологической обработкой. Он относится к группе препаратов, обладающих таргетным действием (воздействуют на определенные биологические мишени) и имеющих нозологические показания к применению, установленные в ходе рандомизированных клинических исследований их эффективности и безопасности [32].
В экспериментальных исследованиях показано плейотропное действие комплексного препарата. В частности, обнаружено, что он увеличивает количество активных рецепторов инсулина (повышает соотношение числа фосфорилированных форм β-субъединиц рецептора к общим формам) как при монотерапии, так и в комбинации с инсулином [33]. Среднее значение соотношения фосфорилированных форм β-субъединиц рецептора инсулина к общим формам в данном препарате в среде без инсулина в 11 раз превысило значения, полученные для очищенной воды (плацебо), и в 3 раза – для культуральной среды. Добавление инсулина (100 нМ) к зрелым адипоцитам, предварительно обработанным препаратом антител к С-концевому фрагменту β-субъединицы рецептора инсулина и антител к эндотелиальной NO-синтазе, приводило к увеличению оцениваемого параметра в 1,9 и 4,4 раза по сравнению со значениями, полученными для aдипoцитов, предварительно обработанных культуральной средой и очищенной водой соответственно.
Известно, что фосфорилирование β-субъединицы рецептора инсулина является инициирующим звеном нескольких внутриклеточных каскадов, включая PI3K-сигнальный путь, в конечном итоге приводящий к транслокации переносчика глюкозы ГЛЮТ-4 к клеточной мембране и увеличению транспорта глюкозы внутрь клетки [34], а следовательно, к сахароснижающему эффекту. Этот механизм справедлив и в отношении Субетты: в исследовании in vitro по изучению уровня инсулинзависимого захвата глюкозы в мышечной ткани было показано, что под действием препарата оцениваемый показатель увеличивается на 43% по сравнению с инсулином (10 нмоль) [35]. Полученные данные свидетельствуют о том, что препарат повышает чувствительность тканей к инсулину посредством увеличения количества активных ГЛЮТ-4.
Кроме того, под действием антител к С-концевому фрагменту β-субъединицы рецептора инсулина и антител к эндотелиальной NO-синтазе выявлено увеличение концентрации адипонектина [36]. Поскольку в данном исследовании препарат воздействовал на адипоциты без добавления инсулина в культуральную среду, можно предположить, что он обладает прямым влиянием на β-субъединицы рецептора инсулина адипоцитов и активирует секрецию адипонектина (рис. 1).
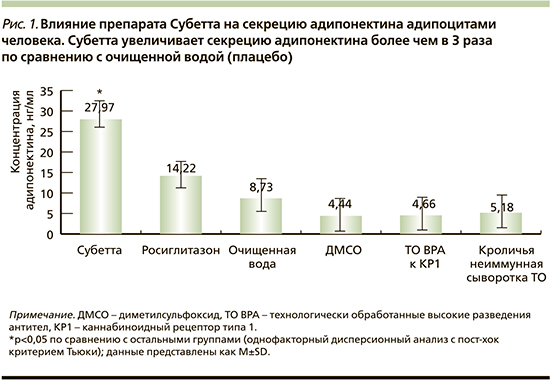
Важно также отметить, что антитела к эндотелиальной NO-синтазе, активируя свою мишень, восстанавливают уровень оксида азота, способствуют снижению реактивности сосудов, уменьшению сосудистого спазма, нормализации уровня артериального давления и улучшению периферической микроциркуляции [37, 38].
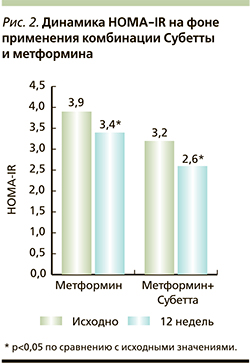 В клинических исследованиях была показана эффективность Субетты при СД2. В 2015 г. опубликованы результаты 12-недельного исследования применения данного препарата дополнительно к метформину пациентами с СД2 и неалкогольной жировой болезнью печени. Больные принимали препарат по 1 таблетке 4 раза в день, в результате отмечено достоверное снижение уровня HbA1c – с 7,7±0,58 до 6,9± 0,66% (на 0,8%, или на 10,4% от исходного значения). При непрерывном мониторировании уровня глюкозы ее усредненное значение у пациентов в основной группе снижалось через 12 недель терапии с 8,2±1,78 до 7,7±1,87 ммоль/л (на 0,5 ммоль/л, или на 6,1 % от исходного значения; p>0,05), а в контрольной группе – с 8,9±1,69 до 8,1±2,22 ммоль/л (на 0,8 ммоль/л, или на 9%; p>0,05). Дополнительно комбинация метформина с комбинированным препаратом антител к С-концевому фрагменту β-субъединицы рецептора инсулина и антител к эндотелиальной NO-синтазе улучшала показатели ИР: индекс HOMA-IR снизился с 3,2±1,53 до 2,6±1,4, или на 18,8% (р<0,05; рис. 2) [39].
В клинических исследованиях была показана эффективность Субетты при СД2. В 2015 г. опубликованы результаты 12-недельного исследования применения данного препарата дополнительно к метформину пациентами с СД2 и неалкогольной жировой болезнью печени. Больные принимали препарат по 1 таблетке 4 раза в день, в результате отмечено достоверное снижение уровня HbA1c – с 7,7±0,58 до 6,9± 0,66% (на 0,8%, или на 10,4% от исходного значения). При непрерывном мониторировании уровня глюкозы ее усредненное значение у пациентов в основной группе снижалось через 12 недель терапии с 8,2±1,78 до 7,7±1,87 ммоль/л (на 0,5 ммоль/л, или на 6,1 % от исходного значения; p>0,05), а в контрольной группе – с 8,9±1,69 до 8,1±2,22 ммоль/л (на 0,8 ммоль/л, или на 9%; p>0,05). Дополнительно комбинация метформина с комбинированным препаратом антител к С-концевому фрагменту β-субъединицы рецептора инсулина и антител к эндотелиальной NO-синтазе улучшала показатели ИР: индекс HOMA-IR снизился с 3,2±1,53 до 2,6±1,4, или на 18,8% (р<0,05; рис. 2) [39].
Сходные данные были получены в исследовании 2011 г., в котором показано существенное преимущество в группе пациентов, получавших комбинацию метформин (850 мг 2 раза в день)+технологически обработанные высокие разведения антител к β-субъединице рецептора инсулина (по 2 таблетки 4 раза в день) по сравнению с группой пациентов на монотерапии метформином. Через 6 месяцев лечения у пациентов, получавших комбинированную терапию, отмечалось снижение уровня HbA1c на 0,78%. Кроме того, установлено эффективное снижение гликемии натощак на 20,47% и уровня постпрандиальной глюкозы на 15,83% (рис. 3) [40].

В многоцентровом двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании отечественного препарата в комплексной терапии больных СД2 в параллельных группах доказана низкая частота развития нежелательных явлений, сравнимая с таковой при применении плацебо [41].
Таким образом, Субетта – зарегистрированный в РФ референтный препарат с доказанным сахароснижающим эффектом, а также с дополнительными преимуществами: снижает ИР, увеличивает продукцию адипонектина и улучшает состояние сосудистой стенки. Особенно важно отметить благоприятный профиль безопасности на фоне применения препарата, что делает его универсальным компонентом любой схемы ранней комбинированной терапии СД2.
Заключение
В последнее десятилетие диабетология переживает «фармацевтический бум»: появилось два новых класса препаратов, множество наименований. Однако проблема коррекции ИР остается актуальной. Среди сахароснижающих препаратов улучшение чувствительности к инсулину обеспечивают только метформин и тиазолидиндионы, другие классы действуют на нее лишь опосредованно. Ограничения, свойственные каждому из них, обеспечивают непрерывный поиск новых молекул, что привело к созданию и внедрению в отечественную практику лечения СД2 препарата Субетта, обладающего плейотропными эффектами. На современном этапе основной мишенью управления СД2 стала не гипергликемия как таковая, а многообразные нарушения в метаболическом статусе пациента. Это привело к формированию концепции ранней комбинированной патогенетической терапии, способной комплексно решать патофизиологические проблемы, характерные для СД2.



