Введение
Цереброваскулярные заболевания (ЦВЗ) часто выявляются у пациентов с хронической болезнью почек (ХБП) и служат дополнительным фактором, влияющим на общий прогноз. В связи с этим в последние годы активно изучаются вопросы поражения центральной и периферической нервных систем при ХБП. Доля пациентов с ЦВЗ и ХБП увеличивается с возрастом. Так, у лиц старше 60 лет ХБП и связанные с ними ЦВЗ отмечаются у каждого четвертого пациента вне зависимости от пола. К тому же классические и неклассические факторы риска развития и прогрессирования ХБП, такие как ожирение, артериальная гипертензия (АГ), сахарный диабет (СД), нарушения метаболизма пуринового, липидного и минерального обменов, в несколько раз увеличивают риски возникновения ЦВЗ [1–3]. У пациентов с ХБП при снижении фильтрационной функции ниже 60 мл/мин, т.е. при развитии почечной недостаточности (ПН), ускоряется развитие кардио-цереброваскулярных осложнений [4]. Ряд исследователей отмечают, что снижение ренальной функции служит независимым фактором риска и ведущим механизмом ускоренного развития неблагоприятных осложнений [5–7]. Этому способствуют прежде всего почечная гипофильтрация, повышенная экскреция белка с мочой, анемия, гиперурикемия, системное воспаление, окислительный стресс, гипергомоцистеинемия, нарушения фосфорно-кальциевого обмена, вторичный гиперпаратиреоз и др. [8–10]. Принимая во внимание увеличение численности людей, страдающих ХБП и ее экстраренальными осложнениями, было принято решение разделить пациентов с С3-стадией заболевания на подгруппы С3 «А» и С3 «Б». Так, при С3 «А» стадии ХБП отмечаются максимальные риски кардиои цереброваскулярных осложнений при умеренных темпах прогрессирования ПН [4]. Подгруппа С3 «А» стадии ХБП включала лиц, имевших снижение скорости клубочковой фильтрации (СКФ) в пределах 45–59 мл/ мин. Тогда как пациенты, имевшие СКФ 30–44 мл/мин, были сгруппированы в подгруппу С3 «Б» стадии ХБП, где скорость развития ПН в несколько раз превышает темпы возникновения кардиои цереброваскулярных осложнений [4]. Ряд исследователей отмечают, что в результате снижения фильтрационной функции почек накапливаются уремические токсины, такие как индоксил сульфат, мочевая кислота, соединения гуанидина, которые оказывают повреждающее влияние на центральную нервную систему [11, 12]. Важно подчеркнуть, что при наличии ПН существенно ухудшается исход ЦВЗ, ограничивается фармакологическое вмешательство из-за снижения ренальной функции. В предлагаемой статье мы попытались оценить частоту встречаемости и роль некоторых значимых факторов риска возникновения кардиои цереброваскулярных осложнений.
Цель исследования: изучить распространенность и клиникофункциональные особенности факторов риска цереброваскулярных осложнений у пациентов с ХБП и наличием ПН.
Материал и методы
Обследование участников исследования проводилось на базе Национального госпиталя Минздрава Кыргызской Республики, где сосредоточено максимальное число терапевтических коек и оказываются различные виды медико-профилактической и лечебной помощи. Проект данного исследования был обсужден и утвержден на заседании Общества специалистов по хронической болезни почек Кыргызстана (протокол № 3 от 12.05.2021). Методологическую помощь в данной работе оказали сотрудники кафедр факультетской терапии КГМА им. И.К. Ахунбаева и терапии № 2 КРСУ им. первого Президента Российской Федерации Б.Н. Ельцина (Бишкек). Всего были проанализированы анамнестические, клинические, инструментальные и лабораторные данные 356 пациентов, у которых отмечались синдром ХБП и ПН. Синдром ХБП и снижение ренальной функции ниже 60 мл/мин устанавливались согласно Клиническим рекомендациям Научного общества нефрологов России (НОНР). Средний возраст обследованных лиц равнялся 57,58 лет (минимальный – 18, максимальный – 87 лет). Численность мужчин и женщин составила 195 (54,8%) и 161 (45,2%) соответственно. Работа проведена в соответствии с Хельсинкской декларацией о правах человека. Исследование носило описательный и одномоментный характер. По общепринятой методике оценивались антропометрические и гемодинамические параметры. Наличие тахикардии, избыточной массы тела, ожирения, АГ, СД 2 типа (СД2), подагры, хронической обструктивной болезни легких (ХОБЛ), атеросклероза сонных артерий, коронарной болезни сердца (КБС), гипертрофии левого желудочка (ГЛЖ), дилатации левого предсердия (ЛП), хронической сердечной недостаточности (СН), анемии, гиперурикемии, гиперфосфатемии, гиперхолестеринемии (ГХС), дислипидемии (ДЛП), гипертриглицеридемии (ГТГ), протеинурии, а также коморбидной патологии устанавливалось согласно Российским национальным рекомендациям [13, 14]. Всем обследуемым проводились эхокардиографическое (Эхо-КГ) и биохимическое исследования. Анализировались параметры Эхо-КГ с вычислением линейных размеров сердца и индекса массы миокарда левого желудочка (ЛЖ), концентрации гемоглобина (Hb), числа эритроцитов и тромбоцитов, С-реактивного белка (СРБ), общего холестерина (ХС), ХС липопротеидов высокой плотности, ХС липопротеидов низкой плотности, триглицеридов, мочевой кислоты, фибриногена, кальция, фосфора, креатинина и цистатина С. Тяжесть ПН определялась на основании уровней сывороточного креатинина и цистатина С. Стадии ХБП устанавливали по СКФ, расчет которой проводился по уровню сывороточного цистатина С [15]. Наличие ЦВЗ устанавливали после осмотра врачей-неврологов и по данным нейровизуализационного исследования.
Статистическая обработка проводилась при помощи программного обеспечения Statistica, version 10.0. При анализе общей выборки использовали абсолютное число (n) и частоту признака (%). Данные представлены в виде М (среднее арифметическое). Для анализа выборочных данных из совокупностей, отличающихся от нормального распределения, использовали непараметрические методы. При установлении непараметрического распределения показателей данные представлены как медиана 25–75-й процентилей. Критический уровень значимости при проверке статистических гипотез принимали при р<0,05.
Результаты
На рис. 1 представлена клинико-нозологическая характеристика обследованных пациентов с ХБП и наличием ПН. Синдром ХБП в наибольшей степени выявлялся среди лиц с АГ (29%), коморбидными патологиями (27%) и КБС (15%). Среди пациентов с ХОБЛ частота встречаемости ХБП и ПН составляла 12 и 8% соответственно. Доля обследованных пациентов с гломерулои тубулопатиями оказалась немногочисленной (3 и 6% соответственно).
В момент проведения данной работы среди участников исследования всего у 62 (17,4%) пациентов регистрировалось наличие ЦВЗ (рис. 2). При этом хроническая ишемия головного мозга (ХИГМ) имела место у 57 (91,9%) обследованных пациентов. В момент сбора данных 18 (29,0%) пациентов в анамнезе перенесли ишемический инсульт (ИИ). Геморрагический инсульт (ГИ) перенесли 7 (11,2%) пациентов. В гендерном плане частота встречаемости различных типов ЦВЗ была больше среди лиц женского пола (рис. 2).
Как показано на рис. 3, ХБП и ПН значимо чаще выявлялись среди лиц пожилого (35,6%) и среднего (32,8%) возраста. Численность пациентов в молодом и старческом возрасте с ХБП составила 18,2 и 13,2% соответсвенно. ХБП и наличие ПН в основном регистрировались среди лиц мужского пола в молодом (72,3%) и среднем (60,6%) возрасте. По данным исследователей, в возрастной группе 40–50 лет риск развития ЦВЗ был в 6 раз выше, чем в группе 50–60 лет, что указывает на необходимость скрининга в более молодом возрасте, когда имеются преимущественно начальные проявления недостаточности мозгового кровообращения, а эффективность комплексного лечения может быть гораздо выше [16].

Начальная стадия ПН, т.е. С3-стадия ХБП, обнаружена у 243 (68,2%) пациентов. Численность лиц с С3-«А» стадией ХБП (n=155) оказалась многочисленной (рис. 4). У 63 (17,6%) пациентов наблюдалась резко сниженная фильтрационная функция почек. Наличие терминальной стадии ХБП (С5) обнаружено у 50 человек в 14,0% случаев.
На рис. 5 представлена частота встречаемости нарушений жирового обмена среди обследованных пациентов. В целом распространенность нарушений жирового обмена составила 55,8%. В частности, избыточная масса тела выявлена у 103 (28,9%) пациентов. Ожирение I и II степеней было у 71 и 13 пациентов соответственно. Ожирение III степени имели 12 обследуемых, большинство из них оказались лицами женского пола.
Были проанализированы электрокардиографические и Эхо-КГ-изменения у пациентов с ХБП и ПН (рис. 6). В качестве аритмии сердца принимали клинически значимое нарушение возбудимости и/или проводимости миокарда. Частота сердечных сокращений (ЧСС) ниже 60 уд/мин (в отсутствие приема βи кальций блокаторов) регистрировалась у 17 (4,7%) пациентов (47% мужчин и 53% женщин). Увеличение ЧСС≥80 уд/мин отмечено в 42,9% случаев (56,2% мужчин и 43,8% женщин). Увеличение размера ЛП≥4,01 см было у 141 (39,6%) пациента. Дилатация ЛП в большей части выявлялась среди лиц мужского пола по сравнению с женщинами (57,4 и 42,6% соответственно). Средний возраст пациентов, у которых отмечалась дилатация ЛП, равнялся 61,2 года. Что касается фильтрационной функции почек, то медиана и интерквартильные показатели сывороточных биомаркеров, снижение ренальной функции были следующими: креатинин – 133,7 (96,0; 263,0) мкмоль/л, цистатин С – 1,95 (1,47; 3,13) мг/л, расчетная СКФ – 36,8 (21,1; 50,3) мл/мин по методике Хоуке. При анализе частоты встречаемости ГЛЖ увеличение индекса массы миокарда ЛЖ≥115 г/м2 у мужчин и 95 г/м2 у женщин регистрировалось у 255 (71,6%) пациентов. ГЛЖ отмечалась у 52,1% мужчин и 47,9% женщин. Средний возраст пациентов с ГЛЖ составил 57,8 года, а уровни сывороточного креатинина и цистатина С – 131,0 (93,9; 246,4) мкмоль/л и 1,90 (1,47; 3,15) мг/л соответственно. Величина СКФ, рассчитанная по методике Хоуке, равнялась 37,7 (21,0; 50,3) мл/мин. Следствием анатомо-функциональных изменений левых отделов сердца является развитие СН. Так, у обследованных нами пациентов в 11,2% случаев выявлены признаки систолической дисфункции ЛЖ со снижением фракции выброса ЛЖ≤40%, более свойственные лицам мужского пола (рис. 6). Возраст пациентов, у которых регистрировалась хроническая СН, был не старшим, т.е. средним (55,4 года). При анализе почечной функции, как и следовало ожидать, концентрация сывороточного креатинина 137,0 [103,0; 421,6] мкмоль/л и цистатина С 2,27 [1,59; 3,83] мг/л были завышенными. Меи Q1–Q3-показатели почечной фильтрации оказались сниженными: расчетная СКФ – 30,0 [16,3; 46,1] мл/мин.
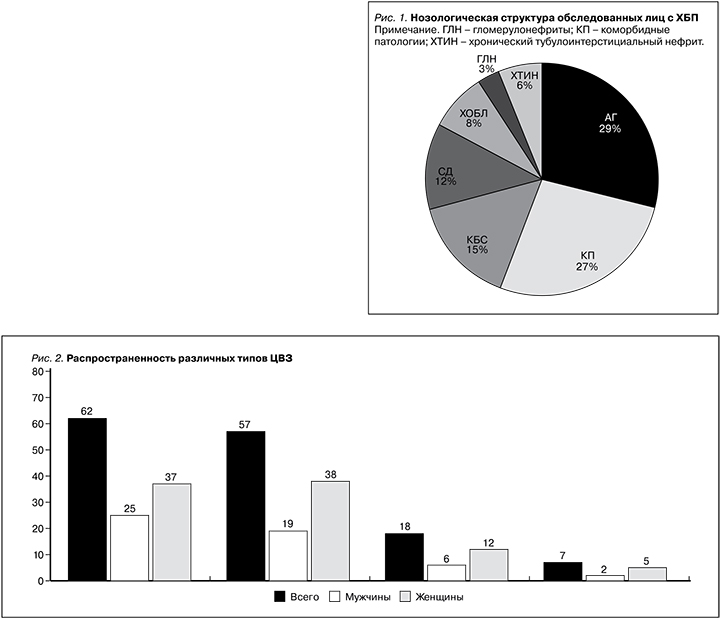
При допплерографическом исследовании признаки субклинического атеросклероза сонных артерий выявлялись у 113 (31,7%) пациентов (рис. 7).
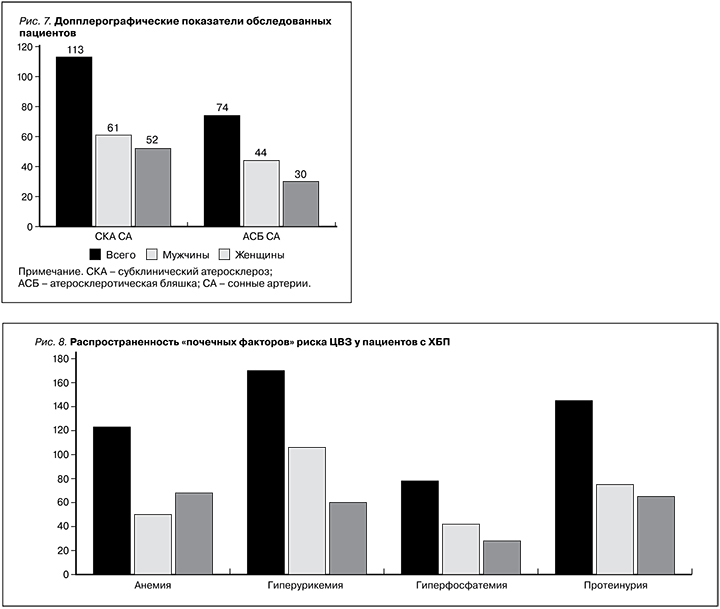
Наличие атеросклеротических бляшек в сонных артериях обнаружено у 74 (20,7%) пациентов (44 мужчины и 30 женщин). По данным лабораторной части исследования был проведен анализ распространенности отдельных, т.н. почечных факторов риска цереброваскулярных расстройств (рис. 8). Наиболее распространенными факторами ЦВЗ оказались повышенные уровни мочевой кислоты крови (48,8%), патологическая экскреция белка с мочой (42,6%) и анемия (36,2%). Повышение концентрации фосфора сыворотки крови наблюдалось у 82 (23,0%) пациентов, из которых доля мужчин и женщин составила 59,7 и 40,3% соответственно.
Как показано на рис. 9, распространенность ГХС, ГТГ и ДЛП составила 35,9%, 31,7 и 33,1% соответственно. Частота ГХС была выше среди лиц женского пола по сравнению с мужчинами (56,3 и 43,7% соответственно). Распространенность ГТГ (49,6% мужчин и 50,4% женщин) и ДЛП (47,5% мужчин и 52,5% женщин) с учетом половых различий значимо не различались.
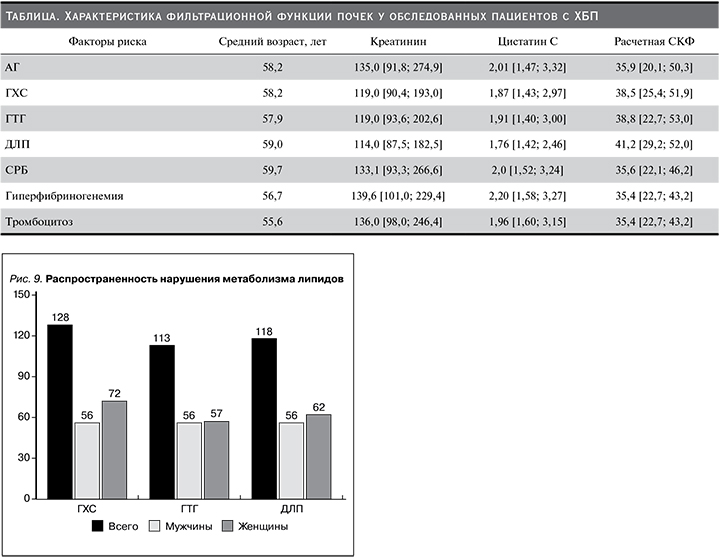
В таблице представлена характеристика тяжести азотовыделительной функции почек. Так, обследованные лица с АГ, ГХС, ГТГ, ДЛП, повышением числа тромбоцитов в периферической крови, а также увеличением содержания белков острой фазы в крови по возрасту значимо не различались. Однако медиана и интерквартильные показатели сывороточного креатинина и цистатина С различались значимо. Сравнительно высокие концентрации сывороточного креатинина были свойственны лицам ХБП в сочетании гиперфибриногенемией: 139,6 [101,0; 229,4] мкмоль/л и повышением числа тромбоцитов в периферической крови: 136,0 [98,0; 246,4] мкмоль/л. Тогда как медиана и интерквартильные концентрации сывороточного цистатина С были значимо выше среди пациентов с ХБП и АГ – 2,01 [1,47; 3,32], с ХБП и гиперфибриногенемией – 2,20 [1,58; 3,27], а также ХБП с повышенным содержанием СРБ крови – 2,0 [1,52; 3,24] мг/л. Согласно критериям включения в исследование, у всех пациентов с ХБП с различными факторами риска ЦВЗ отмечалось снижение фильтрационной функции почек ниже 60 мл/мин. Нужно отметить, что повышение содержания фибриногена крови выявлено у 82 (23,0%) пациентов, из них у мужчин и женщин в 54,9 и 45,1% случаев соответственно. Увеличение циркулирующих тромбоцитов в периферической крови отмечалось у 45 (12,6%) пациентов, из них у мужчин и женщин в 37,8 и 62,2% случаев соответственно. В анализируемой выборке повышенные концентрации СРБ крови замечены у 85 (23,8%) пациентов, из них у мужчин и женщин в 55,2 и 44,8% случаев соответственно.
Обсуждение
ХБП служит потенциальным фактором риска развития атеросклеротических, сердечно-сосудистых, цереброваскулярных осложнений, и это продемонстрировано в серии клиникоэпидемиологических исследований [4, 17, 18–21]. В то же время у лиц с атеросклеротическими сердечно-сосудистыми заболеваниями регистрируется наибольшая распространенность ХБП [4]. Так, в проведенном нами исследовании (рис. 1) синдром ХБП наиболее часто выявлялся у пациентов с АГ (29%), коморбидными патологиями (27%) и КБС (15%). Стоит отметить, что в качестве коморбидной патологии мы принимали случаи ассоциации АГ с СД2, АГ с КБС, АГ, СД2 и ХБП, АГ, КБС и ХБП. По сведениям литературных данных, у пациентов с ХБП на стадии ПН существенно повышаются риски развития фатальных сердечно-сосудистых и церебральных осложнений [4, 5]. К основным неврологическим осложнениям ХБП относятся хроническая ишемия головного мозга, когнитивные нарушения, уремическая энцефалопатия, периферическая невропатия, дисфункция автономной нервной системы и инсульт [11].
Существует тесная связь между степенью и длительностью повышения артериального давления и развитием ХБП, с одной стороны, и возникновением ЦВЗ, с другой. Ряд исследователей продемонстрировали, что АГ, ХБП и ЦВЗ имеют схожие патогенетические механизмы и, сосуществуя, эти патологические состояния ускоряют прогрессирование новых осложнений и значительно отягощают их течение [4, 5]. В нашей работе синдром ХБП в 29% случаев ассоциировался с АГ (рис. 1). При рассмотрении фильтрационной функции почек выяснилось, что медиана и интерквартильные концентрации сывороточного цистатина С были значимо выше: 2,01 (1,47; 3,32) мг/л. По опубликованным данным, высокие концентрации сывороточного цистатина С сопровождаются накоплением β-амилоида в головном мозге, что приводит к развитию ЦВЗ [22, 23].
Высокая распространенность факторов цереброваскулярного риска при ХБП свидетельствует о необходимости ее адресного скрининга в отделениях общетерапевтического профиля. Нужно отметить, что среди участников нашего исследования всего у 62 (17,4%) пациентов регистрировались различные клинические типы ЦВЗ (рис. 2). У 29,0% обследуемых нами лиц в анамнезе был перенесенный ишемический, в 11,2% – геморрагический инсульт. Ранее сообщалось, что при ХБП и наличии ПН риск возникновения инсульта увеличивается в 3,7 раза [24]. Исследователи T. Dad и D.E.Weiner (2015) показали, что расходы, связанные с ведением пациентов с инсультом и ХБП, в 5 раз выше, чем средние расходы для участников программы медицинского страхования в США [25]. В работе А.М. Шутова установлено, что частота начального снижения фильтрационной функции почек у пациентов в остром периоде инсульта составляет 33% [26]. По данным зарубежных исследователей, при проведении магнитно-резонансной томографии асимптомные инфаркты головного мозга выявляются у каждого второго пациента с С4-стадией ХБП [27]. Необходимо помнить, что в постинсультном периоде примерно у каждого четвертого пациента развивается ХБП [28]. Н.А. Овсянникова, А.Л. Арьев и Н.М. Жулев сообщают, что реализация ХБП и ее прогрессирования в постинсультном периоде осуществляются по единому механизму активации нейроиммуноэндокринной системы. По мнению исследователей, при развитии церебральной ишемии происходит одновременная активация симпатической нервной системы, гипоталамо-гипофизарно-надпочечниковой и ренин-ангиотензиновой систем [16]. Увеличивается продукция ренина и ангиотензина-II, что сопровождается ростом уровня катехоламинов и повышением секреции альдостерона. В свою очередь повышение содержания ренина вызывает экспрессию генов раннего реагирования и развитие апоптоза. Альдостерон вызывает изменения в почках и прогрессирование протеинурии [4, 5]. Имеются сведения, согласно которым течение инфаркта головного мозга независимо связано с выраженностью протеинурии [29]. На рис. 8 показано, что протеинурия как фактор риска развития ЦВЗ отмечался у 42,6% пациентов. Важнейшим моментом последствий протеинурии является хроническая гиперактивация ренин-ангиотензин-альдостероновой системы (РААС) [4, 5]. Известно, что основная часть тканевого компонента РААС сосредоточена в эндотелии сосудов. Следовательно, повышенная активация РААС – это непременный атрибут эндотелиальной дисфункции и атеросклероза [5]. Механизмы развития и прогрессирования ЦВЗ на этапе снижения фильтрационной функции почек многофакторные и включают также и нарушения системы гемостаза [30].
В связи с омоложением ЦВЗ в общей популяции и широким распространением полифармакотерапии в лечении неврологических пациентов целесообразна единовременная оценка СКФ и уровня альбуминурии/протеинурии [4]. В случае несвоевременной коррекции протеинурии у больных ЦВЗ длительная патологическая экскреция белка с мочой приводит к гломерулярным и тубулоинтерстициальным изменениям [31].
На стадии ПН повышение сывороточных уровней мочевой кислоты у мужчин и женщин (>0,42 и >0,36 ммоль/л соответственно) может служить дополнительным фактором риска развития ЦВЗ [4, 5]. В нашем исследовании наличие гиперурикемии выявлено у 48,8% обследованных лиц (рис. 8). Нефроцеребральные эффекты гиперурикемии заключаются в том, что в условиях стойкого повышения уровня мочевой кислоты развиваются эндотелиальная дисфункция и нарушение продукции оксида азота, что в свою очередь приводит к вазоконстрикции сосудов головного мозга и клубочкового аппарата почек [32, 33]. Активация тканевого компонента РААС провоцирует воспаление и окислительный стресс, тем самым формируются гломерулои тубулопатии, ухудшаются упруго-эластические свойства сосудистой стенки [34]. С другой стороны, гиперурикемия является потенциальным механизмом, лежащим в основе повышенного риска развития АГ и анемии [35]. Было установлено наличие связи между повышенным уровнем мочевой кислоты и риском развития АГ [36]. По данным другой работы, у лиц с симптомной гиперурикемией распространенность инсульта составляла 10,4% [37]. Клиническое значение гиперурикемии как фактора социально-значимых заболеваний было детально изложено в серии научно-практических исследованиях [38, 39].
Анемия, являясь наиболее частым лабораторным проявлением ПН, может быть потенциальным фактором риска ЦВЗ, а именно когнитивных нарушений [40]. Так, при анемии в результате реактивного тромбоцитоза наблюдаются тромбоз венозных синусов и артериальные церебральные инфаркты с возможным наслоением тромбов или тяжелой гипоксией, вызывающих неврологический дефицит [41]. Как показано на рис. 8, признаки анемии отмечались у 36,2% пациентов. Центральным механизмом в возникновении когнитивных нарушений у пациентов с анемией служит хроническая гипоперфузия головного мозга, которая приводит к истощению механизмов компенсации, снижению энергетического обеспечения головного мозга, что сопровождается развитием морфофункциональных расстройств [42]. При нефрогенной (эритропоэтин-дефицитной) анемии наблюдаются уменьшение содержания кислорода и глюкозы в крови, развитие лактоацидоза, сдвиг метаболизма глюкозы в сторону анаэробного гликолиза, с одной стороны, с другой – формирование гиперосмолярности с капиллярным стазом и повышение склонности к тромбообразованию [43].
Обсуждая «почечные факторы риска» ЦВЗ, следует отметит роль гиперфосфатемии. У нефрологических пациентов стойкое повышение сывороточного фосфора ≥1,45 ммоль/л считается значимым фактором риска кальцификации сосудов [44, 45]. Накопление фосфора в крови как результат снижения его мочевой экскреции в основном наблюдается на С4-стадии ХБП [44, 45]. В нашем исследовании повышение концентрации сывороточного фосфора выявлено у 82 (23,0%) пациентов, из них доля мужчин и женщин составила 59,7 и 40,3% соответственно (рис. 8). Повышение сывороточного уровня фосфора на каждые 0,32 ммоль/л связано с ростом интенсивности формирования кальцификации аортального и митрального клапанов на 25 и 62% соответственно [46]. При гиперфосфатемии кальцификация может происходить и в сонных артериях, что способствует ускоренному развитию атеросклеротического процесса, который лежит в основе возникновения инсульта [47, 48].
Вклад нарушения метаболизма липидов в развитии ЦВЗ общеизвестен. Как показано на рис. 9, частота встречаемости ГХС, ГТГ и ДЛП составила 35,9%, 31,7 и 33,1% соответственно. Как уже было сказано, при наличии «почечных факторов риска» существенно ухудшаются показатели жесткости сосудов и толщина комплекса интима-медиа (КИМ) сонных артерий. При ХБП наибольший вклад в развитие ЦВЗ вносят атерои артериолосклеротические изменения брахиоцефальных артерий и их ветвей [49, 50]. Среди обследованных нами пациентов признаки субклинического атеросклеротического поражения сонных артерий выявлены у 113 (31,7%) пациентов (рис. 7). Наличие атеросклеротических бляшек в сонных артериях обнаружено у 74 (20,7%) пациентов. Важно отметить, что патогенетически значимым в развитии хронической ишемии головного мозга считается стеноз, составляющий не менее 70% просвета сонных артерий. В настоящее время все каротидные стенозы по степени сужения артерии делятся на малый (0–29%), умеренный (30–49%), выраженный (50–69%), критический стенозы (70–99%) и окклюзию (100%) [51]. Важно помнить, что часто атеросклеротическое поражение обнаруживается в области бифуркации общей сонной артерии и проксимальном отделе внутренней сонной артерии [52]. В исследовании Т.Г. Басковой и соавт. (2016) среди факторов риска развития ИИ преобладали АГ (96,2%), ДЛП (84,8%), мужской пол (63,9%), курение (44,8%) и СД2 (27,6%). По данным авторов, из сопутствовавших заболеваний у пациентов наиболее часто присутствовали хроническая ишемия головного мозга (97,1%), АГ (96,2%), КБС (84,8%) [52].
Всеми исследователями признается, что ПН является значимым фактором риска развития старения сосудов. Атеросклероз сонных артерий может приводить к ускоренному ишемическому повреждению вещества головного мозга, затрагивающего преимущественно зоны смежного кровообращения на границе сосудистых бассейнов [53, 54]. Как показано на рис. 2, в структуре ЦВЗ превалировали лица с хронической ишемией головного мозга (91,9%), соотношение мужчин и женщин составило 33,3 и 66,7% соотвтетственно.
Полученные нами данные вполне согласуются с результатами других исследований, где было показано, что наиболее распространенным вариантом поражения центральной нервной системы при ПН является хроническая ишемия головного мозга [55, 56]. В недавно опубликованном обзорном исследовании отмечено, что у лиц с ХБП даже с сохранной фильтрационной функцией почек значимо чаще, чем в общей популяции, выявляются морфофункциональные изменения головного мозга в виде истончения, атрофии и инфарктов белого вещества [57]. В исследовании Н.А. Мухина и соавт. показано, что по мере снижения фильтрационной функции почек увеличивается частота начальных проявлений хронической ишемии головного мозга. Как сообщают исследователи, при нейровизуализации у 30% из них были выявлены очаговые изменения, почти у 25% – лейкоареоз, у 50% – расширение боковых желудочков и у 10% – выраженное расширение борозд полушарий головного мозга [30].
Установлено, что между ЦВЗ и ХБП существует двунаправленная взаимосвязь. В условиях атерои артериолосклеротических изменений брахиоцефальных артерий величина перфузии снижается более чем в 2 раза, постепенно приближаясь к «инфарктному» порогу кровоснабжения мозга, при котором начинается гибель нейронов [58]. В исследовании А.Л. Арьева и соавт. (2010) показано, что среди пациентов (n=138) с хронической ишемией головного мозга частота снижения фильтрационной функции почек составляла 64–65% [59]. Ранее в исследовании G.Piñol-Ripoll, I. de la Puerta и F. Purroy (2009) было установлено, что у пациентов (n=273) с ИИ дисфункция почек С2-градации выявлена в 46,8% случаев. В рамках данного исследования частота умеренного снижения фильтрационной функции почек (С3) регистрировалась в 24,7% случаев у обследованных лиц с ИИ [60]. Столь широкая встречаемость дисфункции почек у пациентов с ЦВЗ объясняется накоплением массы факторов риска дисфункции почек, с одной стороны, и общностью патогенетических механизмов развития и прогрессирования цереброваскулярной болезни и ХБП, с другой [11, 55, 56, 58, 59, 61].
В современной литературе частота встречаемости различных подтипов инсульта у пациентов с ХБП не изучена. Хотя указаний на связь инсульта с структурно-функциональным изменением сердца в литературе достаточно [62]. В инструментальной части нашего исследования (рис. 6) наличие брадии тахиаритмии регистрировалось в 4,7 и 42,9% случаев. Здесь стоит отметить, что среди обследованных нами пациентов с ХБП и ПН случаи гиперкалиемии обнаружены не были. В общей популяции нарушения сердечного ритма у пациентов с инсультом проявляются наджелудочковыми и желудочковыми экстрасистолами, фибрилляцией предсердий, брадикардией, тахикардией, которые сопровождаются нарушениями межжелудочковой проводимости и блокадой ножек пучка Гиса [63, 64]. Аритмии сердца усугубляют церебральную гемодинамику, влияя на течение как инсульта, так и ХБП. Частые наджелудочковые экстрасистолы могут вызывать снижение церебрального кровотока на 7%, желудочковые экстрасистолы на 12%, а желудочковая пароксизмальная тахикардия на 40–75% [65]. Известно, что при дилатации ЛП из-за фибрилляции предсердий повышается риск развития ИИ. Перегрузка левых отделов сердца вследствие АГ и анемии сопровождается существенным расширением полостей сердца. Так, по данным Эхо-КГ, дилатация ЛП была нами выявлена у 141 (39,6%) пациента (81 мужчина и 60 женщин) (рис. 6). В обследуемой когорте больных распространенность ГЛЖ была высокой – 71,6% случаев. В проведенном нами исследовании хроническая СН со сниженной фракцией выброса ЛЖ (≤40%) наблюдалась у 40 (11,2%) пациентов (рис. 6), их средний возраст составил 55,4 года. Причем систолическая дисфункция ЛЖ значимо чаще встречалась среди лиц мужского пола (75%) по сравнению с женщинами (25%). Концентрации сывороточного креатинина и цистатина С были следующими: 137,0 [103,0; 421,6] мкмоль/л и 2,27 [1,59; 3,83] мг/л. Величина фильтрационной функции почек оказалась резко сниженной (медиана расчетной СКФ составила 30,0 мл/мин).
Как показывают результаты проспективных исследований, наибольшее число сердечно-сосудистых событий отмечается среди пациентов с концентрическим типом ГЛЖ [66]. При концентрическом типе ГЛЖ существенно возрастают риски повторного ИИ [67], а увеличение размеров как ЛП, так и ЛЖ ассоциируется с электрической нестабильностью миокарда с повышением риска возникновения аритмии, в первую очередь фибрилляции предсердий, которая в свою очередь повышает риск развития острых и хронических форм ЦВЗ. Очевидно, что пациенты с выявленной дилатацией ЛП и высоким риском фибрилляции предсердий должны расцениваться как лица с потенциально высоким риском ЦВЗ. Результаты ультразвукового исследования сонных артерий показали, что увеличение толщины КИМ>0,9 мм регистрировалось у 31,7% обследованных пациентов.
Риск атеросклеротического поражения сонных артерий увеличивается при ХБП в сочетании с АГ. В проведенном нами исследовании превышение толщины КИМ≥1,5 мм или наличие локального увеличения толщины на 0,5 мм или на 50% обнаружено у 20,7% пациентов (рис. 7).
К возникновению турбулентностей и микроэмболов в сонных артериях могут приводить резко выраженный характер бляшки, на уровне которой происходит срыв ламинарного кровотока на турбулентный [68]. Хотя по данным исследований гиперэхогенные бляшки прогностически более опасные в отношении развития острых форм ЦВЗ, следует отметить, что влияние атеросклероза на состояние церебрального кровообращения не ограничивается локальными гемодинамическими факторами [69]. Со временем в атеросклеротических бляшках происходят воспаление, отек, разрушение, кровоизлияние, расслоение сосудистой стенки с последующим тромбозом и развитием тромбоэмболических цереброваскулярных расстройств.
Определение уровня СРБ и других острофазовых маркеров воспаления может быть полезным для выбора стратегии лечения не только ЦВЗ, но и ХБП [70]. В рамках нашего исследования у 23,0% пациентов выявлено повышение содержания фибриногена крови, а увеличение числа циркулирующих тромбоцитов в периферической крови и высокие уровни СРБ отмечались у 12,6 и 23,8% пациентов соответственно. В недавно опубликованном исследовании отмечено атерогенное свойство СРБ за счет активации инфламмасом и продукции воспалительных цитокинов в атеросклеротических бляшках [71].
В других исследованиях отмечена положительная связь концентрации СРБ с наличием и тяжестью сердечно-сосудистых заболеваний [72]. Есть указание, что СРБ вступает в связь между воспалением и атеросклеротическими сердечно-сосудистыми заболеваниями. Так, была показана способность мономерного СРБ активировать тромбоциты и гликопротеиновые рецепторы IIb/IIIa. Хотя рецептор, ответственный за протромботические эффекты изоформы мономерного СРБ, до конца не выяснен [72], вклад острофазовых белков и тромбоцитов при ПН в развитии ЦВЗ не вызывает сомнений и требует дальнейших активных исследований.
Подводя итог литературных и собственных данных, следует отметить, что именно у пациентов с ХБП и ПН диагностический поиск в отношении риска развития цереброваскулярных осложнений должен быть первоочередным и тщательным. Своевременное выявление и коррекция факторов цереброваскулярного риска при ХБП улучшат приверженность пациентов фармакологическим и нефармакологическим методам торможения прогрессирования темпов ПН.
Выводы
Таким образом, проведенные исследования показали, что у их участников распространенность ЦВЗ составила 17,4%, где наиболее распространенным типом ЦВЗ оказалась хроническая ишемия головного мозга, а частота ишемических и геморрагических инсультов составила 29,0 и 11,2% соответственно. В гендерном разрезе частота встречаемости различных типов ЦВЗ была больше среди лиц женского пола. Распространенность нарушений жирового обмена составила 55,8%. Увеличение размера ЛП выявлено у 39,6% пациентов. Распространенность ГЛЖ и систолической дисфункции ЛЖ составила 71,6 и 11,2% соответственно. Частота встречаемости структурно-функциональных изменений сонных артерий у обследованных пациентов с ХБП и ПН достигла 52,5%. В структуре «почечных факторов риска» цереброваскулярных расстройств наиболее распространенными оказались гиперурикемия (48,8%), протеинурия (42,6%), анемия (36,2%) и гиперфосфатемия (23,0%). Распространенность традиционных факторов цереброваскулярного риска, таких как ГХС, ДЛП и ГТГ, составила 35,9%, 33,1 и 31,7% соответственно. Повышение содержания фибриногена крови выявлено у 23,0% пациентов. Увеличение циркулирующих тромбоцитов в периферической крови отмечено в 12,6% случаев. В анализируемой выборке повышенные концентрации СРБ крови были замечены у 23,8% пациентов.
С учетом распространенности и многообразия факторов риска ХБП, которые могут лежать в основе ЦВЗ, обследование пациентов общетерапевтического профиля при наличии ПН даже в отсутствие явной клинической картины цереброваскулярных расстройств должно быть направлено на устранение их потенциальных факторов риска. Вместе с тем целесообразно оценить фильтрационную функцию почек таких лиц с использованием сывороточного креатинина и цистатина С, а также выделить отдельную диспансерную группу на амбулаторнополиклинических этапах ведения пациентов этой категории.



