Введение
Известно, что острые респираторные вирусные инфекции (ОРВИ), обусловленные возбудителями, принадлежащими минимум к 6 семействам (ортомиксо-, парамиксо-, пикорна-, корона-, парво-, адено-) вирусов, стойко занимают ведущее место в структуре инфекционных заболеваний, особенно в детской инфекционной патологии. В России ОРВИ ежегодно регистрируют примерно на уровне 70–80 тыс. заболеваний на 100 тыс. населения детского возраста (в 3,3 раза выше, чем у взрослых) без тенденции к снижению. Частота встречаемости случаев гриппа при этом наблюдается нередко реже, чем заболеваний другой этиологии в сумме, даже в период его сезонного эпидемического подъема.
И только у пациентов любого возраста с тяжелой формой инфекции доминируют заболевания, обусловленные вирусами гриппа: в настоящее время преимущественно возбудителем пандемии 2009 г. – вирусом гриппа типа А (H1N1) pdm 2009 [1–3]. Примерно в 25–30% случаев, особенно во вновь созданных коллективах (группа детского дошкольного учреждения, первый класс школы, палата стационара, казарма призывников), имеет место одновременное участие в инфекционном процессе нескольких возбудителей, обусловленное эффектом «перемешивания».
Установлено также, что ОРВИ, несмотря на обязательное поражение слизистых оболочек носоглотки и верхних дыхательных путей, отличаются значительным полиморфизмом клинической симптоматики, а большинство их возбудителей, кроме вирусов гриппа, – отсутствием чувствительности к современным популярным противовирусным препаратам: ингибиторам нейраминидазы осельтамивиру и занамивиру, используемым в настоящее время при лечении гриппа [4].
Кроме того, применение данных препаратов возможно только при лечении пациентов старше 1 года (осельтамивир) и с 5 лет (занамивир), а ингибитора слияния умифеновира – при всех ОРВИ, но у детей не ранее 2-летнего возраста [5].
Статистика
Согласно данным Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека следует, что число заболевших ОРВИ детей в возрасте до 17 лет в 2016 г. в РФ было больше числа заболевших взрослых в 2,64 раза, в 2017 г. – в 2,71, в 2018 г. – в 2,51 раза, а в перерасчете на 100 тыс. населения соответствующего возраста число ОРВИ у детей в возрасте до 17 лет больше числа всех заболевших в 2016 г. в 3,71 раза, в 2017 г. – в 3,73, в 2018 г. – в 3,58 раза, при этом наибольшее число заболевших находится в возрастной группе до 14 лет (табл. 1).
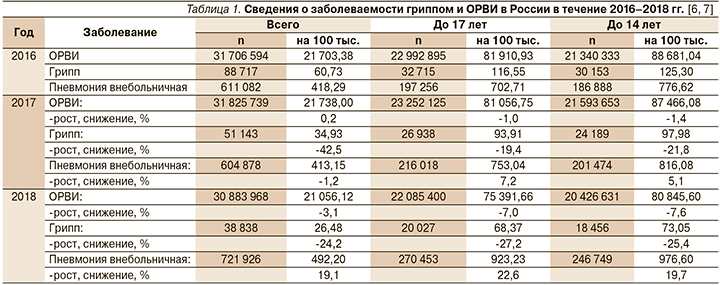
Следует отметить, что частота регистрации гриппа как у всего населения страны, так и в обеих возрастных группах детей в описываемый период времени была существенно более редкой, чем ОРВИ другой этиологии (на 100 тыс. всего населения: в 2016 г. – в 357,4 раза, в 2017 г. – в 622,3, в 2018 г. – в 795,2 раза) [6, 7]. Число зарегистрированных случаев гриппа у детей (в пересчете на 100 тыс.) в 2016 г. было в 2 (в возрасте до 17 лет) и в 3 раза больше (в возрасте до 14 лет), в 2017 г. – в 3 раза больше в обеих группах, в 2018 г. – примерно в 2,5 раза больше, чем у всего населения.
Частота регистрации внебольничной пневмонии у детей (в пересчете на 100 тыс.) была также более высокой (в 2016 г. – в 1,7 и 1,9 раза; в 2017 г. – в 1,7 и 2,0; в 2018 г. – в 1,9 и 2,0 раза), чем у всего населения в целом.
Несколько иные данные получены при анализе частоты регистрации верифицированного гриппа среди 10 399 пациентов, госпитализированных по поводу данного заболевания в 3 инфекционных стационара (2 для детей и 1 для взрослых) Санкт-Петербурга (базы ФГБУ НИИ гриппа) во время сезонных (с ноября текущего года по май следующего) эпидемических подъемов гриппа и ОРВИ в течение 2015–2019 гг. (табл. 2). Этиология заболеваний устанавливалась при помощи полимеразной цепной реакции (ПЦР) в материалах со слизистой оболочки носовых ходов или носоглотки пациентов [8].
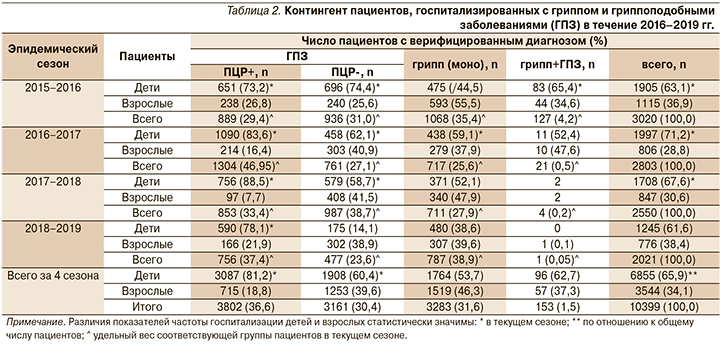
В целом удельный вес пациентов с верифицированным гриппом (моно+микст) составил всего 33,1% из всего наблюдаемого контингента, в т.ч. 39,6% в сезон 2015–2016 гг., 26,3% – в сезон 2016–2017 гг., 28,1% – в сезон 2017–2018 гг. и 38,9% – в сезон 2018–2019 гг. Вместе с тем удельный вес гриппа у госпитализированных детей был несколько более низким (29,3% в сезон 2015–2016 гг., 22,5% – в сезон 2016–2017 гг., 21,8% – в сезон 2017–2018 гг. и 38,6% – в сезон 2018–2019 гг.), что статистически значимо, кроме сезона 2018–2019 гг., отличалось от данных, полученных от взрослого контингента (57,1% в сезон 2015–2016 гг., 35,9% – в сезон 2016–2017 гг., 40,4% – в сезон 2017–2018 гг. и 39,7% – в сезон 2018–2019 гг.). При этом общее число госпитализированных больных ГПЗ, т.е. ОРВИ разной этиологии (ПЦР+ и ПЦР- в сумме), во все наблюдаемые эпидемические сезоны преобладало над числом больных верифицированным гриппом, особенно среди детского контингента. Оказалось также, что в целом число детей, поступивших для стационарного лечения, всегда статистически значимо доминировало над числом взрослых. Вместе с тем в некоторые эпидемические сезоны, в частности в сезон 2015–2016 гг., число взрослых пациентов с верифицированным гриппом преобладало над числом детей.
Показано, что основной контингент госпитализированных детей в анализируемый период времени относился к возрастной группе 0–2 года (978/51,4% из 1905 человек в сезон 2015–2016 гг., 1251/62,7% из 1997 человек в сезон 2016–2017 гг., 1089/63,8% из 1708 человек в сезон 2017–2018 гг. и 749/60,2% из 1245 в сезон 2018–2019 гг. (табл. 3, рис. 1).
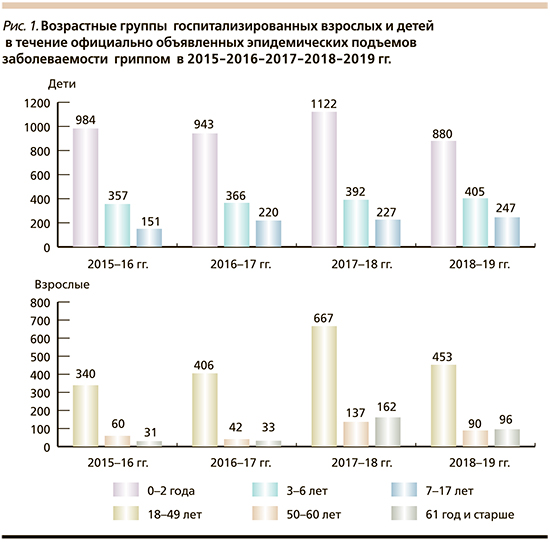
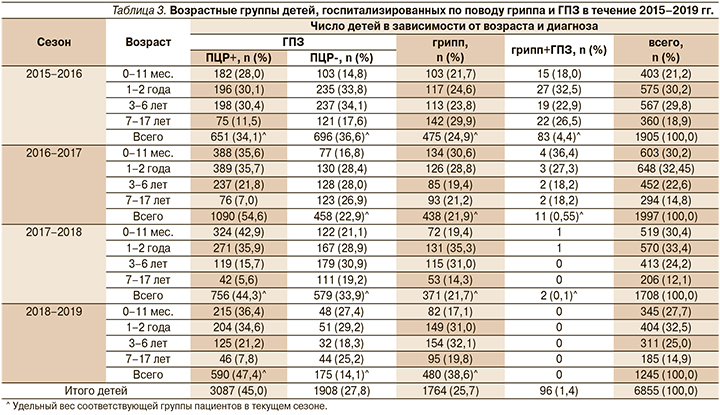
Число госпитализированных школьников в возрасте 7–17 лет было наименьшим (360/18,9% из 1905 человек в 2016 г., 295/14,8% из 1997 человек в сезон 2017–2018 гг. и 206/12,1% из 1708 человек в 2018 г.). При этом во всех возрастных группах детей число случаев ГПЗ (ПЦР+ и ПЦР- в сумме) преобладало над числом случаев с верифицированным гриппом.
Среди взрослого контингента доминировали молодые пациенты в возрасте 18–49 лет (944/84,7% из 1115 человек в 2016 г., 727/90,2% из 806 человек в 2017 г. и 607/71,7% из 847 человек в 2018 г.) (табл. 4). Госпитализированные пациенты в возрасте 61 года и старше составили всего 7,4% в 2016 г., 4,0% – в 2017 г., но 15,4% – в 2018 г.
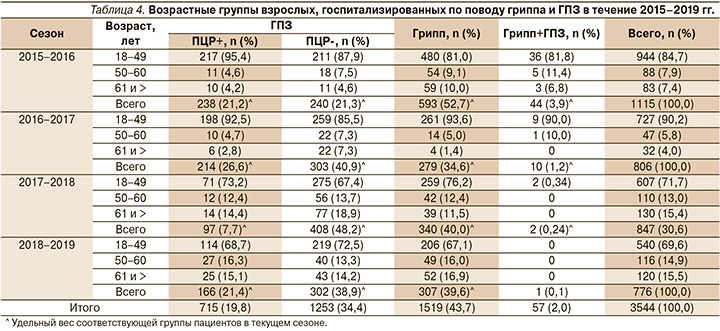
Этиология ГПЗ
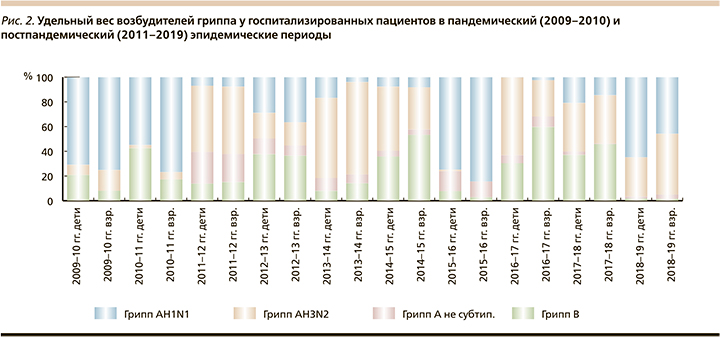
В этиологической структуре гриппа у наблюдавшихся пациентов в эпидемический сезон 2015–2016 гг. спустя 4-летнее после первого постпандемического эпидемического сезона доминирование вируса гриппа типа А(Н3N2) вновь преобладал вирус гриппа типа A(H1N1) pdm 09, что совпадало с данными, полученными в сезоны 2009–2010-х (пандемия) и 2010–2011 гг., что наблюдалось и во время эпидемического подъема гриппа в сезон 2018–2019 гг. (рис. 2).
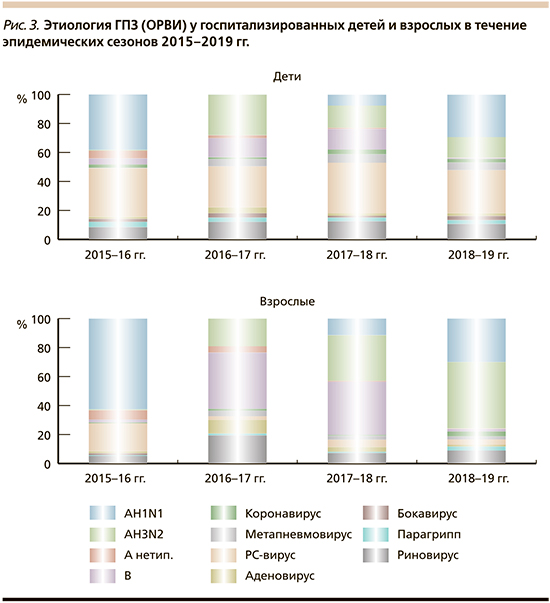
Из возбудителей ГПЗ (ОРВИ) в детской популяции доминировал РС-вирус (у каждого 3-го ребенка), преимущественно в возрасте первых двух лет, затем рино- и аденовирусы. Вирус парагриппа чаще определяли у лиц с острым стенозирующим ларинготрахеитом (ОСЛТ). У взрослых чаше других определяли адено- и риновирусы (рис. 3).
Доказано, что выраженность и быстрота развития клинических проявлений инфекционных заболеваний, в т.ч. и ОРВИ, обусловлены как свойствами возбудителя и массивностью инвазии, так и активностью факторов иммунной защиты, направленных на ограничение репродукции возбудителя, его элиминацию и восстановление структурно-функциональных нарушений в организме заболевшего.
Противовирусная защита
Ведущая роль в противовирусной защите на первых этапах заболевания принадлежит системе интерферонов (ИФН) – естественных цитокинов, обладающих универсальными антивирусными свойствами: способностью подавления репродукции множества РНК- и ДНК-содержащих вирусов [9].
Наличие данной системы в живом организме было доказано после открытия в 1957 г. А. Айзексом и Ж. Линденманном белка ИФН как фактора, определяющего феномен вирусной интерференции (способности задерживать развитие в клетках вирусов) – неспецифической резистентности, индуцируемой самими вирусами и распространяющейся не только на вирус-индуктор, но и на другие агенты [10]. Авторы описывали ИФН как «белок, значительно меньший, чем иммуноглобулины, который производится клетками различных видов животных после заражения живыми или инактивированными вирусами; способный ингибировать рост разнообразных вирусов в клетках тех же видов животных в дозах, не токсичных для клеток». Уже в 1959 г. для координации научной программы исследований был образован Научный комитет по ИФН, который возглавил А. Айзекс.
В различных странах активно начались работы по изучению свойств данного белка и возможности его использования для защиты от вирусной инфекции. Первый успешный эксперимент с обезьяньим ИФН на добровольцах был осуществлен в 1960 г. D.A. Tyrrell [11].
В СССР, а затем в России исследования успешно шли по двум направлениям:
- Изучение возможности индукции ИФН живыми вакцинами, начавшееся в НИИ гриппа РАМН (лаборатория интерферона) под руководством Ал.А. Смородинцева с участием автора настоящего сообщения [12, 13].
- Разработка основы производства и создание на лейкоцитах человека препарата лейкоцитарного ИФН по оригинальной технологии, предложенной В.Д. Соловьевым (Институт эпидемиологии и микробиологии им. Гамалеи) [14].
Полученные результаты разработок обоих исследовательских коллективов были успешно использованы во время эпидемии гриппа типа А(H3N2)Гонконг в 1969 г., а технология производства препарата лейкоцитарного ИФН была использована в последующем как в нашей стране, так и в других странах (Болгария, Япония, Великобритания, США) [15–17].
Вместе с тем, несмотря на успешное применение лейкоцитарного ИФН, к его недостаткам, как и других препаратов, полученных из крови человека, помимо неоднородности состава относится низкая степень очистки и прежде всего от вирусных частиц – индукторов синтеза ИФН. В настоящее время препараты лейкоцитарного ИФН используют строго по жизненным показаниям, когда ожидаемая польза превышает возможный риск.
Получение методами генной инженерии препаратов человеческого ИФН-α в бактериальных клетках позволило преодолеть все вышеназванные проблемы и получить чистый однородный рекомбинантный, идентичный природному по аминокислотному составу белок ИФН в больших количествах и по относительно низкой себестоимости [11].
В 1970-е гг. были описаны I и II типы ИФН, продуцируемые разными клетками под влиянием различных стимулов. В середине 1980-х гг. сформированы понятия «интерфероновый статус», «интерферонодефицитные состояния», открыты многочисленные эффекты ИФН, связанные не только с противовирусной, но и с антипролиферативной активностью [18, 19].
Окончательно представление о наличии системы ИФН как составной части иммунной системы было сформулировано в середине 1990-х гг., обнаружены ее прямые и обратные связи с иммунной и нейроэндокринными системами организма. Если иммунная система имеет специализированные органы и клетки, а ее главная функция – контроль белкового постоянства организма и специфическое реагирование на чужеродную антигенную информацию, то система ИФН, напротив, диссеминирована практически по всем клеткам организма и обладает лишь относительной видовой специфичностью, но ей принадлежит ведущая роль в надзоре за генетическим постоянством клеточных структур, направленная на распознавание и элиминацию чужеродной генетической информации. Гены ИФН индуцибельны, т.е. для включения их активности и, соответственно, синтеза и секреции ИФН требуется активация ИФН-продуцирующих клеток. В качестве индукторов выработки ИФН разных типов выступают антигены, действующие на мембранные TL-рецепторы макрофагов, фибробластов, Т-лимфоцитов и других клеток. Основными индукторами ИФН I типа являются двуспиральная и односпиральная РНК вирусов, реализующая свое действие через TLR3 и комбинацию TLR7/TLR8, а также бактериальная ДНК. Индукторами ИФН I типа могут быть некоторые бактериальные продукты, в частности липополисахарид [20].
В зависимости от иммуногенных свойств и различий в генных последовательностях, кодирующих разные популяции молекул ИФН, а также от физико-химических характеристик и механизма их действия выделяют 3 типа ИФН, из которых наиболее значимый I тип (ИФН-α и ИФН-β). Именно эти виды ИФН преимущественно входят в состав препаратов, используемых в клинической практике.
ИФН I типа (кислотостабильный): α – ИФН-α (13 изоформ – 1, 2, 4, 5, 6, 7, 8, 10, 13, 14, 16, 17, 21), β – ИФН-β (β1 и 3 β2), ω – ИФН-ω, ε – ИФН-ε и κ – ИФН-κ. Гены ИФН I типа, как и BAY II типа, расположены в 9-й хромосоме [21]. Существуют также δ ИФН-ζ (лимитин) – ИФН-δ и зета изоформы, не встречающиеся у человека. Основной источник ИФН I типа – плазмоцитоидные предшественники дендритных клеток, а также моноциты и макрофаги. Кроме того, ИФН-α секретируются эпителиальными клетками и фибробластами, а при вирусной инфекции – всеми ядросодержащими клетками. Самый высокий уровень синтеза ИФН-α выявлен в тканях мозга, низкий – в скелетных и сердечной мышцах [17–19].
Основными продуцентами ИФН-β являются фибробласты и эпителиальные клетки, а также моноциты и макрофаги.
К главным биологическим свойствам ИФН I типа (ИФН-α и ИФН-β) относятся прямая противовирусная активность (блокирование транскрипции и трансляции вирусов) и подавление пролиферации клеток, необходимое для предотвращения распространения вируса, а также стимуляция функций естественных киллеров (NK-клеток) и цитотоксических лимфоцитов, вызывающих лизис инфицированных вирусом клеток-мишеней. Активируются механизмы как врожденного (NК-клетки), так и адаптивного (Т-лимфоциты) иммунитета. Поэтому все ИФН I типа обладают помимо противовирусной иммунорегуляторной активностью. Они же защищают генетическую информацию клеток хозяина от изменений генома, которые могут быть вызваны вирусами, а также ограничивают пролиферацию поврежденных и стареющих клеток, ингибируя функции стволовых клеток. Практически нет клеток, не способных реагировать на действие ИФН I типа. Кроме того, доказано, что они регулируют процессы перекисного окисления липидов, способствуют восстановлению нарушенного гомеостаза, а также ускоряют продукцию антител [22, 23]. Вследствие вышесказанного осуществляется защита окружающих незараженных клеток вновь образованным ИФН, что предотвращает распространение инфекции.
ИФН II типа – ИФН-γ при рH=2,0 нестабилен. ИФН-γ синтезируется и секретируется преимущественно активированными Т-лимфоцитами и натуральными киллерами (NK). Показана также возможность его образования миелоидными клетками (моноцитами/макрофагами), дендритными клетками и В-лимфоцитами. ИФН-γ активирует макрофаги и поддерживает пролиферацию цитотоксических Т-лимфоцитов. Именно на этом этапе происходит выработка медиаторов, таких как супероксид (О2), оксид азота (NO), цитокины интерлейкин-12 (ИЛ-12) и фактор некроза опухоли α (ФНО-α) в составе каскада других провоспалительных и противовоспалительных цитокинов.
ИФН III типа – λ (1. ИФН-λ1/ИЛ-29, 2. ИФН-λ2/ИЛ-28A, 3. ИФН-λ3/ИЛ-28B). Впервые их генетическая структура, расположенная на 19-й хромосоме, была расшифрована в 2002 г.
Это отдельное семейство цитокинов, которое структурно и генетически отличается от ИФН I типа и использует отдельную рецепторную систему, но их биологическая активность аналогична ИФН I типа [24].
Установлено, что кинетика выработки ИФН разных типов определяется временны'ми параметрами активации соответствующих иммунокомпетентных клеток (ИКК) [25–27].
Было показано, что система ИФН является ведущим звеном иммунной системы в противовирусной защите организма. ИФН начинает синтезироваться с первых часов инфицирования, пока еще не активизировались какие-либо другие механизмы защиты, а его уровень как во входных воротах инфекции, так и в общей циркуляции зависит от индивидуальных генетических особенностей организма хозяина и от свойств возбудителя, вызвавшего патологический процесс. Среднегеометрические титры ИФН в крови при ОРВИ негриппозной этиологии, а особенно при респираторно-синцитиальной (РС) вирусной инфекции, были в 2–3 раза ниже, чем при гриппе [27–30].
У больных гриппом, осложненным пневмонией, а также при затяжном его течении к периоду реконвалесценции регистрировали снижение величины всех показателей ИФН-α, что связывается с развитием астенического синдрома и является доказательством целесообразности применения в этом периоде средств с иммуностимулирующей активностью [31].
Доказана наибольшая значимость показателей ИФН-α и -γ-продуцирующей (ИП) способности ИКК, выявлена ее зависимость у больных ОРВИ от преморбидного фона пациентов. Более низкие показатели регистрировались при всей фоновой патологии, в т.ч. и у часто болеющих детей (ЧБД) с кожным или респираторным аллергоанамнезом [32]. Так, по данным Е.А. Эрман (2009), снижение индуцированной продукции ИФН-α выявлено в 34,4% случаев среди ЧБД, а продукции ИФН-γ – среди 73,1% обследованных. Вместе с тем содержание циркулирующего ИФН в сыворотке крови у 100% обследованных ЧБД характеризовалось нормальными значениями [33].
Формы рекомбинантных препаратов ИФН
Были разработаны и внедрены в практику здравоохранения различные лекарственные формы рекомбинантных препаратов ИФН с широким спектром применения: инъекционные формы, глазные капли и пленки, ректальные и вагинальные суппозитории, микроклизмы, мази и гели для дерматологического применения, аэрозоли, растворы и таблетки для перорального применения, наиболее значимыми из которых оказались препараты рекомбинантного ИФН-α-2.
Если химиопрепараты – это главным образом только средства этиотропной терапии, то ИФН обладают комбинированным действием (этиотропным и иммуномодулирующим). Они лишены недостатков химиопрепаратов (узкий спектр действия, формирование резистентности), а спектр антивирусной активности этих препаратов очень широк: грипп и все другие ОРВИ, герпетические инфекции и т.д. Более 90,0% заболеваний, вызванных вирусами, могут быть пролечены при включении в терапию ИФН, вводимого интраназально [34].
Но наиболее оптимальным для лечения и профилактики ОРВИ различной этиологии у пациентов любого возраста (в т.ч. у новорожденных, беременных и кормящих женщин) признано использование рекомбинантных ИФН-α-2b. Их эффективность увеличивается при условии применения препаратов с момента появления первых симптомов заболевания.
Гриппферон
Препарат выбора – отечественный оригинальный препарат рекомбинантного ИФН-α-2b Гриппферон (ООО «ФИРН М», Москва) с оптимальным интраназальным методом введения (патент № 2140285 в Государственном реестре изобретений РФ) [35]. Действующим веществом препарата является ИФН-α-2b человеческий рекомбинантный, который получают из биомассы бактерий Escherichia coli, в генетический аппарат которой встроен ген человеческого ИФН-α-2b (ФСП P N000089/01-050 111 – капли назальные, ФСП ЛП0015-03-311017 – cпрей назальный). В 1 мл препарата содержится не менее 10 тыс. МЕ ИФН, а также антиоксидант трилон-В и биологически совместимый полимер повидон. Препарат действует во входных воротах респираторных возбудителей – эпителиальных клетках слизистой оболочки носа. Полимерные соединения способствуют фиксации препарата на слизистой оболочке и восстановлению проходимости носовых ходов. В экспериментах in vivo и in vitro доказано, что повидон сам обладает способностью стимулировать продукцию ИФН.
Вирусингибирующий эффект лекарственного препарата Гриппферон со стабильным положительным результатом был доказан сотрудниками ФГБУ НИИ гриппа им. А.А. Смородинцева МЗ РФ, СПб НИИ эпидемиологии и микробиологии им. Пастера и Вирусологического центра НИИ микробиологии МО РФ на модели ортомиксовирусной, в т.ч. гриппа птиц типа A(H5N1 и H5N2), гриппа типа А(H1N1) pdm 2009, парамиксо- (парагрипп и РС), адено- и коронавирусных инфекций, а также вируса краснухи в различных клеточных культурах и в опытах на лабораторных животных, причем этот эффект в ряде случаев был более выраженным, чем у препарата сравнения [36–38]. Было достигнуто стабильное подавление репликации вирусов без токсического поражения клеток. Препарат задерживал репродукцию указанных вирусов при его применении как по профилактической, так и по лечебной схеме.
Сотрудниками ФБУН ГНЦВБ «ВЕКТОР» в 2013 г. в результате проведенного исследования in vitro на клеточной культуре Vero и в экспериментах in vivo на мышах было показано, что рекомбинантный ИФН-α-2b обладает противовирусной активностью по отношению к коронавирусам SARS(hCoV штамм Urbani) и MЕRS (hCoV-EMC/2012). Препарат снижал вирусную нагрузку в легких мышей в 10 раз на третьи сутки после заражения диким вирусом SARS (hCoV штамм Urbani) как при экстренно-профилактической, так и при терапевтической схемам применения [39].
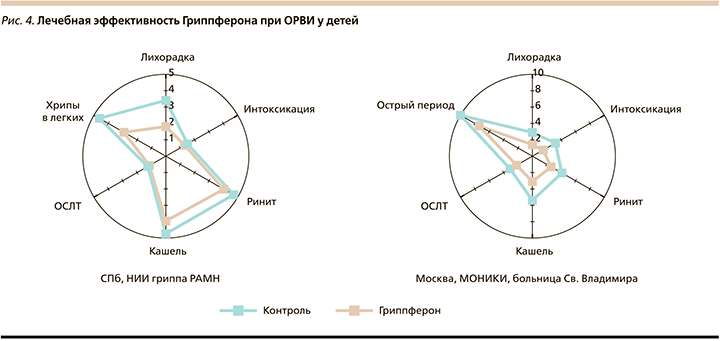
Параллельные клинические исследования по изучению лечебной эффективности рекомбинантного ИФН-α-2b у детей, госпитализированных по поводу гриппа и ОРВИ, были проведены в осенне-зимний период 2002 г. сотрудниками ФГБУ НИИ гриппа МЗ РФ, Санкт-Петербург (у 155 детей) и МОНИКИ, Москва (у 240 человек). В целом препарат получили 230 пациентов, в группу сравнения вошли 165 детей. Проведенные наблюдения показали, что интраназальное введение апробируемого препарата в ранние сроки заболевания детям, в т.ч. и грудного возраста (70% контингента) способствует более быстрой ликвидации всех симптомов заболевания (рис. 4) и статистически значимому сокращению периода выделения вирусных антигенов, обнаруживаемых у пациентов в носовых ходах в течение 7 и более дней после госпитализации и начала лечения [26, 34 40–44]. Четко было показано положительное влияние приема препарата на динамику температурной реакции и выраженность интоксикации, в т.ч. и у детей первого года жизни. Если до начала лечения ее структура у детей в сравниваемых группах была практически одинаковой с преобладанием случаев заболеваний с повышением температуры ≥38,0°С, то уже на следующий день после применения препарата число случаев ОРВИ с повышенной температурой тела и значительной интоксикацией статистически значимо сократилось (63,3 и 89,2% соответственно), особенно за счет уменьшения частоты указанной лихорадочной реакции (рис. 5).
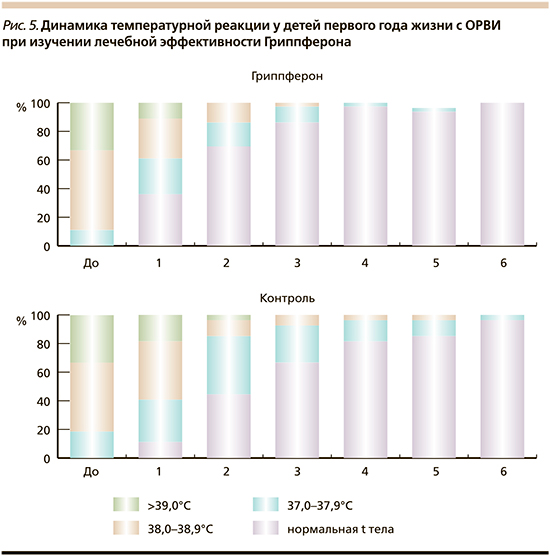
Применение рекомбинантного ИФН-α-2b не вызывало появления каких-либо субъективных жалоб у детей или их родителей и не сопровождалось развитием побочных клинических эффектов. Введение препарата сопровождалось восстановлением сниженного в начале заболевания у большинства детей содержания секреторного иммуноглобулина А (sIgA) в носовых секретах в отличие от детей групп сравнения, среди которых у каждого второго обследованного величина этого показателя продолжала снижаться. Положительные результаты регистрировались у всех наблюдавшихся пациентов независимо от величины показателей содержания у них сывороточного ИФН-α и ИФН-продуци-рующей активности ИКК in vitro, в т.ч. и у ЧБД, ВИЧ-инфицированных и у детей с перинатальным контактом по ВИЧ-инфекции (34, 42, 43).
В течение 2004–2005 гг. в двух центрах: Саратовском медицинском университете и МЛПУ «Городская больница № 33» Нижнего Новгорода – база ГОУ ВПО Ниж. ГМА Росздрава, было проведено многоцентровое рандомизированное исследование по изучению возможности использования рекомбинантного ИФН-α-2b в терапии гриппа и ОРВИ другой этиологии у беременных женщин. Интраназальное применение препарата по лечебной схеме в ранние сроки заболевания способствовало более быстрому выздоровлению пациенток за счет статистически значимого сокращения продолжительности практически всех симптомов поражения респираторного тракта, в т.ч. и лихорадочной реакции (рис. 6) [43, 45].
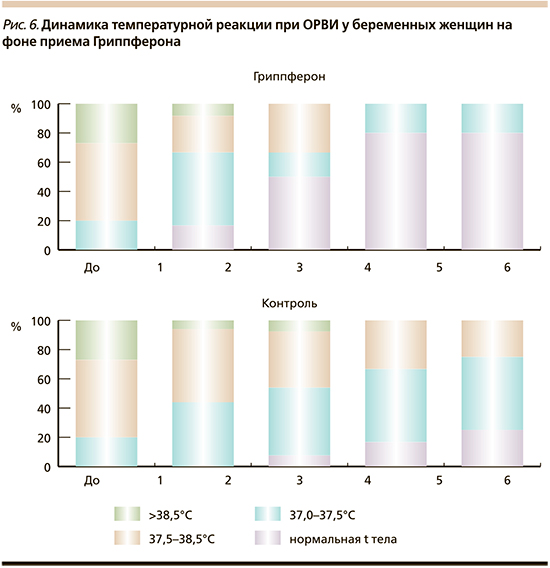
Лечебный эффект рекомбинантного ИФН-α-2b у пациентов с гриппом (взрослых, в т.ч. и беременных, и детей) начинался уже на 2-е сутки лечения, проявляясь исчезновением катаральных симптомов в носоглотке, снижением температуры тела и улучшением общего состояния заболевших. В целом продолжительность заболевания на фоне препарата у пациентов сокращалась на 2 дня.
Введение препарата способствовало сокращению периода выделения вирусных антигенов, причем у детей основных групп новые возбудители при повторных ИФ-обследованиях практически не обнаруживались, что способствовало более редкому (в 2,5–3,0 раза), чем у детей групп сравнения, развитию повторных (внутрибольничных) ОРВИ (с 23,0% пациентов среди детей, не получавших препарат, до 8,9% – в основной группе), возникавших как в стационаре, так и вскоре после выписки ребенка домой (табл. 5).

Одновременно в условиях организованных детских и взрослых коллективов проводили клинические исследования по изучению профилактиче-ской активности рекомбинантного ИФН-α-2b (Гриппферон).
Экстренная профилактика ОРВИ в организованных детских дошкольных учреждениях Санкт-Петербурга при помощи препарата осуществлялась сотрудниками НИИ гриппа во время локальных вспышек, этиология которых определялась при помощи ПЦР в режиме реального времени. Три вспышки были обусловлены аденовирусом, в двух случаях – сочетанием аденовируса с вирусами гриппа типа А(H3N2) и парагриппа, и лишь одна вспышка была вызвана сочетанием вирусов гриппа А(H3N2) и парагриппа [33, 34, 38]. Анализ заболеваемости 396 детей в возрасте 1–6 лет в течение всего периода наблюдений (1 год) показал, что различия в частоте регистраций ОРВИ среди детей, получивших препарат (n=218), и в сравниваемых группах (n=178) были статистически значимыми (табл. 6).
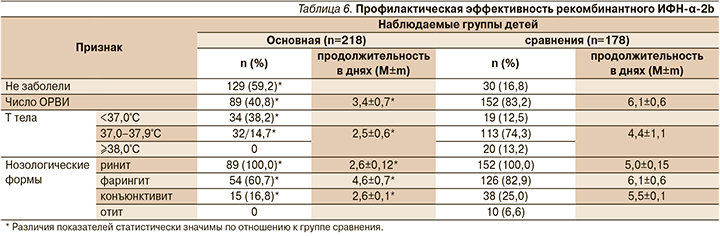
Среди получивших препарат ни разу не заболели 59,2% детей, в сравниваемой группе – 16,8% (р<0,001). Индекс эффективности (ИЭ) рекомбинантного ИФН-α-2b в целом составил 2,3, коэффициент эффективности (КЭ) – 52,8. ОРВИ у детей основной группы протекали преимущественно в виде ринита и ринофарингита на фоне нормальной или субфебрильной температуры тела без интоксикации и осложнений, отмечавшихся в 6,6% случаев у детей групп сравнения. Следует отметить также статистически значимо более короткую продолжительность выявленных симптомов ОРВИ у детей, получавших препарат, по сравнению с группой сравнения.
Успешным было исследование профилактической эффективности препарата у беременных женщин [45, 46] и недоношенных детей, родившихся с очень низкой и экстремально низкой массой тела, перенесших критическое состояние и переведенных из отделения реанимации (Ивановский ФГБУ НИИ материнства и детства) [47].
У детей, получавших препарат (капли назальные), ОРВИ развивались реже, протекали легче с более редким развитием осложнений (в 3,5% случаев против 32,2% в группе сравнения; р<0,001) и были статистически значимо менее продолжительными (10,0±1,3 против 13,2±5,6 дня в группе сравнения; р<0,001). Риск заболевания гриппом беременных, получавших препарат, уменьшился в 2,6–3,0 раза, а среди детей, получавших препарат, не заболели 47,4% против 13,6% недоношенных из группы сравнения.
Полученные результаты свидетельствовали о возможности применения данного препарата с лечебной и профилактической целью детьми, в т.ч. и первого года жизни, при гриппе и других ОРВИ, что было подтверждено многочисленными наблюдениями в детских и взрослых коллективах России (Москва, Московская область, Санкт–Петербург, Ярославль, Ульяновск, Нижний Новгород, Саратов) во время эпидемических подъемов гриппа за 2001–2019 гг., в которых зарегистрировано статистически значимое (в 2,4–3,5 раза) снижение заболеваемости среди лиц, получавших препарат. Подобные результаты регистрировали и в группах «риска», в частности среди медицинских работников и провизоров, железнодорожных служащих, в коллективах инвалидов и пожилых лиц, а также детей разного возраста, в т.ч. и часто болеющих, живших в учреждениях Комитета социальной защиты населения [34, 42–44]. Применение препарата было максимально успешным при его приеме хотя бы за несколько дней до начала вспышки заболевания.
Заключение
Таким образом, проведенные лабораторные (на клеточных культурах in vitro и на животных in vivo), а также многочисленные клинические исследования отечественного препарата рекомбинантного ИФН-α-2b Гриппферон (капли назальные и спрей назальный дозированный) позволяют рассматривать его в качестве безопасного эффективного профилактического и терапевтического средства при ОРВИ любой этиологии и гриппе во всех возрастных группах пациентов, включая новорожденных детей, в т.ч. и недоношенных, а также пожилых пациентов. Успешно используется препарат у беременных и кормящих женщин, а также у детей с наличием сопутствующих фоновых заболеваний и часто болеющих.



