Варикоцеле – расширение вен гроздевидного сплетения в пределах семенного канатика.
Международный код идентификации –ICD Code 456.4. На первый взгляд варикоцеле – весьма широко распространенное заболевание. В литературе часто утверждается, что варикоцеле встречается у 20 % мужчин репродуктивного возраста, а среди пациентов с бесплодием – в 40 % наблюдений. Широкое эпидемиологическое исследование, проведенное под контролем Всемирной организации здравоохранения (ВОЗ), показало, что частота заболевания составила лишь 11,7 % во всей популяции мужчин и достига 25,4 % в группах мужчин с бесплодием. В настоящее время относительно большую частоту выявления варикоцеле у мужчин можно объяснить самим фактом бесплодия [1–9].
Существуют различные механизмы повреждающего действия варикоцеле на сперматогенез, из которых поддерживаются следующие:
• нарушение температурной регуляции яичка;
• рефлюкс токсических метаболитов из надпочечника (почки);
• нарушение гормонального статуса, а именно – угнетение секреции гонадотропинов или андрогенов,
что может приводить к нарушению функции обоих яичек;
• повреждающее действие рН, рО2, рСО2 в яичковом венозном русле и интерстиции. При этом венозный стаз в яичке считается причиной влияния токсических метаболитов на сперматогенез.
Врач целенаправленно выявляет варикоцеле у пациента, а если варикоцеле нет, предпринимается диагностика субклинических форм заболевания. Иными словами, зачастую диагностику варикоцеле при бесплодии выносят на первое место, при этом игнорируя множество других причин, которые могут приводить к бесплодию [7]. Нарушение репродуктивной функции у мужчин обусловлено увеличением
частоты заболеваний половых органов, ростом аномалий развития, влиянием вредных факторов внешней среды, аллергизацией населения, широким и бесконтрольным применением лекарственных препаратов, злоупотреблением алкоголем и никотином [8].
Мужское бесплодие, а следовательно, бесплодный брак, будучи явлением, довольно распространенным, приобретает все большее социальное значение. Обращает на себя внимание
тенденция к росту удельного веса мужского фактора. За последние 20 лет он повысился с 30 до 50 % и продолжает расти, поэтому исследование репродуктивной функции мужчин в настоящее время является актуальной задачей. Современные технологии позволяют справиться с бóльшей частью
проблем бесплодия, однако они часто связаны и с большими материальными затратами.
В настоящее время в мире проводятся многочисленные исследования по установлению роли генетических факторов в развитии бесплодия у мужчин [10–12].
Выделяют следующие группы нарушений:
1. Мутации гена ароматазы СУР19.
2. Мутации гена рецептора эстрогенов.
3. Мутации гена рецептора андрогенов.
4. Y-микроделеции.
5. Полиморфизм генов GSTT1,
GSTM1.
6. Мутации CFTR.
7. Нарушения половых хромосом. Около 5 % бесплодных мужчин имеют хромосомные аномалии (синдром Нунан, Тернера, синдром ХУУ и др.).
Известно, что нулевой генотип GSTT1 и/или GSTM1 является модератором развития свободно-радикального повреждения клеток. В ряде исследований показано, что 49 % представителей
белой расы и 35 % негроидной являются носителями указанных генетических альтераций [10–12].
Впервые теорию свободно-радикального повреждения предложил геронтолог Д. Харман в 1954 г. Свободные радикалы представляют собой атомы кислорода, которые имеют неспаренный электрон на внешней электронной орбите и обладают высокой реакционной способностью (супероксид анион, оксид азота, гидроксильный радикал). Они повреждают нуклеиновые кислоты, белки и липиды. Оксид азота является неактивным, но при взаимодействии с О2 образуется пероксинитрит, который разлагается с образованием гидроксильного радикала, последний в свою очередь реагирует с белками и другими веществами с образованием альдегидов, кетонов, продуктов перекисного окисления липидов. В организме человека гидроперекисями являются такие химические соединения, как простагландины, лейкотриены, тромбоксаны и др. Установлено, что избыточное образование свободных радикалов приводит к активации перекисного окисления липидов плазматической мембраны сперматозоидов. В норме существует ферментная система, каталитическая активность которой обеспечивает защиту клеток от свободно-радикального повреждения благодаря поддержанию фосфолипидного состава их мембран.
Известно, что глутатион-S-трансферазы Т1 и М1 являются ферментами, которые катализируют конъюгацию генотоксических метаболитов (канцерогенов, липидов, продуктов свободно радикальных реакций) с глутатионом (предшественники метионин и цистеин), вызывая их инактивацию. Глутатион защищает клетку от токсичных агентов, таких как свободные радикалы, и определяет редокс-статус внутриклеточной среды. Отношение восстановленный/окисленный глутатион внутри клетки является важнейшим параметром, который показывает уровень внутриклеточной токсичности (уровень оксидативного стресса). Истощение клетки восстановленным глутатионом приводит к накоплению в цитоплазме белков, запускающих апоптоз.
Цель настоящего исследования – оценить качество эякулята у мужчин после различных видов оперативного лечения варикоцеле и определить роль полиморфизма генов GSTT1, GSTM1 в развитии патозооспермии.
Материал и методы
Обследованы 25 мужчин от 18 до 34 лет, оперированных по поводу варикоцеле слева с 2006 по 2012 г.:
• 16 (64 %) операций по Иваниссевичу;
• 6 (24 %) операции Мармара;
• 3 (12 %) лапароскопических клипирования яичковой вены.
Критерии исключения:
• острые и хронические воспалительные заболевания органов мочевыделительной системы, в т. ч. инфекции, передаваемые половым путем в анамнезе;
• травмы органов мошонки и промежности в анамнезе;
• ожирение и заболевания сердечно-сосудистой системы;
• злокачественные новообразования любых локализаций, в т. ч. в анамнезе;
• специфические заболевания легких и других локализаций в настоящее время и в анамнезе;
• регулярный прием любых лекарственных средств с возможным токсическим воздействием на сперматогенез;
• хронический алкоголизм, наркомания;
• возраст младше 18 и старше 40 лет;
• отсутствие согласия на участие в настоящем исследовании.
План обследования включал спермограмму, MAR (Mixed agglutination reaction)-тесты, биохимический анализ семенной плазмы (цинк, фруктоза, α-гликозидаза), исследование мутации гена рецептора андрогенов и полиморфизма генов GSTT1, GSTM1 (кровь). Ультразвуковое исследование органов
мошонки.
Результаты исследования и обсуждение
Обследованные пациенты были разделены на две группы: в первую вошли 15 больных, при исследовании эякулята которых не наблюдалось отклонений от нормы, хотя по результатам спермограммы до оперативного лечения было отмечено снижение подвижности сперматозоидов умеренной степени. У четырех мужчин, вступивших в брак, родились дети.
Пациенты первой группы перенесли следующие виды операций:
• 11 (73,3 %) операций по Иваниссевичу;
• 2 (13,3 %) операции Мармара;
• 2 (13,3 %) лапароскопических клипирования яичковой вены.
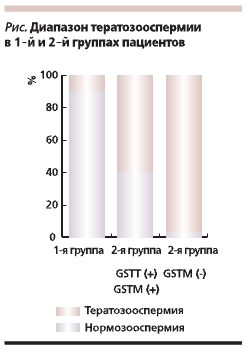
Во вторую группу включили 10 пациентов, у которых была выявлена тератозооспермия разной степени
выраженности в сочетании с олиго- и/или астенозооспермией на фоне низкой ферментативной активности придатка яичка (по результатам биохимического анализа эякулята). Степень выраженности тератозооспермии варьировалась в зависимости от генотипа GSTT1/GSTM1 (см. рисунок);
• у 5 пациентов с GSTT1(+), GSTM1(+) – в диапазоне от 52 до 60 % патологических форм сперма-
тозоидов в эякуляте;
• у 5 пациентов с нулевым генотипом GSTM1 от 60 до 97 %.
Ни у одного из обследованных пациентов не обнаружено мутации гена рецептора к андрогенам.
Пациенты второй группы перенесли следующие виды оперативного вмешательства:
• 5 (50 %) операций Иваниссевича;
• 4 (40 %) операции Мармара;
• 1 (10 %) лапароскопическое клипирование яичковой вены.
Заключение
У пациентов с нулевым генотипом GSTM1 конъюгация генотоксических метаболитов с глутатионом является неполноценной за счет выключения каталитической активности глутатион S-трансферазы М1. С целью купирования метаболических нарушений в эякуляте, восстановления плазматических мембран сперматозоидов и повышения их энергообеспечения пациентам с нулевым генотипом GSTM1
начата терапия таурином (продуктом обмена метионина и цистеина).
Пациенты с выявленными патологическими отклонениями в биохимическом составе эякулята подлежат дальнейшему наблюдению вне зависимости от генетического профиля, им необходимо более углубленно исследовать эякулят, в т. ч. на панель неорганических соединений.



