Введение
Наружный генитальный эндометриоз (НГЭ) – хроническое рецидивирующее прогрессирующее гормонозависимое заболевание, характеризующееся доброкачественным разрастанием за пределами полости матки ткани, по морфологической структуре и функциям сходной с эндометрием [1]. Согласно гайдлайну Европейского общества репродукции человека и эмбрио-логии (European Society of Human Reproduction and Embryology – ESHRE) «Эндометриоз» 2022 г., точная распространенность заболевания неизвестна. По данным литературных источников, частота встречаемости данной патологии варьируется от 2 до 10% среди пациенток репродуктивного возраста, у инфертильных женщин эндометриоз подтверждается в 50% случаев. Таким образом, в настоящее время 190 млн женщин репродуктивного возраста и девочек-подростков во всем мире страдают эндометриозом [2], что является крайне тревожным фактом в условиях неблагоприятной демографической ситуации. Отсутствие высокоспецифических и чувствительных биомаркеров неинвазивной диагностики, многогранная симптоматика заболевания, а также неспособность современных методов визуализации однозначно подтвердить или исключить эндометриоз приводят как к задержке постановки диагноза в среднем на 8–12 лет, так и к несвоевременному назначению патогенетически обоснованной терапии [3]. Основные симптомы заболевания: эндометриоз-ассоциированный болевой синдром и бесплодие. Для пациенток с НГЭ характерны дисменорея, диспареуния, дизурия и дисхезия, а также нециклическая тазовая боль, которые в отсутствие свое-временной коррекции приводят к развитию хронической тазовой боли, что, в свою очередь, оказывает негативное влияние на качество жизни и позволяет рассматривать эндометриоз как социальную проблему [4]. Многогранность патогенетических механизмов развития заболевания, вариабельность клинической симптоматики, а также отсутствие единой концепции терапии эндометриоза диктуют необходимость поиска современных способов коррекции данной патологии. Изолированное использование хирургического или медикаментозного методов в настоящее время не рассматривается в качестве «золотого» стандарта терапии, и современной стратегией в отношении лечения заболевания является разработка персонифицированного комплексного подхода к пациенткам с НГЭ. Одним из таких направлений может быть ретинол.
Жирорастворимый витамин А – циклический непредельный одноатомный спирт, обладает антипролиферативным, противоопухолевым эффектами, воздействует на биосинтез эстрогенов и является мощным антиоксидантом, что обосновывает возможность его участия в патогенезе генитального эндометриоза. С учетом способности витамина А ингибировать пролиферацию эндомет-риоидных кист яичников, уменьшать размеры эндометриоидных гетеротопий, модулировать синтез провоспалительных цитокинов он может рассматриваться в качестве перспективного направления терапии заболевания [5, 6]. Несмотря на то что витамином А чаще всего называется ретинол, вариабельность его форм приводит к появлению различных названий: ретинол (витамин А спирт, витамин А1), дегидроретинол (витамин А2), ретиналь (ретинен, витамин А альдегид) и ретиноевая кислота (витамин А кислота). Эти витамеры достаточно нестабильны, поэтому витамин А в составе витаминно-минеральных комплексов и пищевых добавок используют в более химически устойчивых формах – сложных эфирах ретинола (как правило, ретинола ацетат или ретинола пальмитат) [7]. Витамин А поступает в организм человека вместе с пищей в виде эфиров, в большинстве случаев в виде пальмитата, которые в кишечнике гидролизуются под действием ферментов поджелудочной железы и эпителиальных клеток слизистой оболочки тонкой кишки, в конечном итоге, превращаясь в свободный ретинол, усваиваемый организмом. Далее происходит реэстерификация ретинола в эпителиоцитах с образованием преимущественно его высших эфиров, главным образом ретинола пальмитата, который распространяется по всему организму через грудной лимфатический проток [8]. Удаление избытков ретинола в клетке осуществляется путем его катаболизма ферментами семейства P-450 системы цитохромов, что приводит к образованию т.н. полярных метаболитов – физиологически менее активных соединений. Наибольшей аффинностью к ретинолу обладают цитохромы CYP26A1 и CYP26B1, которые полностью связывают транс-ретиноевую кислоту (ATRA) и иные изоформы витамина А в цитоплазме и катализируют ее до 4-ОН-RA, 4-oxo-RA и других соединений, защищая клетку от избытка ретиноевой кислоты в цитоплазме и препятствуя ее попаданию в ядро [9]. Уровень метаболитов витамина А может быть снижен вследствие увеличения содержания фермента CYP26. Предполагается, что повышенные уровни трансформирующего фактора роста бета (TGF-β) в сыворотке крови и перитонеальной жидкости у больных эндометриозом вызывают уменьшение содержания CYP26, что по механизму отрицательной обратной связи приводит к увеличению концентрации метаболитов витамина А [10]. Далее транспорт ретинола в клетки осуществляется посредством рецептора клеточной поверхности – белка STRA6, который является основным регулятором поглощения ретинола эндометрием. Снижение экспрессии этого гена при эндометриозе может способствовать снижению экспрессии мРНК 17-β гидроксистероиддегидрогеназы 2-го типа (HSD17B2), что, в свою очередь, приводит к избытку эстрадиола в эндометриоидной ткани и, как следствие – прогрессированию заболевания [11]. Как только ретинол попадает в клетку с помощью STRA6, он последовательно окисляется сначала алкогольной дегидрогеназой с короткой цепью и далее одной из альдегиддегидрогеназ (ALDH) с образованием наиболее биологически активной ретиноевой кислоты. В этом случае витамин А может играть либо интракринную, либо паракринную роль. Внутри клетки он может перемещаться из цитоплаз-мы в ядро с помощью белков-переносчиков, включая клеточный белок 2, связывающий ретинол (CRABP2), и белок 5, связывающий жирные кислоты (FABP5). Благодаря этим механизмам ретинол связывает специфические ядерные рецепторы, присутствующие в этой клетке, для регуляции экспрессии генов. Ретиноевая кислота является мощным модулятором транскрипции генов, с помощью которого он осуществляет контроль роста, дифференцировки и апоптоза клеток.
Yamagata Y. et al. продемонстрировали in vitro при анализе транскриптома с использованием выделенных эндометриоидных стромальных клеток, что в генах, обработанных ATRA, отмечалось подавление клеточной пролиферации [12].
Цель исследования – определить уровень ретинола у пациенток с НГЭ в периферической крови и перитонеальной жидкости, оценить эффективность его применения на основании хирургически индуцированного эндометриоза на крысах линии Wistar.
Методы
В основную группу вошли 38 пациенток с гистологически подтвержденным (на основании лапароскопии) диагнозом НГЭ I–IV степеней распространенности, согласно пересмотренной классификации Американского общества репродуктивной медицины (r-ASRM), средний возраст которых составил 31,7±4,1 года. Контрольную группу составили 10 пациенток без эндометриоза, которым проводилась диагностическая лапароскопия перед вступлением в протокол вспомогательных репродуктивных технологий (в связи с мужским фактором бесплодия). Всем пациенткам проводилось определение уровня витамина А в сыворотке крови и перитонеальной жидкости с использованием наборов Cloud-Clone Corp методом ИФА.
Критерии включения пациенток в исследование: 1) наличие информированного добровольного согласия на забор биологических жидкостей с целью определения уровня витамина А, 2) эндометриоз-ассоциированный болевой синдром, 3) репродуктивный возраст, 4) НГЭ I–IV степеней распространенности, подтвержденный на основании лапароскопии и результатов гистологического исследования. Критерии исключения: 1) сахарный диабет, 2) злокачественные новообразования, 3) сочетание эндометриоза с миомой матки или синдромом поликистозных яичников.
Экспериментальная модель
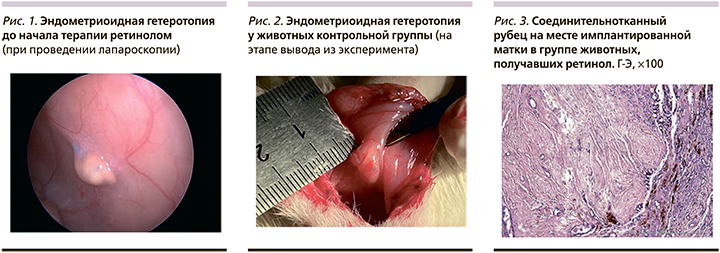
Хирургически индуцированная модель эндометриоза выполнена на 21 половозрелой самке крыс линии Wistar в возрасте от 10 до 12 недель, массой 220±50 г. До начала проведения эксперимента в течение 14 дней после окончания сроков карантинизации проводилась оценка эстрального цикла у крыс путем забора влагалищных мазков с последующим микроскопическим исследованием после фиксации материала и окраски метиленовым синим. Все особи, включенные в эксперимент, находились в фазе эструса.
Создание экспериментальной модели проводилось в три этапа. Первый этап – моделирование заболевания, второй – подтверждение наличия НГЭ посредством лапароскопии и оценка площади эндометриоидных гетеротопий с последующей терапией заболевания, третий этап – выведение животных из эксперимента, оценка площади эндометриоидных гетеротопий в динамике, гистологическое исследование. Площадь эндометриоидных гетеротопий оценивалась по формуле площади эллипса: S=A×B×π, где S – площадь гетеротопии (мм2), А – продольный размер (мм), В – поперечный размер (мм), π - 3,14.
После проведения 1-го этапа эксперимента зафиксирована гибель двух животных. Полученный после окончания эксперимента материал подвергался фиксации в течение 24 часов в 10%-ном нейтральном забуференном формалине. Гистологическую проводку материала осуществляли с использованием автоматической станции Histo-Tek VP1, далее образцы заливали в парафиновые блоки и готовили гистологические срезы толщиной 4 мкм; полученные микросрезы окрашивали гематоксилином и эозином. При световой микроскопии выявляли наличие эндометриоидной гетеротопии в инфильтратах, определяли реактивные и патологические воспалительные изменения. Световую микроскопию проводили на микроскопе Olympus CX31 (Olympus, Япония) при увеличении ×100, ×200, ×400.
Статистический анализ
Полученные данные обрабатывали в программах Excel, STATISTICA. Количественные нормально распределенные переменные описаны через среднее значение и стандартное отклонение, в случае распределения, отличного от нормального, – при помощи медианы. Для оценки значимости различий средних величин применялся t-критерий Стьюдента.
Результаты
Всем пациенткам с НГЭ для определения степени распространенности заболевания проведено хирургическое вмешательство с применением лапароскопического доступа. НГЭ I степени, согласно классификации r-ASRM, обнаружен у 18,4% (n=7) женщин, II – у 26,3% (n=10), III – у 26,3% (n=10), IV степени у 28,9% (n=11). Медианное значение уровня витамина А у пациенток с НГЭ в периферической крови составило 5541,5 нг/мл (2706; 10 482), что достоверно превышает его уровень в перитонеальной жидкости – 1650,5 нг/мл (635; 7234) более чем в 2 раза (t-критерий Стьюдента, p=0,000000). Статистически значимые различия в уровне ретинола в сыворотке крови и перитонеальной жидкости отмечены и у пациенток группы контроля – 4242 нг/мл (3170; 7476) и 1903 нг/мл (807; 2944) соответственно (t-критерий Стьюдента, p=0,000056). Отсутствие эндометриоза в группе контроля устанавливалось на основании лапароскопии. При сравнении уровня витамина А в сыворотке крови пациенток группы с НГЭ и контрольной группы отмечались значимые статистические различия (t-критерий Стьюдента, p=0,04). Следует отметить, что у больных с распространенным эндометриозом (НГЭ III–IV степеней) уровень витамина А в сыворотке крови был ниже по сравнению с уровнем у пациенток с начальными формами заболевания (НГЭ I–II степеней), но различия не были статистически значимыми (критерий Манна–Уитни, p=0,13888). У пациенток с НГЭ I–II степеней медианное значение уровня витамина А в периферической крови составило 5631 (3879; 10 482) нг/мл, у пациенток с распространенными формами – 4771 (2706; 8959) нг/мл. Выявлена корреляционная зависимость между уровнем ретинола в сыворотке крови и в перитонеальной жидкости у пациенток с начальной степенью и распространенным эндометриозом (критерий Вилкоксона, p<0,001).
В каждой из групп больных НГЭ уровень витамина А в периферической крови был выше по сравнению с уровнем у пациенток группы контроля, однако эти показатели статистически не значимы (критерий Краскела–Уоллиса; p=0,18387): средний уровень ретинола в сыворотке крови у пациенток с НГЭ I степени составил 6296,57±840,08 нг/мл, II – 5945,30±567,33 нг/мл, III – 5121,90±611,66 нг/мл, IV степени – 5130±632,90 нг/мл, в контрольной группе – 4488±433,53 нг/мл. При оценке того же критерия, но для образцов перитонеальной жидкости также не отмечались статистически значимые различия между группами с различной степенью НГЭ и контрольной группой (критерий Краскела–Уоллиса; p=0,59141). Для пациенток с НГЭ I степени средний уровень витамина А в перитонеальной жидкости составил 2830,6±798,85 нг/мл, II – 2580,2±682,39 нг/мл, III – 2157,4±334,45 нг/мл, IV степени – 1689,5±302,01 нг/мл, в контрольной группе – 1953±197 нг/мл.
Результаты применения ретинола в терапии эндометриоза на основании экспериментальной модели заболевания
Проводилась оценка эффективности ретинола в терапии заболевания по сравнению с диеногестом и контрольной группой. Группа А (n=5) после проведения лапароскопии ежедневно перорально получала ретинол в дозе 10 мг/кг, вторая группа (В) – контрольная (n=4), лечение не получала. Третья группа (С) – группа сравнения (n=5), ежедневно перорально получала диеногест в дозе 1 мг/кг. Продолжительность терапии составила 21±3 дня.
Размеры эндометриоидных гетеротопий до начала терапии заболевания варьировались в пределах от 16 до 40 мм2.
Средняя площадь гетеротопий в группе А (n=5) до начала терапии составила 33,3±6,78 мм2. Спустя 3 недели после ежедневного перорального применения ретинола отмечалась полная резорбция очагов эндометриоза, что подтверждается результатами гистологического исследования. В группе животных, получавших диеногест, средняя площадь эндометриоидных гетеротопий (n=5) до начала терапии составила 41,16±12,1 мм2. После завершения лечения полная резорбция отмечалась в 70% случаев, в 30% случаев имело место уменьшение размеров эндометриоидных гетеротопий до 12,14 мм2. В контрольной группе (n=4) исходная средняя площадь эндометриоидных гетеротопий составила 28,14±6,11 мм2, через 3 недели площадь эндометриоидных гетеротопий была увеличена до 45,78±11,5 мм2.
На основании результатов проведенного эксперимента выявлено достоверное уменьшение размеров эндометриоидных гетеротопий в группе животных, получавших диеногест, с полной резорбцией очагов в 70% случаев. Следует отметить, что диеногест в настоящее время рассматривается как первая линия терапии заболевания.
В группе животных, получавших ретинол, во всех случаях отмечена полная резорбция эндометриоидных гетеротопий. В группе контроля через 3 недели от момента лапароскопии отмечался прогрессивный рост очагов в 2 раза по сравнению с исходными данными. Полученные в ходе проведения эксперимента результаты подтверждают эффективность ретинола в терапии НГЭ, которая не уступает гормономодулирующей терапии, следовательно, витамин А может быть рассмотрен как альтернативный метод лечения НГЭ.
Обсуждение
Роль ретинола в патогенезе эндометриоза достаточно активно изучается, однако в литературных источниках опубликованы лишь единичные исследования, оценивающие уровень витамина А в сыворотке крови. Данные об уровне ретинола в перитонеальной жидкости у больных эндометриозом отсутствуют. Для разработки показаний к назначению ретинола у пациенток с эндометриозом решено определить его исходный уровень в сыворотке крови и перитонеальной жидкости. На основании полученных результатов установлено достоверное увеличение уровня ретинола в сыворотке крови более чем в 2 раза по сравнению с показателями перитонеальной жидкости как в группе пациенток с НГЭ, так и в контрольной группе, причем для пациенток с распространенными формами заболевания характерен более низкий уровень витамина А по сравнению с пациентками с начальными его формами. При анализе полученных данных мы не обнаружили дефицита или недостаточности ретинола у пациенток с НГЭ. По данным литературы, известно, что пациентки с эндометриозом употребляют меньше овощей, полиненасыщенных жирных кислот омега-3, молочных продуктов, но больше красного мяса и кофе [13]. Было бы логично предположить, что повышенный уровень витамина А ассоциирован с употреблением красного мяса и ветчины, т.к. среди пациенток не было вегетарианцев. Однако ориентироваться на «повышенный» уровень ретинола у пациенток с эндометриозом нецелесообразно и весьма сомнительно. Подобный диссонанс возникает вследствие нескольких причин. Во-первых, известно, что ретинол не вырабатывается в организме, а лишь поступает вместе с пищей извне. В исследовании J. Mier-Cabrera et al. доказано, что диета с высоким потреблением антиоксидантов, каковым является ретинол, в течение 3 месяцев приводит к повышению активности супероксиддисмутазы и глутатионпероксидазы и снижению уровня малонового диальдегида, являющихся маркерами оксидативного стресса, который отмечается как в сыворотке крови, так и в перитонеальной жидкости у пациенток с НГЭ. Супероксиддисмутаза и глутатионпероксидаза – это ферменты, способствующие инактивации свободных радикалов, играют ключевую роль в снижении активности процессов оксидативного стресса. В свою очередь, малоновый диальдегид участвует в метаболизме арахидоновой и других полиненасыщенных жирных кислот, индуцируя оксидативный стресс в организме человека. Вследствие дальнейших биохимических превращений он окисляется до диоксида углерода или вступает во взаимодействие с фосфолипидами, аминокислотами и нуклеиновыми кислотами [14]. Согласно литературным данным, высокие концентрации маркеров оксидативного стресса и перекисного окисления липидов, наблюдаемые у пациенток с эндометриозом, усиливают рост и адгезию клеток эндометрия в брюшной полости и, соответственно, приводят к прогрессированию заболевания [15]. Во-вторых, ключевой механизм повышенного уровня ретинола ассоциирован с его метаболизмом в организме человека. Ретинолсвязывающий белок 4 (RBP4), являющийся переносчиком ретинола в плазме, подобно адипокинам, происходит из жировой ткани. Адипокины играют решающую роль в различных клеточных функциях, таких как ангиогенез, про- или противовоспалительное действие и регуляция иммунных процессов, что подтверждает их участие в патогенезе эндометриоза. RBP4 – это новый цитокин, происходящий из адипоцитов, который играет важную роль в регуляции чувствительности к инсулину и процессах энергетического метаболизма [16]. В исследовании J. Lee et al. показано, что у пациенток с эндометриозом отмечалась выраженная экспрессия RBP4 как в перитонеальной жидкости, так и в периферической крови [17]. Было бы логично предположить, что у больных НГЭ нарушения метаболизма витамина А связаны с изменениями функции печени, однако отклонений в показателях биохимического анализа крови при рутинном обследовании нами не было выявлено. У всех пациенток определялись уровни АЛТ, АСТ, общего билирубина.
На основании исследований, проведенных в последнее время, продемонстрировано, что RBP4 играет важную роль в прогрессировании злокачественных новообразований, отмечается увеличение его уровня в сыворотке крови у пациенток с раком яичников, экспрессия RBP4 увеличивается в 4 раза по сравнению с его экспрессией в доброкачественных тканях яичников [18, 19]. Предполагается, что ретинол контролирует экспрессию ряда белков, регулирующих важнейшие опухоль-ассоциированные сигнальные пути, например NF-κB, интерферон γ, трансформирующий ростовой фактор-β, фактор роста эндотелия сосудов, белки, обладающие опухоль-супрессорной активностью, такие как р53 и AP-2 [20–22]. Для многих типов опухолей показано, что ретиноевая кислота стимулирует дифференцировку, активирует процесс апоптоза, снижает способность к неприкрепленному росту, подавляет пролиферативную активность и ангиогенез. Все это способствует снижению выживаемости опухолевых клеток [23]. Установлено, что экспрессия фермента, катализирующего ретиналь альдегид в ретиноевую кислоту, альдегиддегидрогеназы, (ALDH1A3) повышена в тканях при раке молочной железы, яичников, колоректальном раке и шейки матки по сравнению со здоровыми тканями человека. Увеличение активности ферментов ALDH1А3 в свою очередь приводит к повышению уровня ретиноевой кислоты [24]. Несмотря на то что эндометриоз является доброкачественным заболеванием, он имеет сходство с опухолевыми процессами: потеря контроля клеточной пролиферации, инфильтративный рост, локальное и отдаленное расположение очагов, характерное для процесса метастазирования [25].
Заключение
Таким образом, на основании проведенного нами исследования установлено, что у пациенток с эндометриозом отмечается повышенный уровень витамина А в сыворотке крови, который достоверно превышает его уровень в перитонеальной жидкости, особенно при начальных формах эндометриоза. «Искусственное» увеличение уровня ретинола в сыворотке крови опосредовано множеством причин, в первую очередь нарушением его метаболизма и изменением экспрессии ретинолсвязывающего белка-4, и требуются дальнейшие исследования для более детализированного изучения роли витамина А в патогенезе эндометриоза. При этом высокая эффективность применения ретинола, характеризующаяся полной резорбцией очагов эндометриоза на основании экспериментальной модели хирургически индуцированного заболевания у крыс линии Wistar, позволяет рассматривать ретинол в качестве перспективного метода терапии НГЭ.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Роль ретиноевой кислоты в патогенезе наружного генитального эндометриоза, течении беременности и разработка патогенетически обоснованной прегравидарной подготовки».
Работа подготовлена в рамках темы ФНИ №122041500063-2.



