Хорошо известно, что к основным биологическим эффектам витамина D относится участие в поддержании кальциево-фосфорного гомеостаза и процессах ремоделирования костной ткани. Считается, что механизм действия витамина D на костную ткань осуществляется за счет его прямого негеномного действия, опосредуется через паратиреоидный гормон, а также может быть связан с изменением активности рецептора витамина D [1–3]. Исследования последних лет показали, что в минерализации скелета важную роль может играть не только активный D-гормон, но и прогормон – кальцидиол (25(ОН)D), а также повышение уровня паратиреоидного гормона (ПТГ), наблюдающееся при недостатке и дефиците витамина D [4]. Наличие фермента CYP27B1 и рецепторов витамина D в остеобластах и остеокластах делает возможным прямое или опосредованное через ПТГ участие витамина D в активации экспрессии лиганда рецептора активатора ядерного фактора-kB (RANKL) и в снижении экспрессии гена остеопротегерина, дисбаланс которых лежит в основе активации резорбции костной ткани [5]. Однако в условиях дефицита витамина D наблюдается не только нарушение процессов физиологического ремоделирования костной ткани с преобладанием костной резорбции [2, 6], но и уменьшение мышечной массы, приводящее к увеличению риска падений [7–9] и числа остеопоротических переломов, особенно у лиц пожилого возраста. Если для лиц пожилого возраста связь между низким уровнем обеспеченности витамином D и риском переломов доказана [6, 10, 11], то у лиц молодого возраста эти данные весьма противоречивы. Например, результаты исследования, проведенного R. Kremer и соавт. в 2009 г., продемонстрировали отсутствие значимых взаимосвязей между минеральной плотностью костной ткани и степенью обеспеченности витамином D [12].
Известно, что снижение минеральной плотности кости (МПК) зависит от многих факторов. Помимо дефицита витамина D к ним относятся низкая масса тела, низкое потребление кальция с пищей, снижение уровня половых гормонов, злоупотребление алкоголем, курение, прием ряда препаратов, а также наличие заболеваний, ассоциированных с низкой минеральной плотностью скелета. Роль низкой массы тела в развитии остеопороза изучена давно. Считается, что индекс массы тела (ИМТ) мене 20 кг/м2, а также быстрое снижение веса более чем на 10% у женщин старше 25 лет сочетается с низкой МПК и риском развития переломов [13]. В то же время связь между избыточной массой тела и МПК весьма противоречива. С одной стороны, результаты некоторых эпидемиологических исследований показали, что пациенты с ожирением имеют более высокие, чем лица с нормальной массой тела, показатели минеральной плотности костной ткани [14, 15].
С другой стороны, у больных ожирением количество жировой и костной ткани находится в отрицательной корреляционной зависимости [16]. Противоречивость имеющихся данных послужила поводом для проведения настоящего исследования, целью которого было определить показатели минерализации скелета у женщин молодого возраста и различной массой тела для уточнения вклада дефицита витамина D в формирование остеопенического синдрома.
Материал и методы
В исследование были включены 204 женщины в возрасте от 30 до 52 лет (средний возраст – 46,20±0,54 года). МПК была определена методом двух-энергетической рентгеновской абсорбциометрии в поясничном отделе позвоночника в прямой проекции и в проксимальном отделе бедренной кости. Согласно рекомендациям Всемирной организации здравоохранения, диагностика снижения МПК у женщин молодого возраста (до 45 лет) выполнялась на основании Z-критерия, а в более позднем возрасте – на основании T-критерия [18–20].
Всем женщинам, включенным в исследование, было проведено стандартное антропометрическое исследование (масса тела, рост, окружность талии [ОТ]) и рассчитан ИМТ. Согласно рекомендациям Международной федерации диабета (International Diabetes Federation, IDF, 2005), показатель ОТ у женщин, равный или более 80 см, принимали за абдоминальное ожирение [21].
Определение уровня 25-гидроксивитамина D (25(ОН)D) в сыворотке крови проведено методом иммунохемилюминесцентного анализа на анализаторе AbbottArchitect 8000 (США). Согласно рекомендациям Международного общества эндокринологов (2011) и клиническим рекомендациям российской ассоциации эндокринологов (2015), за нормальную обеспеченность витамином D принимали значения 25(ОНD в сыворотке крови, равные или превышающие 75 нМоль/л; за недостаточную – значения от 50 до 75 нМоль/л; значения ниже 50 нМоль/л расценивали как дефицит витамина D [22, 23].
Определение уровня ПТГ в сыворотке крови проведено методом хемилюминесцентного анализа с использованием наборов фирмы Beckman Coulter (Великобритания) на аппарате Access. Определение уровня адипонектина, лептина в сыворотке крови проведено методом иммуноферментного анализа с ферментной меткой (ELISA), основанного на принципе «сэндвич» с использованием наборов фирмы DRG® Leptin (ELISA) и DRG® Адипонектин (EIA-2935) (США).
Результаты исследования
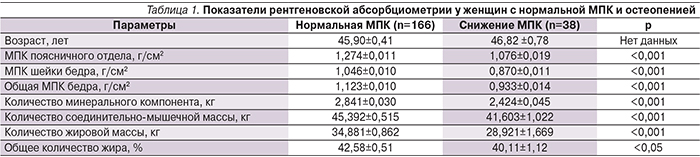
При анализе результатов рентгеновской абсорбциометрии было установлено, что у 38 (18,6%) женщин имелось снижение МПК в поясничном отделе позвоночника или в проксимальном отделе бедренной кости, при этом у 11 (6,6%) человек имелись изменения МПК как в осевом, так и в периферическом отделах скелета. Результаты рентгеновской абсорбциометрии, проведенной у обследованных женщин с нормальной МПК и остеопенией, представлены в табл. 1.
При сравнении параметров, отражающих композиционный состав тела, было выявлено, что у женщин с остеопенией имелись более низкие показатели ИМТ, ОТ, количества жировой массы, в т.ч. жира, локализованного на туловище, а также количества соединительно-мышечной ткани по сравнению со значениями данных параметров у женщин с нормальной МПК (табл. 1).
Результаты проведенного анализа продемонстрировали существование положительной корреляционной связи между показателем МПК в поясничном отделе позвоночника, проксимальном отделе бедра, с одной стороны, и показателями ИМТ (r=0,16, p=0,02 и r=0,43, p=0,008 соответственно), ОТ (r=0,19, p=0,008 и r=0,51, p=0,002, соответственно) и процентом общего количества жира (r=0,21, p=0,005 и r=0,43, p=0,0008 соответственно), с другой. Таким образом, было установлено, что женщины с более высокими показателями минерализации скелета имели большее количество жировой ткани. В связи с этим в зависимости от показателя ОТ женщины были разделены на 2 группы – с абдоминальным ожирением и нормальной массой тела – и отдельно были проанализированы показатели двухэнергетрической рентгеновской абсорбциометрии (табл. 2).
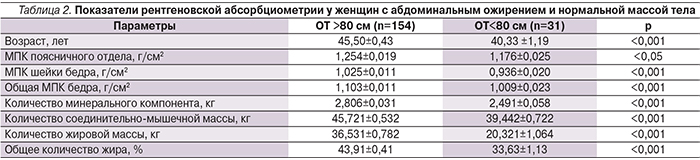
Распределение обследованных позволило подтвердить более высокое значение МПК как в поясничном отделе позвоночника, так и в проксимальном отделе бедра у женщин с избыточным количеством жировой массы. В ходе исследования отдельно были проанализированы уровень обеспеченности витамином D и концентрация ПТГ у женщин с различными показателями минерализации костной ткани. Показатели 25(ОН)D и ПТГ в сыворотке крови представлены в табл. 3.
Было выявлено, что у женщин с остеопенией уровень 25(ОН)D и ПТГ в сыворотке крови достоверно не различался (p>0,05). Однако проведенный корреляционный анализ выявил наличие ассоциаций между значением МПК в поясничном отделе позвоночника и уровнем 25(ОН)D в сыворотке крови (r=0,48, p=0,04), а также концентрацией ПТГ (r=-0,44, p=0,02) у женщин в возрасте до 40 лет, в то же время у женщин старше 40 лет такой взаимосвязи выявлено не было (p>0,05).
Связь МПК с количеством жировой массы послужило поводом для определения уровня адипоцитокинов (адипонектин и лептин) у обследованных женщин. Было установлено, что концентрация адипонектина и лептина у женщин с нормальной МПК и остеопенией не различалась (p>0,05), однако уровень лептина был выше у лиц с абдоминальным ожирением, чем у женщин с показателем ОТ менее 80 см (51,22±2,11и 28,64±4,08 нг/мл соответственно; p<0,01).
Результаты проведенного линейного регрессионного анализа показали, что, несмотря на полученные в ходе исследования ассоциации, наибольшее влияние на показатели МПК поясничного отдела позвоночника (у женщин в возрасте до 40 лет) оказывали уровень 25(ОН)D (R2=0,25, p=0,011) и ПТГ (R2=0,15, p=0,037). Вместе с тем показатели МПК проксимального отдела бедра зависели от ИМТ (R2=0,21, p=0,016), ОТ (R2=0,30, p=0,005), количества жировой ткани (R2=0,28, p=0,006) и уровня лептина в сыворотке крови (R2=0,26, p=0,043) независимо от возраста обследованных женщин.
Обсуждение
Результаты проведенного исследования показали, что 18,6% обследованных женщин имели снижение МПК (остеопения) осевого скелета или проксимального отдела бедра. До настоящего времени отсутствует единая точка зрения о том, с какого возраста начинается физиологическая потеря костной массы. Результаты ряда исследований свидетельствуют об изменениях уже после 30 лет, другие же ученые полагают, что снижение МПК начинается приблизительно к 40 годам. Полученные данные согласуются с результатами других исследователей, показавших, что 15% женщин в возрасте от 30 до 40 лет имеют остеопенический синдром, а около 0,5% – снижение МПК, соответствующее остеопорозу [24]. Принимая во внимание тот факт, что в данное исследование были включены женщины, ранее не имевшие патологии скелета и хронических заболеваний, полученные нами результаты позволяют констатировать, что каждая пятая женщина репродуктивного возраста в последующие периоды годы жизни с появлением дефицита эстрогенов может иметь еще более низкие показатели минерализации скелета.
Женщины с остеопенией имели более низкие, чем женщины с нормальной МПК, показатели ИМТ, ОТ и количества жировой массы. Однако при проведении линейного регрессионного анализа было установлено, что данные факторы оказывали влияние только на показатели минерализации проксимального отдела бедра. Роль низкой массы тела в развитии остеопороза изучена давно. В то же время связь между избыточной массой тела и МПК весьма противоречива. С одной стороны, результаты некоторых исследований показали, что пациенты с ожирением имеют более высокие показатели МПК [14, 15], с другой – более низкие показатели МПК [16, 25], чем лица с нормальной массой тела. Обе теории имеют научное обоснование. Считается, что при избыточном количестве жира увеличивается образование эстрогенов в жировой ткани, а в сочетании с инсулинорезистентностью повышается концентрация андрогенов и эстрогенов в сыворотке крови [26], которые играют важную роль в минерализации скелета [27–29]. В то же время известно, что с возрастом остеобласты костного мозга замещаются адипоцитами и увеличение жировой ткани сопровождается уменьшением объема трабекулярной кости [29]. Активация же рецепторов пероксисом пролифератор-активирующих рецепторов-гамма (PPAR-γ) в костном мозге приводит к дифференцировке адипоцитов и угнетению образования остеобластов из мезенхимальных клеток [30]. В проведенном исследовании была установлена прямая корреляционная зависимость между показателем ОТ, ИМТ, количеством жира, с одной стороны, и МПК, с другой, что ближе к данным, полученным T. Douchi и соавт. в 2000 г. [14] и T.L. Radak и соавт. в 2004 г. [15]. Следует отметить, что оценка МПК проведена женщинам пре- и перименопаузального возраста, что, вероятно, и сказалось на характере полученных результатов.

Вместе с этим в работах последних лет установлено, что в регуляции метаболизма костной ткани могут участвовать адипоцитокины (лептин и адипонектин). Группа исследователей во главе с C.M. Steppan в экспериментальных работах показала, что лептин является потенциальным стимулятором костного роста [31]. J. Cornish и соавт. в 2002 г. пришли к аналогичному выводу [32]. S. Legiran и M.L. Brandi проанализировали имеющиеся исследования и показали, что лептин повышает уровень остеопротегерина, связывающего RANKL, следствием чего является снижение активности остеокластов [33]. Параллельно с этим было установлено, что адипонектин обладает противоположным действием и через систему «RANKL–остеопротегерин» стимулирует пролиферацию остеокластов [5, 32, 34, 35]. Данные, полученные в проведенном исследовании, показали, что уровень адипонектина и лептина у женщин с нормальной МПК и остеопенией не различался. Однако линейный регрессионный анализ выявил, что лептин является независимым фактором, оказывающим влияние на минеральную плотность проксимального отдела бедра. Поскольку гиперлептинемия характерна для лиц с ожирением, изменения МПК или их отсутствие при избыточной массе тела может быть ассоциировано с различным уровнем лептина крови.
Известно, что низкое потребление кальция с пищей относится к факторам риска развития остеопороза и его восполнение в адекватных количествах необходимог при проведении профилактических и лечебных мероприятий. Как было опубликовано ранее [18], для женщин молодого возраста характерно низкое потребление продуктов, богатых кальцием. Однако, несмотря на то что в сутки потребление кальция было практически в 2 раза ниже рекомендуемых возрастных норм [19], его недостаток не оказал влияния на показатели МПК.
Уровень 25(ОН)D и ПТГ в сыворотке крови не был связан с показателями минерализации скелета у всех обследованных женщин. Вместе с тем у женщин в возрасте до 40 лет снижение показателей МПК поясничного отдела позвоночника коррелировало с низким уровнем 25(ОН)D и повышенным уровнем ПТГ в сыворотке крови. Похожие данные были получены и другими исследователями. Так, R. Kremer и соавт. в 2009 г. продемонстрировали, что у пациентов молодого возраста отсутствуют значимые связи между МПК и уровнем обеспеченности витамином D [12]. Другие же исследователи выявили обратную зависимость между этими показателями [36].
Таким образом, проведенное исследование показало, что избыточное количество жировой массы, дефицит витамина D, часто ассоциированный с ожирением, а также повышенный уровень лептина играют наиболее важную роль в формировании пика костной массы у женщин молодого возраста.



