Гипогликемия является наиболее часто встречающимся осложнением при лечении сахарного диабета (CД) и существенно ограничивает возможности по достижению целевого гликемического контроля. Тем самым гипогликемия препятствует профилактике хронических осложнений СД 2 типа (СД2). Гипогликемии чаще возникают при более интенсивных режимах сахароснижающей терапии. Так, исследование ACCORD было досрочно закончено в связи с увеличением смертности в группе интенсивного контроля. Отрицательное влияние более агрессивного контроля было также продемонстрировано в исследованиях NICE-SUGAR; ACLS; SAHS; Australian Diabetes, Obesity and Lifestyle [1, 2]. В ретроспективном анализе базы больных СД в США были использованы данные 48 тыс. пациентов с СД2 за 20-летний период наблюдения. Было показано, что пациенты с НbА1с < 6,7 % или > 9,9 % имели более высокую смертность, чем пациенты с НbА1с в пределах 6,7–9,9 % [4]. В ряде же других исследований не было получено данных, подтверждивших отрицательное влияние интенсивного режима сахароснижающей терапии. К таким исследованиям можно отнести ADVANCE, DCCT, VADT, BARI 2D, DIGAMI 2 [5–8], хотя в этих исследованиях на фоне интенсивной терапии также увеличивалась частота гипогликемий. Подобные результаты можно объяснить разницей в интенсивности терапии. Так, в исследовании ACCORD целевой уровень НbА1с (6,4 %) был достигнут за год, в то время как в исследовании ADVANCE – за 3 года. При этом изначально уровень гликемического контроля в исследовании ACCORD был хуже, чем в ADVANCE (НbА1с – 8,3 против 7,5 %). Длительность СД была больше в исследовании ACCORD и составила в среднем 10 лет. Основной причиной увеличения смертности на фоне интенсивного режима терапии считают увеличение частоты гипогликемии. Американская диабетическая ассоциация определяет гипогликемию как любое снижение уровня глюкозы крови, которое может приносить потенциальный вред, с порогом глюкозы плазмы < 3,9 ммоль/л, с симптомами или без них. Согласно современной классификации, выделяют легкую гипогликемию, при которой больному не требуется помощь других лиц и ее можно купировать приемом быстроусвояемых углеводов, и тяжелую гипогликемию (с потерей сознания или без), при которой пациенту требуется посторонняя помощь.
Повторяющиеся гипогликемии приводят к разбалансировке механизмов защиты и развитию циклов повторных гипогликемий [9]. Это может затруднять достижение контроля гликемии, повышать риск развития осложнений и фатального исхода. Повторяющиеся гипогликемии (рис. 1) снижают способность своевременного их распознавания: пациент не замечает первых признаков гипогликемии. Это может приводить к развитию более тяжелой гипогликемии или даже гипогликемической комы.

В ряде фармакоэкономических исследований, посвященных гипогликемии, проводилась оценка прямых затрат системы здравоохранения: госпитализации, выезды скорой медицинской помощи и т. д. Данные опроса пациентов с СД2 показывают, что 25 % больных отмечают легкие эпизоды гипогликемии еженедельно [23]. Потерянное рабочее время составляет 8,3–15,9 часа на один эпизод. Большая часть этих эпизодов была ночной с последующим пропуском работы 28 % пациентов [24].
 C внедрением новых технологий, таких как одновременное мониторирование ЭКГ и гликемии, появилась возможность выявлять бессимптомные гипогликемии (рис. 2) и определять механизмы, в результате которых гипогликемия приводит к увеличению сердечно-сосудистой смертности. Так, при гипогликемии выявляются следующие изменения ЭКГ: удлинение интервала QT, депрессия сегмента ST [10–12, 14], снижение вариабельности сердечного ритма [42]. Подобные изменения повышают аритмогенную активность и сопровождаются увеличением риска внезапной смерти среди пациентов с СД [10, 11, 13–15]. Механизм данного явления можно объяснить тем, что при удлиненном QT происходит развитие тахикардии и/или фибрилляции [14]. В крупномасштабном исследовании длительностью 5 лет у пациентов с СД2 удлинение корригированного интервала QT более 460 мс ассоциировалось с 2-кратным увеличением смертности. Проаритмогенный характер увели-чения дисперсии интервала QT был подтвержден и в других исследованиях.
C внедрением новых технологий, таких как одновременное мониторирование ЭКГ и гликемии, появилась возможность выявлять бессимптомные гипогликемии (рис. 2) и определять механизмы, в результате которых гипогликемия приводит к увеличению сердечно-сосудистой смертности. Так, при гипогликемии выявляются следующие изменения ЭКГ: удлинение интервала QT, депрессия сегмента ST [10–12, 14], снижение вариабельности сердечного ритма [42]. Подобные изменения повышают аритмогенную активность и сопровождаются увеличением риска внезапной смерти среди пациентов с СД [10, 11, 13–15]. Механизм данного явления можно объяснить тем, что при удлиненном QT происходит развитие тахикардии и/или фибрилляции [14]. В крупномасштабном исследовании длительностью 5 лет у пациентов с СД2 удлинение корригированного интервала QT более 460 мс ассоциировалось с 2-кратным увеличением смертности. Проаритмогенный характер увели-чения дисперсии интервала QT был подтвержден и в других исследованиях.
Как видно из рис. 2, частота нераспознанных гипогликемий у пациентов с СД 1 и 2 типов составляет более 50 %. Подобные результаты подтверждаются и другими исследованиями.
Следует отметить, что на сегодняшний день нет стопроцентного подтверждения отрицательного влияния гипогликемии на сердце. Нельзя исключить, что увеличение дозы препаратов на фоне активного режима жизни увеличивало риск побочных эффектов. Кроме того, гипогликемия может служить суррогатным маркером тяжести СД: к тяжелым гипогликемиям в большей степени предрасположены пациенты с длительным стажем диабета, выраженными осложнениями. Это подтверждают результаты исследования ACCORD, в котором не было получено данных об увеличении смертности на фоне повторных гипогликемий [4]. Необходимо также учитывать возраст больных. Так, пациенты старшей возрастной группы (> 75 лет) более предрасположены к тяжелым гипогликемиям. Это связано с наличием сопутствующих заболеваний, возрастным снижением уровней контринсулярных гормонов (глюкагона, соматотропного гормона), а также снижением почечной функции и активности печеночных ферментов, что может изменять метаболизм препаратов (сульфонилмочевины и инсулина). Кроме того, необходимо оценивать чувствительность пациентов к гипогликемиям. Известно, что частые гипогликемии могут приводить к автономной недостаточности в ответ на гипогликемию, что увеличивает риск тяжелой гипогликемии и, соответственно, смерти. Хотя в настоящее время существует мнение, будто развитие автономной недостаточности служит приспособительной реакцией на повторяющиеся гипогликемии. На это указывают эксперименты на животных: смертность на фоне тяжелой гипогликемии была ниже у мышей с гипогликемиями в анамнезе, чем без них.
 На вопрос о влиянии гипогликемии на снижение ментальных способностей до настоящего времени нет единого ответа. Наблюдательное исследование длительностью более 20 лет (1980–2002) показало увеличение риска развития деменции в 2 раза среди пациентов с СД, которые обращались за медицинской помощью из-за гипогликемии. Следует отметить, что до начала исследования когнитивные тесты пациенты не проходили. Результаты исследования ACCORDMIND [1] не показали отрицательного влияния гипогликемии на когнитивную функцию.
На вопрос о влиянии гипогликемии на снижение ментальных способностей до настоящего времени нет единого ответа. Наблюдательное исследование длительностью более 20 лет (1980–2002) показало увеличение риска развития деменции в 2 раза среди пациентов с СД, которые обращались за медицинской помощью из-за гипогликемии. Следует отметить, что до начала исследования когнитивные тесты пациенты не проходили. Результаты исследования ACCORDMIND [1] не показали отрицательного влияния гипогликемии на когнитивную функцию.
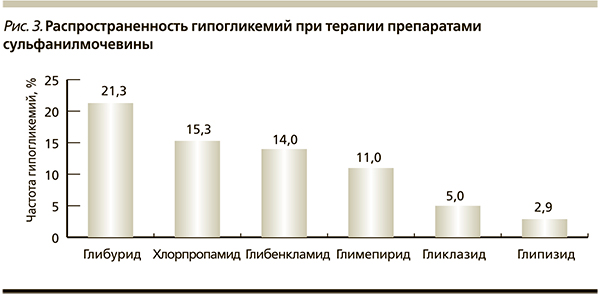
В настоящее время нет убедительных доказательств опасности легких гипогликемий. Однако страх гипогликемий заставляет врачей и пациентов поддерживать уровень гликемии выше рекомендуемых целевых значений (37 % пациентов не достигают компенсации углеводного обмена из-за страха гипогликемии), что увеличивает риск развития осложнений. Для достижения поставленной терапевтической цели очень важно выявить у пациента нечувствительность (или сниженную чувствительность) к гипогликемии. Для того чтобы минимизировать частоту гипогликемических состояний у пациентов с СД2, в т. ч. и бессимптомных, нужно рекомендовать больным частый мониторинг глюкозы в крови в проблемные периоды, например в ночные часы в течение 3–7 дней. Наибольший риск развития гипогликемий возникает у пациентов, получающих инсулин и/или препараты сульфонилмочевины [17]. Это связано с тем, что данные препараты вызывают в определенное время гиперинсулинемию. Различные представители этого класса обладают разным относительным риском вызывать гипогликемии [16]. Это вызвано различиями в аффинности к рецепторам β-клеток, которая выше у препаратов сульфонилмочевины длительного действия (рис. 3) [15, 16]. Поэтому для снижения риска гипогликемии пациентам, получающим глибенкламид, не стоит увеличивать дозу более 7,5 мг/сут, т. к. уже на этой дозе развивается максимальный сахароснижающий эффект.
Так как пациенты с СД2 представляют собой весьма гетерогенную популяцию в плане инсулинсекреторных возможностей, контроль диабета должен быть индивидуализирован. Основой успешного контроля является обучение больных по структурированной программе. По мере развития заболевания изменяются и подходы к содержанию обучающих программ: чем больше длительность диабета, тем больше знаний о гипогликемии и соответствующих поведенческих навыков должно быть у пациента. Риск гипогликемии повышается с появлением новых факторов риска. Наибольшему риску подвергаются пациенты, которым назначается новый вид терапии, изменяется доза препарата. При определении целевых значений гликемии и расчете рисков необходимо учитывать продолжительность заболевания и наличие сопутствующих сердечно-сосудистых или почечных заболеваний для назначения наиболее безопасного режима сахароснижающей терапии. Многие пациенты могут не знать о связи факторов риска (употребление алкоголя, физические нагрузки) с развитием гипогликемии. Поскольку большинство пациентов обычно не информируют врачей об эпизодах гипогликемии, необходимо активно инициировать диалог об этом на визитах. Пациентам с высоким риском гипогликемии необходимо скорректировать терапию и повысить индивидуальные целевые значения гликемического контроля. Наличие гипогликемии в анамнезе должно быть учтено при корректировке режима терапии или дозировки препаратов. Снижение частоты гипогликемии улучшает качество жизни пациентов и усиливает удовлетворение от лечения, а также препятствует развитию осложнений СД [25].
В настоящее время инкретиннаправленная терапия СД2 рассматривается как одна из наиболее перспективных и безопасных. Инкретиномиметики, включая ингибиторы дипептидилпептидазы-4 (ДПП-4), вызывают глюкозозависимое усиление секреции инсулина β-клетками, глюкозозависимое уменьшение секреции глюкагона, замедление опорожнения желудка и снижение потребления пищи за счет повышения чувства насыщения после еды. Следует подчеркнуть, что даже при условии жесткого контроля гликемии практически отсутствует риск развития тяжелых гипогликемий, т. к. необходимым условием стимуляции секреции инсулина β-клетками служит наличие минимального уровня глюкозы (не менее 4,5 ммоль/л). При нормальных значениях гликемии эффекты препаратов данных групп не проявляются. Поэтому одним из преимуществ этих препаратов является возможность их широкого применения больными СД2 с минимальным риском развития гипогликемий, в т. ч. в группах пожилых пациентов, пациентов с гипертензией и нарушением почечной функции средней тяжести, больных группы сердечно-сосудистого риска. Ингибиторы ДПП-4 можно комбинировать с любым сахароснижающим препаратом, в т. ч. с инсулином [18].
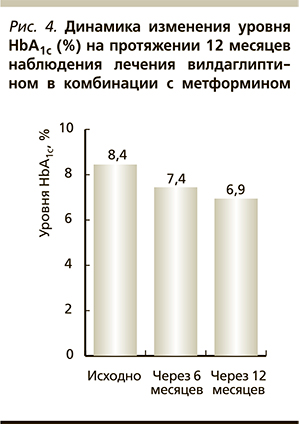
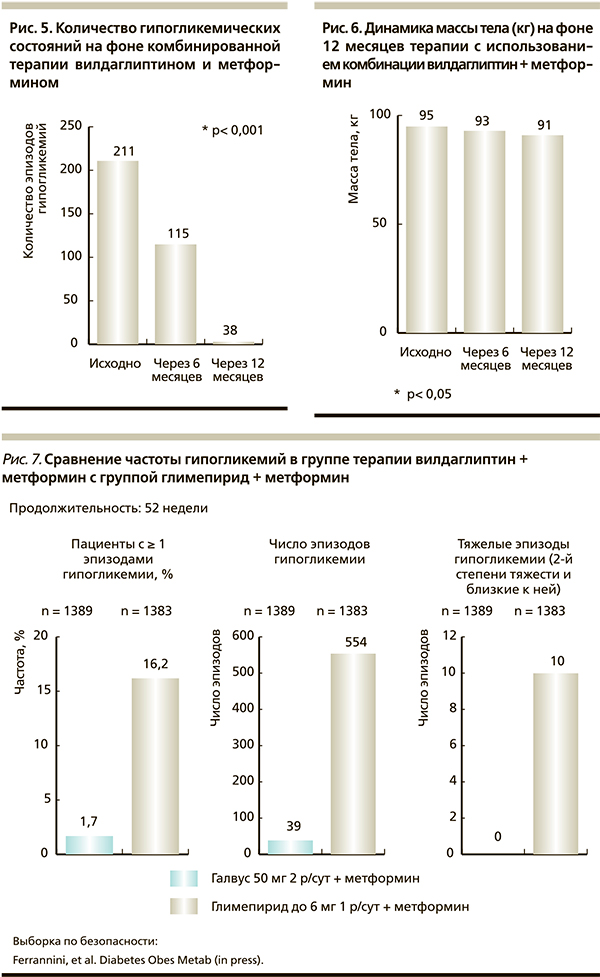
Одним из препаратов класса ингибиторов ДПП-4 является вилдаглиптин (Галвус). В ходе международных клинических исследований с участием свыше 22 тыс. больных СД2 и нарушенной толерантностью к глюкозе была показана эффективность вилдаглиптина при применении его как в виде монотерапии, так и в комбинации с другими сахароснижающими средствами. К настоящему времени проведена серия работ, в которых доказана целесообразность комбинированной терапии вилдаглиптина с метформином. Вилдаглиптин в комбинации с метформином оказывает синергичное влияние на синтез и активность глюкагон-подобного пептида-1 [19], обеспечивает эффективный гликемический контроль без риска развития гипогликемий и повышения массы тела. Так, наблюдательная программа «Эффективность препарата Галвус Мет (вилдаглиптин + метформин) в реальной клинической практике в Москве» показала высокую эффективность и безопасность подобного варианта комбинированной сахароснижающей терапии 3200 пациентов с СД2 (рис. 4–6) на протяжении 12 месяцев наблюдения [20].
В другом исследовании сравнивалась эффективность комбинированной терапии вилдаглиптином (50 мг × 2 р/сут) + метформин (1500 мг/сут) с комбинацией глимепирида (6 мг/сут) + метформин (1500 мг/сут). Было показано, что в течение года терапии показатели гликемического контроля были сходными в обеих группах: среднее снижение HbA1c на 0,7–0,8 % при исходном HbA1c – 7,3 % [21]. Через год терапии разница в динамике массы тела составила 2,8 кг между больными первой и второй групп. Частота гипогликемий в группе терапии вилдаглиптином + метформин оказалась минимальной, при этом тяжелых эпизодов не было зарегистрировано вообще (рис. 7) [21].
В последние годы появились сведения о том, что метформин способствует увеличению уровня глюкагон-подобного пептида-1. Среди предполагаемых механизмов обсуждается роль метформина в непосредственном усилении секреторной функции L-клеток кишечника, активации транскрипции/трансляции гена проглюкагона, снижении почечной экскреции глюкагон-подобного пептида-1, блокаде ДПП-4 [22]. Было показано, что повышение уровня глюкагон-подобного пептида-1 на фоне приема метформина и ингибиторов ДПП-4 идентично.
При комбинированном приеме метформина и ингибиторов ДПП-4 отмечается суммация эффекта.
Таким образом, комбинированная терапия метформином и ингибиторами ДПП-4 оказывает одновременное воздействие на ключевые звенья патогенеза СД2 – инсулинорезистентность и нарушение функции островковых клеток поджелудочной железы, что обеспечивает высокий терапевтический потенциал данному виду лечения.



