Современные достижения в области кардиологии на клеточно-молекулярном уровне позволили подвергнуть критическому переосмыслению ранее считавшиеся основополагающими позиции в вопросах патофизиологии и лечения сердечно-сосудистых заболеваний (ССЗ), в частности артериальной гипертензии (АГ). Окончательно признана полигенность эссенциальной АГ, что означает необходимость ее рассмотрения не как болезнь хронически повышенного артериального давления (АД), а как сложный комплекс взаимосвязанных гемодинамических, метаболических и нейрогуморальных нарушений.
Согласно единому сердечно-сосудистому почечному континууму, предложенному в 1991 г. V. Dzau и E. Braunwald, в котором ренин-ангиотензин-альдостероновая система (РААС) представлена ведущим звеном в адаптационной регуляции параметров центральной гемодинамики, АГ следует рассматривать как один из основных модифицируемых факторов риска в прогрессировании ишемической болезни сердца (ИБС) и хронической сердечной недостаточности (ХСН) [1, 14].
Изменения во взглядах ведущих специалистов в области кардиологии на патофизиологию, диагностику и лечение АГ, произошедшие за последние десятилетия клинической практики, отражены в Европейских рекомендациях по диагностике и лечению АГ (2010–2013), в которых постулировано главное направление лечебных мероприятий – необходимость коррекции эндотелиальной дисфункции, т.к., по мнению многих ведущих специалистов, АГ – «болезнь эндотелия» [4, 7, 9, 17].
Дисфункция эндотелия – снижение способности эндотелиальных клеток секретировать эндотелий-зависимый фактор релаксации – NO, с относительным или абсолютным увеличением секреции сосудосуживающих, агрегационных и пролиферативных факторов. Одним из важных компонентов в формировании эндотелиальной дисфункции является повышенная активация РААС. Взаимосвязь изменений функции и структуры нескольких органов и систем организма в рамках сердечно-сосудистого континуума предполагает наличие общих патофизиологических процессов в развитии и прогрессировании органных повреждений. В основном все многообразие механизмов адаптации и дезадаптации может быть сведено к генетическим, нейрогуморальным и гемодинамическим факторами. Среди них одно из центральных звеньев принадлежит активации РААС, которая прослеживается практически на всех этапах сердечно-сосудистого континуума [1, 2, 3, 6, 9, 17].
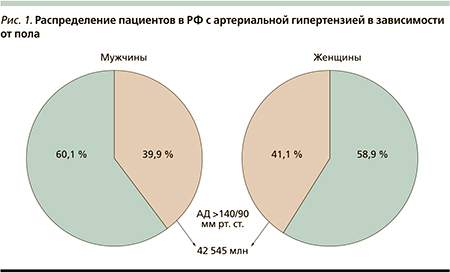
Артериальная гипертензия занимает ведущее место в структуре ССЗ и их осложнений во всех странах с развитой экономикой, что определяет ее как социально-медицинскую интернациональную проблему. Стабильно высокий уровень АД > 140/90 мм рт. ст. в 3–4 раза увеличивает риск развития сердечно-сосудистых осложнений: мозговой инсульт, острый коронарный синдром, инфаркт миокарда, сердечная недостаточность с летальным исходом.
По данным эпидемиологического исследования, проведенного в РФ среди взрослого населения, у 42,5 млн человек регистрируются повышенные цифры АД: у 41,1 % женщин и 39,2 % мужчин (рис. 1).
Метаболический синдром, по определению экспертов ВОЗ: «…неинфекционная пандемия начала XXI в.». Метаболический синдром представляет собой комплекс метаболических нарушений и ССЗ (АГ, ИБС, ХСН), последовательность развития которых патогенетически взаимосвязана с инсулинорезистентностью и манифестирует нарушениями углеводного обмена, атерогенной дислипидемией, повышением триглициридов, липопротеидов низкой плотности, снижением липопротеидов высокой плотности на фоне висцерально-абдоминального типа ожирения [8, 11, 12].
Ломка старых стереотипов о концепции патогенеза хронически высокого уровня АД (взамен концепции о приоритетности гемодинамической разгрузки – снижение АД) определила главное направление лечебных мероприятий – необходимость коррекции эндотелиальной дисфункции, т.к., по мнению ведущих экспертов ВОЗ, патологически высокий уровень АД (> 140/90 мм рт. ст.), как указывалось выше, представляет собой «болезнь эндотелия» [1, 3, 4, 9, 17].
В настоящее время в Европейские рекомендации по диагностике и лечению АГ внесен ряд существенных дополнений:
Выделена «абдоминальная» (андрогенная) форма ожирения как маркера «метаболического синдрома», одним из компонентов которого является АГ.
Выделены нарушения углеводного обмена в качестве одних из ведущих факторов риска, увеличивающих частоту формирования высокого уровня АД.
К числу маркеров риска поражения эндотелия (основного звена в патогенезе АГ) добавлен С-реактивный белок, высокий уровень которого является значимым предиктором сердечно-сосудистых осложнений.
Наличие микроальбуминурии рассматривается в качестве признака поражения «органов-мишеней» при АГ (в частности, почек), в то время как протеинурия – в качестве признака ассоциированной патологии почек.
Повышение уровня креатинина в пределах 107–133 ммоль/л рассматривается как признак поражения «органов-мишеней», тогда как концентрация креатинина в сыворотке, превышающая 133 ммоль/л, свидетельствует о полиморбидном состоянии [7].

Ренин-ангиотензин-альдостероновая система играет важную роль в регуляции АД, электролитного и водного баланса, в связи с чем фармакологическая блокада этой системы на любом ее уровне может оказывать положительные эффекты при лечении АГ.
В арсенале врачей первичного звена здравоохранения РФ в настоящее время имеются 3 группы лекарственных средств, способных блокировать активность РААС: ингибиторы ангиотензин-превращающего фермента (иАПФ), блокаторы рецепторов ангиотензина II (БРАТII) – сартаны, прямой ингибитор ренина.
На сегодняшний день получена максимальная доказательная база о непосредственной гипотензивной, плейотропной эффективности ингибиторов ангиотензин-превращающего фермента – иАПФ [1, 3, 6, 10, 15–17].
По силе своего воздействия на эндотелий ингибиторы АПФ равны статинам, эффективность которых в профилактике и регрессе атеросклеротических поражений и дисфункции эндотелия доказана в многочисленных исследованиях. Многопрофильность действия иАПФ позволила назвать их «золотым» стандартом в терапии ССЗ [1, 3, 15].
История изучения РААС берет свое начало от 1898 г., когда в Стокгольмском каролинском университете финский физиолог Robert Tigelstedt и его ученик Per Gunnan Bergman выделили из почечной ткани первый компонент РААС – ренин. Спустя более 50 лет, в 1940 г., две группы исследователей независимо друг от друга идентифицировали вещество, которое образовывалось под действием активированного ренина. Группа исследователей аргентинского Университета в Буэнос-Айросе под руководством профессора E. Braun-Menendez выделила биологически активную гипертензивную субстанцию, которую назвали «гипертензин». В том же году группа ученых под руководством выдающегося специалиста в области физиологии почек и патофизиологии артериальной гипертонии I.
Page идентифицировала субстрат, получивший название «ангиотонин», который под действием ренина оказывал мощный гипертензивный эффект. В 1958 г. термины «гипертензин» и «ангиотонин» при обоюдном согласии были объединены под единым названием «ангиотензин» [2, 8, 10].
В 1960 г. бразильским исследователем S. Ferreira идентифицирован ангиотензин-превращающий фермент (АПФ), первоначально названный «брадикинин-потенциирующий фактор». В последующем несколько научно-биологических лабораторий показали, что фермент, стабилизирующий брадикинин, идентичен АПФ.
Первой попыткой фармакологического контроля за активностью РААС были экспериментальные исследования о конкурентной способности рецепторов к ангиотензину II (АТII) аминокислотного соединения 1-Асп-S-Ала-АТII (Саларазин), проведенные в 1971 г. D. Pals с сотрудниками. Клиническое применение Саларазина было отсрочено более чем на 20 лет в связи с кратковременностью гипотензивного эффекта и необходимостью внутривенного введения. А уже в 1971 г. в лаборатории фирмы «Squibb» был синтезирован первый игибитор АПФ – тепротид, выделенный непосредственно из яда змеи Bothrops Jararaca. Несмотря на устойчивый гипотензивный эффект, его токсическое действие стало препятствием для применения в клинической практике. В 1975 г. в той же лаборатории был создан первый пероральный иАПФ SQ14.225 – Каптоприл, вскоре были синтезированы два других иАПФ – Эналаприл и Лизиноприл.
Но лишь сегодня, спустя более 50 лет, становится понятной важная роль РААС и иАПФ не только в гомеокинетической регуляции АД, перфузии тканей, баланса жидкости и электролитов, но и в широком спектре профилактики патологических процессов сердечно-сосудистого континуума.
Ренин-ангиотензин-альдостероновая система представляет уникальную регуляторную систему, активным эффектором которой является АТII, вырабатываемый в межклеточном пространстве путем последовательного протеолитического расщепления его предшественников. Предшественник АТII – ангиотензиноген (АТГ) – биологически инертный глобулин, содержащий 14 аминокислотных компонентов, синтезируемый в основном в печени, который под действием ренина путем отщепления 4 концевых аминокислотных компонентов превращается в ангиотензин I (АТI).
В свою очередь АТI биологически активен (вазоконстриктор), под действием АПФ экзопептидаза, локализованная на мембранах различных клеток (эндотелиальных, эпителиоцитов проксимальных почечных канальцев, нейроэпителиоцитов), путем отщепления еще двух аминокислотных компонентов превращается в активный АТII (рис. 2).
Основным эффектором РААС служит АТII, действие которого реализуется через специфические рецепторы ангиотензина II (РАТII). К настоящему моменту выделено 4 подтипа РАТII1–4. Наибольшее значение имеют РАТII1, 2, через стимуляцию которых реализуется большинство как физиологических, так и патофизиологических эффектов АТII.
РАТII1 локализованы в кровеносных сосудах, сердце, почках, надпочечниках, печени, головном мозге и легких. РАТII2 широко представлены в мозге, почках и других тканях, играют контррегуляторную роль в отношении АТII1 (см. таблицу). Функции РАТII3 мало изучены, и их стимуляция, видимо, участвует в спектре липидного обмена адипоцитов, а стимуляция АТII4 модулирует синтез ингибитора активатора плазминогена. Недавно выявлены также специфические рецепторы проренина, их роль уточняется. В эксперименте показано их влияние на развитие диабетической нефропатии. По мере совершенствования идентификации рецепторов АТII и их долевого участия в функционировании РААС с позиций клинической фармакологии созданы новые блокаторы рецепторов АТII (БРАТII) – сартаны, к числу которых в настоящее время относятся непептидные соединения с высокоселективным блокирующим эффектом АТ1-рецепторов: валсартан, ирбесартан, кандесартан, лозартан, телмисартан, эпросартан.
В настоящее время по своим фармакодинамическим характеристикам БРАТII подразделяются на два поколения: первое оказывает влияние только на РААС через блокаду АТ1-рецепторов, второе поколение БРАТII – это бифункциональные лекарственные препараты, не только блокирующие АТ1-рецепторы, но и активирующие PPAR-γ (ядерные рецепторы, активируемые пероксисомальными пролифераторами-γ), участвующие в регуляции внутриклеточного углеводного и липидного обменов.
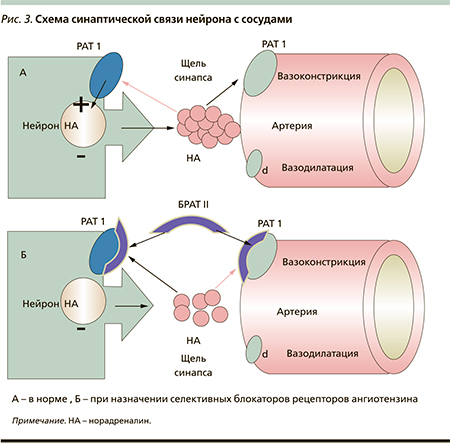
Суммарно механизмы действия БРАТII обусловлены воздействием на основные нейрогуморальные звенья регуляции сосудистого тонуса РААС и симпатической нервной системы. Препараты этой группы не только блокируют биологические эффекты АТII, реализуемые через АТ1-рецепторы сосудов и надпочечников, но и взаимодействуют с пресинаптическими рецепторами адренергических нейронов. Одновременно в основе антигипертензивного действия селективных БРАТII лежит их аффинная способность избирательно блокировать пресинаптические РАТII1, которые контролируют темп синтеза и секрецию норадреналина в синаптическую щель. Снижая синтез и секрецию норадреналина в «синаптическую щель», БРАТII реализуют свой гипотензивный эффект через снижение тонуса симпатической нервной системы (рис. 3).
Не оказывая влияния на активность АПФ, БРАТII не влияет на метаболизм брадикинина, способствует увеличению высвобождения NO и длительности его биологической жизни, что суммарно реализуется в более эффективную вазодилатацию.
В многочисленных многоцентровых исследованиях были выявлены дополнительные механизмы гипотензивного эффекта через воздействие БРАТII на гемореологию и микроцеркуляцию, которое опосредуется через биологические структуры гомеокинеза:
А. БРАТII не блокируют тканевую активность калликреин-кининовой системы, которая является одним из компонентов внутреннего каскада конверсии плазминогена в плазмин. В свою очередь плазмин способствует удалению избытка фибриногена из сосудистого русла.
Б. БРАТII снижают активность тромбоцитарно-сосудистого звена гемостаза. Тромбоциты человека имеют рецепторы к АТII. Антитромбоцитарная активность БРАТII связана, с одной стороны, с блокадой рецепторов тромбоцитов, с другой – с благоприятным их влиянием на эндотелий сосудов (антиагрегантные эффекты) и уменьшением внутриклеточной концентрации кальция в тромбоцитах.
В. Селективные БРАТII тормозят рост, миграцию и пролиферацию гладкомышечных клеток сосудов, трансформацию моноцитов в пенистые клетки, вызывают регресс структурных изменений в артериолах.
Г. БРАТII улучшают липидный профиль крови через снижение концентрации атерогенных липидов и увеличение холестерина липопротеидов высокой плотности; снижают толерантность к глюкозе через увеличение чувствительности клеточных рецепторов к инсулину, что суммарно ведет к снижению вязкости крови [2, 6, 8, 10, 15].
Данные литературы свидетельствуют о нарушении функциональной активности тромбоцитов уже на ранней стадии АГ, что проявляется повышением их агрегационной активности, повышением чувствительности к индукторам агрегации [4, 12, 13].
Причинами повышения агрегационной активности тромбоцитов при АГ могут быть активация симпато-адреналовой системы (за счет гиперкатехоламинемии), РААС с повышением концентрации ренина плазмы, что провоцирует образование внутрисосудистых эритроцитарно-тромбоцитарных агрегатов и высвобождение аденозиндифосфата. Дислипидемия вносит существенный вклад в функциональную гиперактивность тромбоцитов. Увеличение содержания общего холестерина, холестерина липопротеидов низкой и очень низкой плотности вызывает гиперсекрецию тромбоксана А2 с повышением агрегационной активности тромбоцитов. Это связано с наличием на поверхности тромбоцитов рецепторов апо-В и апо-Е липопротеинов. Активация тромбоцитов также может быть связана с эндотелиальной дисфункцией, возникновением дисбаланса между выработкой активирующих и блокирующих механизмов, а в дальнейшем – с ремоделированием сосудистой стенки.
В свою очередь деформируемость эритроцитов снижается в связи с абсорбцией на поверхности эритроцитарных мембран белков плазмы, прежде всего фибриногена. Нарушения деформируемости эритроцитов имеют место при изменениях липидного спектра крови, прежде всего при нарушении соотношения холестерин/фосфолипиды, и при наличии продуктов перекисного окисления липидов. Изменение эластических свойств эритроцитарных мембран сопровождается снижением их поверхностного заряда с последующим образованием эритроцитарных агрегатов. Суммарно это повышает вязкостное сопротивление кровотоку на уровне артериол и является дополнительным фактором повышения АД [13].
Таким образом, антигипертензивное действие БРАТII основано на их суммарном воздействии непосредственно на сердечно-сосудистую систему и опосредованно – на улучшение реологических параметров крови (вязкость, агрегационная активность тромбоцитов и эритроцитов).
Результаты многочисленных клинических исследований, при которых были выявлены плейотропные эффекты сартанов, позволили сформулировать ряд новых показаний к применению этой группы препаратов в клинической практике – метаболический синдром, диабетическая нефропатия с микроальбуминурией или протеинурией, ХСН, фибрилляция предсердий, заболевания сердечно-сосудистой системы с гипертрофией левого желудочка, непереносимость иАПФ (сухой кашель, невротический отек).
В настоящее время в аптечной системе РФ одним из первых представителей сартанов второго поколения с бифункциональными фармакологическими свойствами, разрешенным к лечению ССЗ, считается телмисартан (Микардис®). Телмисартан получен из активного метаболита лозартана (ЕХР 3174) путем замещения бензимидазольного на липофильный имидозольный компонент, что определило более выраженную липофильность, тканевую биодоступность этого препарата из всех БРАТII. Благодаря наличию липофильной группы телмисартан в дозировке 80 мг однократно в сутки быстро всасывается в желудочно-кишечном тракте (биодоступность до 50 %) с достижением пиковой концентрации в плазме крови через 0,5–1,0 час с периодом полувыведения более 20 часов. Стабильная терапевтическая концентрация телмисартана в плазме крови наступает после 5–7 дней приема препарата с устойчивым гипотензивным эффектом [8].
Клиническая эффективность телмисартана при различных коморбидных состояниях сердечно-сосудистой системы была документирована в многочисленных многоцентровых исследованиях – TRANSCEND, PROTECTION, PRISMA I, PRISMA II, SMOOTH, ATHOS, PROBE, в которых проводились оценки наличия гипотензивного, антидиабетического, нефропротективного, антиагрегантного свойств телмисартана [2, 5, 6, 8, 10, 11, 16]. Результаты данных исследований убедительно показали наличие у телмисартана плейотропных фармакодинамических эффектов с органопртекцией, улучшением качества и прогноза жизни среди пациентов с различными ССЗ.
Современная стратегия коррекции высоких уровней АД подразумевает в первую очередь снижение риска сердечно-сосудистых осложнений, летальных исходов, улучшение состояния органов мишеней на фоне эффективного контроля АД. Этой цели соответствует дальнейшее развитие бифункциональных лекарственных средств – БРАТII (сартаны), обладающих двумя и более биофармакологическими механизмами действия, оказывающих протективное влияние на органы-мишени, что повысит эффективность при лечении пациентов с ССЗ.
Таким образом, блокаторы рецепторов АТII (БРАТII1) – большая группа лекарственных препаратов с плейотропными фармакологическими свойствами, обладающая многокомпонентной антигипертензивной эффективностью и хорошей переносимостью. За последние годы получены убедительные доказательства, что БРАТII способны улучшить отдаленный прогноз для больных АГ, особенно при сочетании с нарушениями углеводного и липидного метаболизма, наличии признаков диабетической нефропатии, являющихся компонентами метаболического синдрома. Использование сартанов – селективных БРАТII (телмисартан) в клинической практике врача первичного звена перспективен в лечении ССЗ, особенно на ранних этапах сердечно-сосудистого континуума и метаболического синдрома.



