Введение
Пандемия новой коронавирусной инфекции COVID-19 представляет глобальную опасность для всех людей, живущих на планете, но пациенты с хроническими заболеваниями, несомненно, особенно уязвимы к такому серьезному заболеванию и вероятность их смерти очень высока. Риск развития тяжелых проявлений новой коронавирусной инфекции чрезвычайно высокий у онкологических пациентов, получающих химиотерапию, а также у пациентов, для лечения которых требуется постоянное применение иммуносупрессивной и цитотоксической терапии. Одними из представителей такой группы риска являются пациенты после трансплантации органов, которые должны постоянно принимать иммуносупрессивные препараты [1].
В то же время в одних из первых сообщений отмечалась низкая заболеваемость реципиентов трансплантированных органов. Так, по сравнению с общим числом в 67 тыс. случаев новой коронавирусной инфекции COVID-19 в провинции Хубэй только в общей сложности 22 случая были подтверждены у реципиентов трансплантации органов. 23 января было диагностировано 19 больных с трансплантацией почек и 3 – с трансплантацией печени [2]. Вероятно, это в значительной степени связано с многолетним и постоянным медицинским наблюдением за реципиентами трансплантата. Пациенты, перенесшие трансплантацию, лучше могут использовать методы самозащиты, особенно если они носят маски во время интенсивных сезонов гриппа. Это дает дополнительные доказательства того, что пациенты с трансплантацией органов могут защитить себя от инфекции с помощью дистанцирования, маскировки, мытья рук и самоизоляции, даже если их иммунитет ниже нормы.
К моменту написанию этой статьи в мировой медицинской общественности не было единого мнения о режиме иммуносупрессивной терапии реципиентов почечного аллотрансплантата. Есть мнение о полной отмене ингибиторов кальцийневрина или к его уменьшению.
И в то же время ввиду отсутствия данных долгосрочных наблюдений полная отмена ингибиторов кальцийневрина требует отдельных исследований, тем более есть мнение о подавление репликаций коронавируса ингибитором кальцийневрина – циклоспорином А [3, 4]. И в одном авторы опубликованных работ соглашаются – это необходимость полной отмены микофенолата мофетила и азатиоприна [5, 6].
Случай из нашей практики, представленный вашему вниманию. состоялся еще до появления публикаций приведенных выше работ – в самом начале госпитализации пациентов после АТП с диагностированной новой коронавирусной инфекцией COVID-19. Перед нами стояла цель – лечение вирусной инфекции и сохранение функции трансплантированного органа; именно поэтому была применена вся доступная терапия: достичь поставленную цель.
Клиническое наблюдение
Пациентка М. 57 лет доставлена бригадой СМП в отделение нефрологии № 1 (патологии трансплантированной почки) ГБУЗ ГКБ № 52 ДЗМ с жалобами на непродуктивный кашель и повышение температуры до 38,00. Из анамнеза известно, что впервые лейкоцитурия и эритроцитурия были выявлены в 2007 г., но пациентка не обследовалась и не лечилась В 2012 г. при прогрессировании почечной недостаточности, потребовавшей начало заместительной почечной терапии – сеансы гемодиализа. По данным серологии диагностирован быстропрогрессирующий гломерулонефрит в рамках ANCA-ассоциированного васкулита. Проведена пульс-терапия метилпреднизолоном в суммарной дозе 1500 мг и циклофосфан 600 мг 1 раз в 2 недели, в последующем – преднизолон 20 мг внутрь. Однако, несмотря на проведенную терапию, функция почек не восстановилась и в связи с неудовлетворительной переносимостью сеансов гемодиализа пациентка была переведена на лечение перитонеальным диализом. В октябре 2013 г. выполнена аллотрансплантация трупной почки. Функция трансплантата немедленная. Базисная иммуносупрессивная терапия: циклоспорин, микофенолат мофетила, преднизолон. В августе 2015 г. криз отторжения трансплантированной почки, в комплексной терапии которого была выполнена конверсия с циклоспорина на такролимус пролонгированного действия. С ноября 2015 г. – рецидивирующее течение пиелонефрита трансплантата, азотвыделительная функция трансплантированной почки оставалась в диапазоне 150–225 ммоль/л. С 6.02 по 14.02.2020 находилась на стационарном лечении по поводу активного пиелонефрита трансплантата. Проведена антибактериальная терапия. За время госпитализации концентрация креатинина в плазме крови достигала 147–136 ммоль/л, концентрация такролимуса в крови – 5,0–7,0 нг/мл. Была выписана в удовлетворительном состоянии.
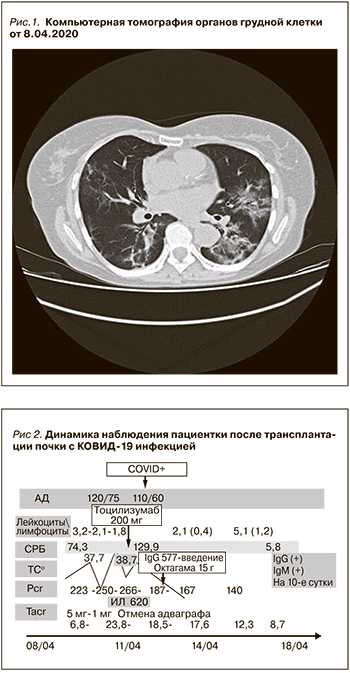 Настоящая госпитализация с 8 по 20 апреля 2020 г. Состояние при поступлении средней тяжести: одышки в покое нет, в легких дыхание везикулярное, в нижних отделах влажные мелкопузырчатые хрипы, синусовая тахикардия – 118 в мин. Умеренный лейкоцитоз (11х109 /л), СРБ – 116 мг/мл, креатинин в плазме крови – 140 мкмоль/л. По данным КТ органов грудной клетки, картина массивного двустороннего поражения легких, типичная для тяжелого COVID-19 (рис. 1).
Настоящая госпитализация с 8 по 20 апреля 2020 г. Состояние при поступлении средней тяжести: одышки в покое нет, в легких дыхание везикулярное, в нижних отделах влажные мелкопузырчатые хрипы, синусовая тахикардия – 118 в мин. Умеренный лейкоцитоз (11х109 /л), СРБ – 116 мг/мл, креатинин в плазме крови – 140 мкмоль/л. По данным КТ органов грудной клетки, картина массивного двустороннего поражения легких, типичная для тяжелого COVID-19 (рис. 1).
Пациентке была скорректирована иммуносупрессивная терапия: доза такролимуса пролонгированного действия с 5 мг в сутки снижена до 1,5 мг в сутки, метилпреднизолон был увеличен до 8 мг в сутки, отменен мофетила микофенолат и назначена следующая терапия: лопинавир 200 мг/ритонавир 50 мг 2 раза в сутки, гидроксихлорохин 400 мг в сутки, амоксициллин/сульбактам 4,5 г в сутки; антикоагулянтная терапия – далтепарин натрия 5000 ЕД в сутки. Динамика клинико-лабораторных данных представлена на рис. 2.
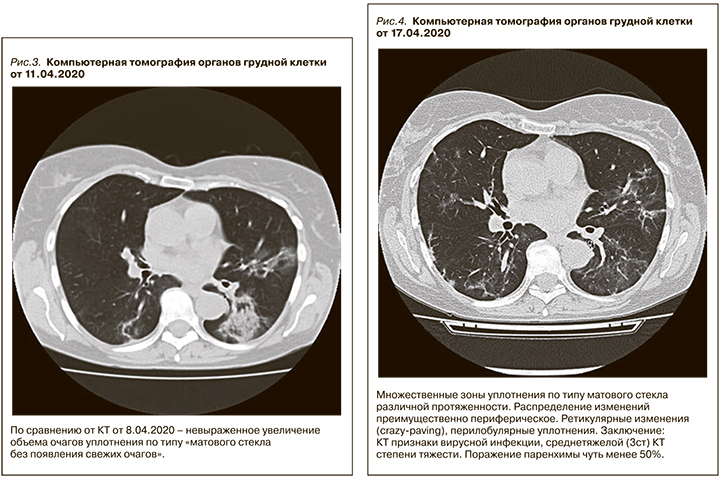
На фоне вышеуказанной терапии развилась дисфункция трансплантированной почки, сохранялась выраженная лихорадка, прогрессировала лейкопения/лимфопения, значительно выросла концентрация такролимуса в крови, несмотря на значительное снижение дозы такролимуса – более чем в 3 раза, наросла концентрация С-реактивного белка. Зарегистрирована отрицательная динамика при компьютерной томографии органов грудной клетки (рис. 3 и 4) Отмечено прогрессирующее снижение SpO2 c 97 до 86%, несмотря на высокопоточную оксигенотерапию, антибактериальную и антикоагулянтную терапию
Пациентке был отменен прием такролимуса до нормализации концентрации препарата в крови, несмотря на отмену лопинавира/ритонавира через 3 дня приема последнего. Проводился постоянный мониторинг концентраций такролимуса. Назначен тоцилизумаб в дозе 200 мг в сутки, затем в/в введение иммуноглобулинов G.
В результате проведенной терапии самочувствие пациентки улучшилось. Нормализовалась температура тела, прекратилась потребность в использовании кислорода. В отсутствие клинических признаков пневмонии, нормализации функции трансплантированной почки пациентка выписана на амбулаторное наблюдение в удовлетворительном состоянии.
Обсуждение
Реципиенты почечного аллотрансплантата нуждаются в постоянной пожизненной поддерживающей иммуносупрессивной терапии. Терапевтический мониторинг лекарственных средств – это необходимый и абсолютно обоснованный стандарт медицинской помощи, позволяющий балансировать эффективность и безопасность, т.е. предотвращать аллоиммунный ответ (отторжение) и только при умеренно повышенном риске инфекций одновременно предотвращать токсический эффект ингибиторов кальцийневрина. Поскольку на данный момент сведения о лечении новой коронавирусной COVID-19 у реципиентов трансплантата почки практически отсутствуют, справедливо предположить, что снижение поддерживающей иммуносупрессии может быть ключом к их лечению. Однако остается неясной степень снижения уровня иммунодепрессантов, необходимая для обеспечения сдерживания новой коронавирусной COVID-19. Посттрансплантационная иммуносупрессия, в частности, при применении ингибиторов кальцийневрина подавляют адаптивный Т-клеточный ответ в значительной степени и таким образом способствуют повышенному риску неконтролируемого вирусной инвазии. Основываясь на обобщенном опыте клинической практики, экстраполированной из протоколов других системных вирусных инфекций, можно предположить, что реципиенты трансплантата почки с легкой формой COVID-19 должны продолжать получать ингибиторы кальцийневрина и прежнюю дозу глюкокортикоидов, но препараты микофенолата мофетила или азатиоприн должны быть отменены. Полная отмена ингибиторов кальцийневрина в этих случаях может спровоцировать острое отторжение трансплантированной почки, вплоть до ее гибели. А экстренное выполнение трансплантатэктомии в условиях активного воспаления, вызванного вирусной инфекцией, несомненно представляет крайне высокий риск. В то же время у реципиентов почечного аллотрансплантата с тяжелым течением подтвержденной новой коронавирусной инфекции COVID-19, по своему клиническому статусу требующей госпитализации в отделение интенсивной терапии и искусственной вентиляции легких, ингибиторы кальцийневрина, так же как и микофенолат мофетил и азатиоприн, должны быть немедленно отменены, а дозы глюкокортикоидов, вероятно, должны быть увеличены […….].
Что же касается назначениz противовирусных препаратов реципиентfv почечного аллотрансплантата при новой коронавирусной инфекции, достоверных и обоснованных рекомендаций в настоящее время нет. Всемирная организация здравоохранения уже приступила к проведению исследований, которые будет тестировать четыре подхода к лечению COVID-19: ремдесивир; лопинавир–ритонавир; лопинавир–ритонавир с интерфероном-β1A; и хлорохин или гидроксихлорохин. Ремдесивир был разработан лечить болезнь, вызванную вирусом Эбола, и работает через блокаду РНК-зависимой РНК-полимеразы – ключевого вирусного фермента, в то время как лопинавир–ритонавир является комбинацией ингибиторов протеазы против ВИЧ. Первое исследование из Уханя, в котором сравнивали лопинавир–ритонавир со стандартной терапией, показало отрицательные результаты [6]. Представленный нами случай совпадает с выводами статьи. Применение лопинавир–ритонавира вызвало значительный рост концентрации такролимуса в крови с развитием нефротоксического эффекта, что потребовало временного прекращения применения такролимуса нашей пациенткой. При отмене лопинавира–ритонавира и исчезновении токсических проявлений прием такролимуса был возобновлен под контролем его концентрации в крови. Предполагается проведение исследований по применению лопинавира–ритонавира как монотерапии или в сочетании с интерфероном-β и хлорохином или гидроксихлорохин, которые по сути являются противомалярийными препаратами, но, как сообщалось, проявляют противовирусную активность в отношении SARS-CoV-2 in vitro [7]. Реципиенты трансплантированной почки не исключены из этого исследования, и можно надеяться, что в ближайшее время будут доступны достоверные данные о возможности и необходимости применения этих препаратов. Для оценки эффективности и безопасности перорального применения лопинавира–ритонавира инфицированных SARS-CoV-2 проведено рандомизированное контролируемое открытое исследование LOTUS China (Lopinavir Trial for suppression of SARS-Cov-2 in China) взрослых пациентов, госпитализированных с COVID-19. Несмотря на отсутствие убедительных доказательств эффективности гидроксихлорохина в сочетании с поддерживающей терапией лечения новой коронавирусной инфекции COVID-19, этот препарат был предложен как для лечения, так и в некоторых случаях для профилактики этой инфекции. Необходимы рандомизированные контролируемые исследования гидроксихлорохина на пациентах с COVID-19 [8].
Очень важно помнить, что некоторые из противовирусных препаратов проявляют значительные лекарственные взаимодействия, особенно с ингибиторами кальцийневрина, и необходимо будет тщательно контролировать уровень циклоспорина или такролимуса. И что, на наш взгляд, чрезвычайно важно и касается всех принимаемых терапевтических решений, необходимо учитывать индивидуальные особенности каждого отдельного пациента.
Следует ли назначать антицитокиновые препараты, такие как анти-IL-6 или ингибиторы комплемента, в настоящее время достоверно неизвестно. В описываемом нами случае мы, на наш взгляд, успешно применили препарат тоцилизумаб. Ранее имелись сообщения о том, что применение тоцилизумаба существенно улучшает прогноз выживания пациентов со средней или тяжелой формой пневмонии, вызванной новой коронавирусной инфекцией COVID-19 [9]. У пациентов в таком состоянии нередко возникает т.н. цитокиновый шторм – чрезмерная реакция иммунной системы, во время которой в избыточном количестве вырабатываются цитокины и атаке подвергаются здоровые клетки организма. В случае с коронавирусной инфекцией цитокиновый шторм может вызывать острую респираторную недостаточность, которая заканчивается смертью пациента [10]. Тоцилизумаб представляет собой иммунодепрессант, подавляющий цитокины ИЛ-6 из подкласса иммуноглобулинов IgG1. Препараты на его основе применяют взрослые при ревматоидном артрите со средней или высокой степенью активности как в виде монотерапии, так и в комбинации с противовоспалительными лекарствами. Активное вещество тоцилизумаб способно подавлять как растворимые, так и мембранные рецепторы ИЛ-6 (интерлейкин, который может действовать как рецептор цитокинов I типа). Как отмечают эксперты, на сегодняшний день нельзя исключить вероятность отрицательного воздействия тоцилизумаба на противоопухолевую и противоинфекционную защиту организма [11]. В ходе клинических исследований/доказана эффективность тоцилизумаба в отношении уменьшения субъективных и объективных признаков ревматоидного артрита. Эффект от такой терапии возникал на второй неделе, в дальнейшем усиливался и сохранялся более трех лет [12].
Тоцилизумаб, применяемый в лечении ревматоидного артрита, предложен во Временных методических рекомендациях по профилактике, диагностике и лечению новой коронавирусной инфекции COVID-19 МЗ РФ, опубликованных 28.04.2020, для упреждающей противовоспалительной терапии COVID-19 взрослых, но имеющий противопоказания к применяемой иммуносупрессивной терапии при трансплантации органов. Препараты на основе моноклональных антител, ингибирующие ИЛ-6, предназначены пациентам со среднетяжелым течением: острым респираторным дистресс-синдромом, тяжелым жизнеугрожающим синдромом высвобождения цитокинов [13].
В заключение следует отметить, что медицинские данные, касающиеся оптимальных подходов к лечению во время этой пандемии, в настоящее время только накапливаются и любые предложения, в т.ч. и обсуждаемые в настоящем комментарии, по-прежнему нуждаются в проверке в ходе будущих исследований.



