Впоследние десятилетия биологические исследования в психиатрии приобретают все большее значение по меньшей мере по двум причинам. Во-первых, в связи с попытками уточнения этиологии психических расстройств, в частности поиском биомаркеров шизофрении, и во-вторых, – с определением предикторов эффективности и переносимости психофармакотерапии [1–5]. В связи с этим несомненный интерес представляет эндокринологический подход к изучению больных с первым психотическим эпизодом (ППЭ) в процессе антипсихотической терапии (АПТ), что будет способствовать определению гормональных предикторов ее эффективности и переносимости и даст возможность минимизировать развитие нейроэндокринных побочных эффектов у указанного контингента. К настоящему времени в научной литературе имеется крайне мало исследований, освещающих эту проблему. Большинство из них связано с изучением у больных с ППЭ, получающих АПТ, таких гормональных показателей, как уровни пролактина, эстрадиола, тестостерона, прегненолона [6–8]. В отечественной литературе данных об изучении гормонов гипоталамо-гипофизарно-адреналовой оси (ГГАО) у вышеуказанного контингента больных явно недостаточно [9, 10]. В связи с этим представляется актуальным проведение исследований по изучению особенностей гормонального дисбаланса ГГАО у больных с ППЭ в процессе АПТ.
 Цель исследования состояла в оценке динамики уровней кортизола и дегидроэпиандростерона сульфата (ДГЭА-С) у больных с ППЭ в процессе терапии оланзапином в зависимости от гендерного фактора, тяжести психопатологической симптоматики и эффективности лечения.
Цель исследования состояла в оценке динамики уровней кортизола и дегидроэпиандростерона сульфата (ДГЭА-С) у больных с ППЭ в процессе терапии оланзапином в зависимости от гендерного фактора, тяжести психопатологической симптоматики и эффективности лечения.
Материал и методы
Объектом изучения (основная группа) послужили 33 пациента с ППЭ (16 женщин и 17 мужчин) в возрасте от 18 до 50 лет (средний возраст – 28,6±1,5 года) и длительностью заболевания, составившей в среднем 1,5 года, которым проведена монотерапия оланзапином в дозе 5–20 мг/сут (средняя суточная доза – 14,6±6,6 мг), инъекционно или в таблетированной форме. У всех больных была диагностирована параноидная шизофрения (F-20.0) в соответствии с критериями МКБ-10. Критериями включения в исследование стали: 1) возраст от 18 до 55 лет; 2) ППЭ – баллы по шкале PANSS >60; 3) верифицированный диагноз шизофрении в соответствии с Международной классификацией болезней 10-го пересмотра; 4) отсутствие органической патологии ЦНС; 5) отсутствие эндокринных, соматических и гинекологических заболеваний; 6) отсутствие беременности и лактации; 7) отсутствие предшествующей АПТ; 8) информированное согласие пациента на участие в исследовании. В качестве контрольной группы обследованы 34 психически и соматически здоровых лица (14 женщин и 20 мужчин), средний возраст которых составил 34,6±6,8 года.
В исследовании применялись клинико-психопатологический, биохимический и статистический методы исследования.
Пациенты обследовались динамически на определенных этапах терапевтического процесса: фон (1-й этап) – до назначения АПТ, 3–4-я неделя терапии (2-й этап) и 6–8-я неделя терапии (3-й этап).
На всех этапах работы оценка психического состояния больных производилась по валидизированной русскоязычной версии шкалы позитивных и негативных синдромов PANSS (Positive and Negative Syndrome Scale) [11]. Редукция общего балла по шкале PANSS более чем на 25% к 6-й неделе терапии оланзапином давала возможность регистрировать положительный результат и расценивать данных пациентов как респондеров (23 пациента). Все остальные больные регистрировались как нонреспондеры (10 человек). Сравнительный анализ изучаемых параметров проведен как между группами, так и внутри подгрупп основной группы с учетом гендерного фактора, тяжести психопатологической симптоматики и эффективности терапии.
Определение содержания кортизола и ДГЭА-С проводилось натощак в утренние часы в сыворотке крови иммуноферментным методом на фотометре вертикального сканирования Multiscan Agent («Labsystems», Финляндия) с использованием реактивов фирмы «АлкорБио». Референтные значения гормонов: кортизол – 150–660 нмоль/л; ДГЭА-С – мужчины 1,0–4,2, женщины 0,8–3,9 мгк/мл.
Статистическая обработка результатов осуществлена с использованием компьютерной статистической программы «Statistiсa», версия 7.0.
Результаты и обсуждение
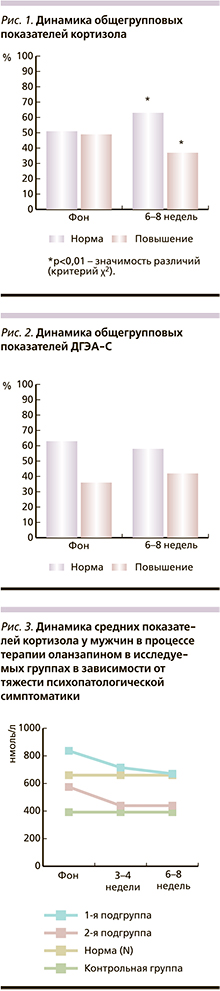
Динамика общегрупповых показателей кортизола и ДГЭА-С (%) представлена на рис. 1, 2.
Как следует из данных рис. 1, фоновое (до начала АПТ) процентное соотношение пациентов с нормативными и превышающими значениями уровня кортизола было сопоставимо (51,5 и 48,5% соответственно). К 6-8-й неделе терапии число пациентов с нормативными показателями уровня кортизола значимо (p <0,01) увеличилось (с 51,5 до 63,5%), причем нормализация уровня кортизола происходила в основном за счет больных мужского пола.
При анализе представленности пациентов с нормативными и повышенными уровнями ДГЭА-С до начала и по окончании терапии оланзапином (рис. 2) значимых изменений не выявлено. В то же время по сравнению с кортизолом отмечено значимо (p<0,01) большее число пациентов с нормативными показателями ДГЭА-С как до, так и после проведения курса АПТ.
В целях проведения анализа влияния тяжести психопатологического процесса на динамику уровней исследуемых гормонов основная группа больных была разделена на две подгруппы в зависимости от тяжести психопатологической симптоматики. Первую подгруппу (26 человек: 14 мужчин и 12 женщин) составили больные с выраженной психопатологической симптоматикой – бо'лее 80 баллов по шкале PANSS (в среднем – 93,16±7,5 балла). У 7 пациентов – 3 мужчин и 4 женщин (2-я подгруппа), имели место нерезко выраженные психопатологические нарушения – 68–79 баллов (в среднем – 76,5±5,07 балла). Анализ динамики уровней гормонов в подгруппах проведен с учетом гендерного фактора.
Сравнительный анализ динамики уровней кортизола и ДГЭА-С у мужчин (рис. 3, 4) в зависимости от тяжести психопатологической симптоматики показал, что у больных 1-й подгруппы имела место разнонаправленность изменений уровней гормонов: снижение показателей кортизола от этапа к этапу и, наоборот, повышение уровней ДГЭА-С. Показатели кортизола на всех этапах терапии превышали нормативные и значимо (p<0,01) превышали показатели в контрольной группе. Уровни ДГЭА-С превышали нормативные значения только на 2-м и 3-м этапах. У больных с менее выраженной симптоматикой (2-я подгруппа) отмечена сходная динамика гормонов: снижение их содержания к 3–4-й неделе, к окончанию терапии показатели оставались на том же уровне.
В отличие от 1-й подгруппы показатели кортизола на всех этапах исследования находились в нормативном диапазоне, а уровни ДГЭА-С превышали верхние границы нормы в процессе терапии. И те, и другие показатели значимо (p<0,01) превышали средние уровни гормонов контрольной группы.
У женщин с ППЭ с выраженной психопатологической симптоматикой динамика уровней кортизола носила волнообразный характер: повышение (выше нормативных значений) на 2-м этапе и снижение к окончанию терапии. При этом уровень ДГЭА-С снижался на всех этапах терапии, оставаясь в пределах нормы. Как и у мужчин, показатели кортизола и ДГЭА-С значимо (p<0,01) превышали уровни гормонов контрольной группы.
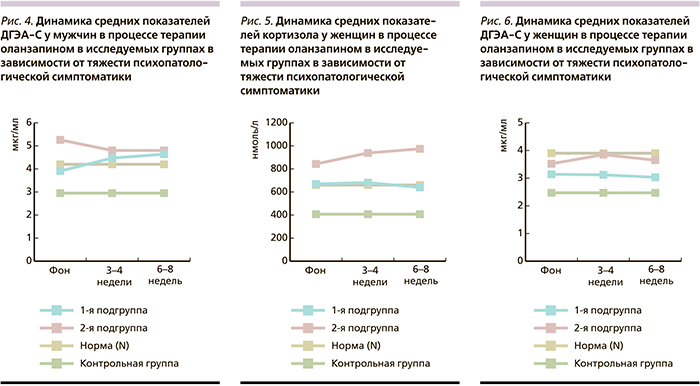
У пациенток с менее выраженной психопатологической симптоматикой (2-я подгруппа) средние показатели кортизола были выше нормативных значений на всех этапах терапии и наблюдалось значимое (р<0,01) их повышение от этапа к этапу. Динамика уровней ДГЭА-С была сходной лишь на 2-м этапе терапии (значимое [р<0,01] повышение), а к концу АПТ наблюдалось снижение уровня гормона. Наличие самого высокого показателя уровня кортизола у пациенток 2-й подгруппы (938,2±223,3 нмоль/л – выше нормы) на 2-м этапе исследования и повышение в ответ ДГЭА-С (3,85±1,07 мгк/мл) подтверждают важную роль ДГЭА-С для компенсации нейротоксического воздействия кортизола на мозг.
Результаты проведенного анализа позволяют предположить, что у пациентов с ППЭ выявляется повышенная активность ГГАО. Экзацербация психопатологического процесса сопровождается значимым (p<0,01) повышением среднего общегруппового уровня кортизола, который в процессе терапии постепенно снижается на фоне менее выраженных изменений со стороны ДГЭА-С. Вместе с тем анализ показателей гормонов в зависимости от выраженности психопатологической симптоматики с учетом гендерного фактора не позволил выявить прямую зависимость между тяжестью расстройств и уровнями гормонов. По всей вероятности, это связано с недостаточным количеством обследованных больных. Получены данные о прямой корреляционной зависимости (r=0,72; p<0,03) между уровнями кортизола и ДГЭА-С, т.е. повышение уровня кортизола сопровождалось повышением уровня ДГЭА-С. Это состояние ГГАО свидетельствует о нейропротективной функции ДГЭА-С с точки зрения компенсации нейротоксического воздействия на мозг кортизола у больных с ППЭ. Результаты нашего исследования согласуются с данными, полученными в ряде научных работ [12–15].
Динамика уровней кортизола и ДГЭА-С у больных с ППЭ в зависимости от эффективности терапии представлена на рис. 5–8.
Как видно из рис. 7 и 8, динамика уровней кортизола у мужчин-респондеров (R) характеризовалась снижением показателей от этапа к этапу. У нонреспондеров (NR) динамика уровней кортизола была иной: на 2-м этапе терапии уровень кортизола достоверно снижался по сравнению с фоном (p<0,03) до нормативных пределов, а на 3-м этапе отмечалось его повышение. Обращает на себя внимание, что у мужчин-NR отмечается самый высокий фоновый уровень кортизола.
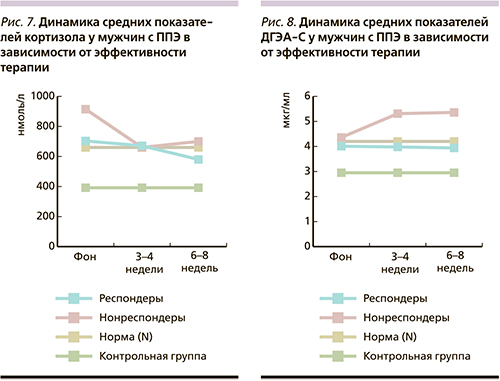
Выявленная достоверная положительная корреляционная связь между уровнями кортизола на 2-м и 3-м этапах терапии (r=0,78; p<0,036) у NR может свидетельствовать о том, что снижение уровней гормона на 2-м этапе АПТ приводит к его повышению по окончании терапии, что в свою очередь косвенным образом подтверждает неустойчивость состояния ГГАО у больных с ППЭ в отсутствие положительной терапевтической динамики. Изменения ДГЭА-С у мужчин-Р были сопоставимыми с динамикой показателей кортизола (снижение от этапа к этапу в нормативных пределах). Интерес представляет динамика уровней ДГЭА-С у мужчин-NR: при снижении уровней кортизола отмечается повышение ДГЭА-С, причем на 2-м и 3-м этапах оба показателя превышают нормативные. Найденная достоверная отрицательная корреляционная взаимосвязь между фоновыми значениями кортизола и ДГЭА-С (r=-0,75; p<0,05) может свидетельствовать о том, что у больных-NR отмечается патологическое функционирование ГГАО, что в свою очередь может служить гормональным биомаркером отсутствия положительной терапевтической динамики.
У респондеров и нонреспондеров женского пола с ППЭ (рис. 9, 10) не найдено различий в динамике уровней кортизола – повышение показателей на 2-м этапе и снижение к 6–8-й неделе терапии. Вместе с тем у респондеров этой группы средние показатели уровней кортизола превышали нормативные значения на всех этапах исследования, тогда как у нонреспондеров все изменения происходили в референтных пределах. Динамика уровней ДГЭА-С у женщин-R основной группы была сопоставимой с динамикой уровней кортизола – повышение значений на 2-м этапе и снижение к концу терапии. У нонреспондеров превышение уровней ДГЭА-С отмечено только к концу терапии на фоне снижения уровней кортизола. В связи с малочисленностью группы нонреспондеров анализ достоверности различий между респондерами и нонреспондерами провести не удалось. В то же время следует обратить внимание на более гармоничную в физиологическом плане сочетанную динамику обоих гормонов у пациенток- R.
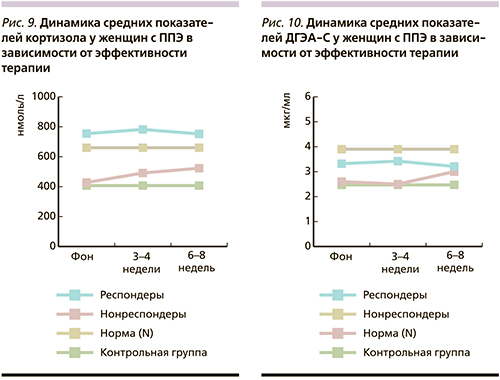
Таким образом, полученные нами данные свидетельствуют о вовлеченности ГГАО в патофизиологические и терапевтические процессы у больных с ППЭ и в целом согласуются с результатами отдельных исследований [16, 17]. Определенная роль в этих процессах принадлежит гендерному фактору, тяжести психопатологической симптоматики и различиям в эффективности АПТ.
Выводы
- Повышенный средний фоновый показатель кортизола у пациентов мужского и женского пола с ППЭ по сравнению с контрольной группой здоровых испытуемых (p<0,001 и <0,01) свидетельствует о гиперактивности ГГАО.
- Наличие самого высокого показателя кортизола у пациенток с ППЭ с нерезко выраженными психопатологическими нарушениями на 2-м этапе исследования и повышение в ответ уровня ДГЭА-С подтверждают его важную роль в плане компенсации нейротоксического воздействия кортизола на мозг.
- Гормональными предикторами (биомаркерами) эффективности терапии больных с ППЭ оланзапином служат повышение показателей кортизола и ДГЭА-С у женщин и их снижение у мужчин к 3–4-й неделе АПТ:
- гармоничность динамических изменений уровней кортизола и ДГЭА-С в процессе АПТ;
- отсутствие фоновой отрицательной корреляционной связи между кортизолом и ДГЭА-С у мужчин.



