Введение
Антипсихотические препараты составляют одну из главных групп психофармакотерапевтических средств и занимают центральное место в современной психиатрической практике [6]. Следует отметить, что основное внимание исследователей и практических врачей долгое время было направлено на изучение эффективности применяемых антипсихотических средств в отношении психопатологической симптоматики. Так, при купирующей психофармакотерапии учитывалась симптомоспецифичность антипсихотических препаратов (влияние на галлюцинаторно-бредовую симптоматику, возбуждение, антидепрессивное действие и т.д.). При длительной противорецидивной терапии одной из основных оценок эффективности оказалось отсутствие рецидивов психического заболевания. Значительно меньше внимания уделялось изучению переносимости антипсихотиков (АП) – побочным эффектам и осложнениям (экстрапирамидным двигательным расстройствам, нейроэндокринным дисфункциям – НЭД, токсическому эффекту и др.). За последние десятилетия в связи с современными требованиями к проведению психофармакотерапии, а также с появлением АП нового поколения изменились основные параметры оценки оптимального результата лечения, среди которых наряду с эффективностью все большее значение приобретают параметры переносимости [1, 4, 6]. Необходимо подчеркнуть, что исследование и решение проблемы переносимости (побочных эффектов в целом и НЭД в частности) АП – одна из важных задач на современном этапе оптимизации терапии психических больных.
Анализ результатов эпидемиологических и клинических исследований свидетельствует о высокой распространенности НЭД среди больных шизофренией при проведении антипсихотической терапии (АПТ), которая составляет от 3 до 100% [3, 5, 6, 10, 12, 14]. По данным ряда исследований, частота встречаемости синдрома нейролептической гиперпролактинемии (СНГП) при проведении АПТ в целом колеблется в пределах 4–95%, причем у женщин репродуктивного возраста эти показатели составляют 42–93%, у мужчин – 42–47%, при этом распространенность метаболических нарушений (МН) варьируется в пределах 6,7–92% [2, 4, 7–9, 13, 15, 21, 22]. Обращает на себя внимание большой разброс приводимых показателей, что, на наш взгляд, можно объяснить рядом причин, к которым относятся разнородность и выборочный характер исследуемого клинического материала; недостаточность изучаемых выборок; отсутствие учета возрастных, антропометрических, временных, фармакогенных и других факторов; игнорирование современных требований к популяционным и эпидемиологическим исследованиям и т.д. В то же время следует подчеркнуть, что, по данным S. Madhusoodanan и соавт. (2010), распространенность, в частности, СНГП недооценена, особенно в отношении АП первого поколения (АПП), таких как галоперидол, хлорпромазин, тиоридазин и др. Авторы подчеркивают, что это вызвано трудностями диагностики бессимптомной СНГП, нежеланием пациентов сообщать о симптомах, которым они не придают значения или которые их смущают (в частности, сексуальным расстройствам), и низкой осведомленностью со стороны врачей в отношении различных аспектов СНГП. На протяжении двух последних десятилетий появилось значительное количество публикаций, касающихся исследований частоты встречаемости тех или иных НЭД при терапии АП второго поколения (АВП) [2, 3, 7, 10, 19]. Вместе с тем в доступной литературе отсутствуют данные о частоте формирования НЭД при проведении терапии двумя и более АП, а также при сочетанном применении АП и антидепрессантов (АД).

Таким образом, исходя из приводимой в литературе информации, актуальным представляется изучение частоты и особенностей формирования НЭД у больных шизофренией при различных вариантах длительной АПТ в амбулаторных условиях. В первую очередь это связано с тем обстоятельством, что НЭД, являясь одним из показателей переносимости АПТ, значительно ухудшают качество жизни и социальное функционирование больных шизофренией. Кроме того, реальная оценка распространенности НЭД позволит разработать и внедрить в психиатрическую практику более четкие стратегии в отношении профилактики, диагностики и коррекции этой патологии.
Целью настоящего исследования было изучение частоты встречаемости и особенностей клинических характеристик НЭД у больных параноидной шизофренией в процессе длительной АПТ в условиях амбулаторной практики.
Материал, методы и дизайн исследования
Для оценки частоты встречаемости НЭД были обследованы 122 пациента с верифицированным диагнозом «параноидная шизофрения» (F-20), согласно международной классификации болезней 10-го пересмотра. В их число входили 26 (21,3%) мужчин и 96 (78,7%) женщин в возрасте от 16 до 55 лет. Средний возраст пациентов в целом составил 30,2±1,8 года (мужчины – 32,0±2,6 года; женщины – 28,5±3,7). Все пациенты находились под динамическим амбулаторным наблюдением в 22 психоневрологических диспансерах Москвы.

Критерии включения в исследование: возраст от 16 до 55 лет; отсутствие органических заболеваний ЦНС, эндокринных заболеваний, тяжелых форм соматических и гинекологических заболеваний, беременности и лактации; длительная (не менее 6 месяцев) терапия антипсихотическими препаратами; наличие информированного согласия пациента на участие в исследовании. Соответствующие установленным критериям больные направлялись в отдел психиатрической эндокринологии МНИИП – филиала ФГБУ ФМИЦПН им. В.П. Сербского Минздрава России для проведения исследования уровня пролактина и консультации психоэндокринолога.
Клинико-эндокринологическое исследование проводилось с использованием специальной ранжированной карты обследования больных. Определение уровня содержания пролактина проводилось иммуноферментным методом на фотометре вертикального сканирования Multiscan Agent («Labsystems», Финляндия) с использованием реактивов фирмы «АлкорБио». Нормативные показатели пролактина: для женщин – 70–700 мМЕ/л; для мужчин – 50–500 мМЕ/л.
Статистическая обработка полученных данных осуществлена с использованием компьютерной программы Statistica 7 с вычислением средних значений, стандартного отклонения от среднего, критерия Вилкоксона, критерия Манна–Уитни, критерия χ2.
Результаты и обсуждение
Из 122 больных, составивших исследуемую выборку, 41 (33,6%) пациент находился на долечивании, 81 (66,4%) получал поддерживающую противорецидивную терапию. АПТ больных включала: АПП – трифлуоперазин, галоперидол, перфеназин, зуклопентиксол, флуфеназин; АВП – рисперидон, рисперидон конста, палиперидон, палиперидона пальмитат, сертиндол, амисульприд, клозапин, кветиапин, оланзапин. Препараты назначались как в виде монотерапии, так и в сочетанном виде – т.н. полипрагмазия (ПП). Кроме того, в ряде случаев в качестве аугментации больные получали АД – пароксетин, флувоксамин, миртазапин, эсциталопрам, кломипрамин и амитриптилин. В дальнейшем для анализа влияния различных вариантов АПТ на формирование НЭД было сформировано 4 группы: 1-я (21 пациент; 17,2%) – терапия АПП; 2-я (60 пациентов; 49,18%) – терапия АВП; 3-я (14 пациентов; 11,47%) – терапия ПП и 4-я группа (27 пациентов; 22,13%) – сочетание АП и АД (АП+АД).
В целом НЭД были выявлены у 115 пациентов, что составило 94,3% от общей выборки. Были диагностированы следующие виды патологии: микропролактинома – 1 пациент, ожирение (индекс массы тела >30,0 кг/м2) – 9, избыточная масса тела (индекс массы тела 25–29,9 кг/м2) – 10, СНГП – 95; у 7 пациентов НЭД отсутствовали.
Частота формирования НЭД у исследованных больных в зависимости от вариантов терапии варьировалась от 90,5 до 100% (рис. 1). Значимо (p<0,01) чаще НЭД формировались у больных параноидной шизофренией при назначении ПП (3-я группа) и сочетании АП и АД (4-я группа) – в 100% случаев по сравнению с 1-й (АПП) и 2-й (АВП) группами, где частота встречаемости НЭД составила 90,5 и 93,3% соответственно. Полученные данные в отношении развития НЭД при терапии АПП и АВП в целом согласуются с данными научной литературы [6, 20, 21], но отличаются от полученных нами в предыдущих исследованиях данных в отношении АВП, при применении которых частота НЭД составила от 56,4 до 61,8% [3, 4]. Это связано в первую очередь с тем фактом, что в указанных работах проводилось изучение монотерапии различными АВП, а в данном исследовании столь четкого разграничения по применяемой терапии провести не представлялось возможным в связи с недостаточным числом больных, получавших идентичную терапию. Сравнить полученные нами данные по частоте развития НЭД при ПП и сочетанном применении АП и АД с результатами других исследований не удалось, т.к. в доступной литературе подобная информация отсутствует.
Исходя из особенностей клинических проявлений НЭД, можно выделить два основных симптомокомплекса: СНГП и МН. Как следует из рис. 1, различные варианты терапии ассоциируются с разной представленностью указанных симптомокомплексов. Значимо (p<0,01) чаще СНГП формируется в процессе терапии ПП (84,4%) по сравнению с другими вариантами лечения. МН значимо (p<0,01) чаще развиваются при сочетанном применении АП и АД (35%). Вместе с тем следует отметить, что при всех выделенных нами вариантах АПТ частота встречаемости СНГП достаточно высока и значимо (p<0,01) превышает частоту МН, что безусловно требует повышенного внимания к разработке стандартов диагностики и коррекции СНГП. Полученные нами результаты в отношение формирования МН в определенной степени отличаются от литературных. В большинстве исследований частота встречаемости МН при терапии АПП составляет от 6,7 до 62%, при терапии АВП – от 40 до 92% [2, 7, 10, 14, 21, 22]. Одним из возможных объяснений этого факта может быть то обстоятельство, что практические врачи, участвовавшие в данном исследовании, более избирательно направляли на обследование больных с клиническими проявлениями СНГП, несмотря на то что это не являлось критерием включения в исследование.
Анализ частоты встречаемости НЭД с учетом гендерного фактора внутри групп показал, что только у женщин 1-й группы (АПП) НЭД формируются значимо (p<0,01) чаще по сравнению с мужчинами. В остальных группах встречаемость НЭД у мужчин и женщин не имели различий (табл. 1).
Формирование СНГП значимо (p<0,01) чаще происходило у женщин и мужчин при терапии ПП (3-я группа) по сравнению с другими вариантами лечения. Значимых (p<0,01) различий в частоте формирования синдрома у мужчин 1-й, 2-й и 3-й групп выявлено не было. При терапии АП+АД СНГП у женщин формировалось значимо (p<0,01) чаще по сравнению с мужчинами. МН значимо (p<0,01) чаще отмечалось у мужчин 4-й группы по сравнению с больными мужского пола других групп и по сравнению с женщинами при терапии АП+АД. Среди пациенток 1-й и 4-й групп частота развития МН значимо (p <0,01) превышала таковую при терапии АВП и ПП. Полученные данные по роли гендерного фактора в формировании НЭД согласуются с данными литературы [11, 20].
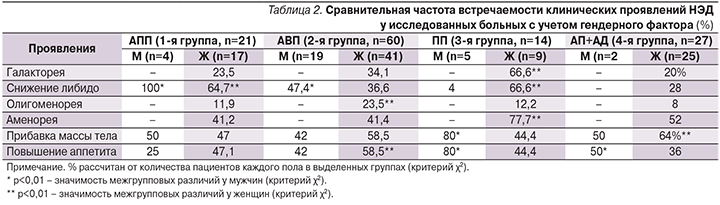
Структура выделенных симптомокомплексов характеризуется следующими клиническими проявлениями: СНГП – нарушения менструального цикла в виде аменореи и олигоменореи, галакторея, снижение либидо; МН – повышение аппетита и прибавка массы тела.
Сравнительная частота клинических проявлений НЭД у исследованных больных с учетом гендерного фактора представлена в табл. 2.
Галакторея в данном исследовании выявлена только у пациенток и значимо (p<0,01) чаще представлена у женщин при терапии ПП. Нарушения менструального цикла в виде аменореи также значимо (p<0,01) чаще наблюдались у пациенток с данным вариантом терапии. Частота формирования олигоменореи была невысокой при всех видах терапии, однако значимо (p<0,01) чаще представлена у женщин при терапии АВП. Сексуальные дисфункции в виде снижения либидо значимо (p<0,01) чаще развивались у мужчин при терапии АПП и АВП по сравнению с пациентами, получавшими ПП, и отсутствовали у мужчин 4-й группы (АП+АД). У женщин снижение либидо отмечено при всех вариантах терапии, но значимо (p<0,01) чаще при назначении АПП и ПП.
МН в виде прибавки массы тела встречаются с равной частотой у мужчин и женщин при терапии АПП и АВП. В 3-й группе частота этого нарушения (p<0,01) преобладает у мужчин, в 4-й группе – у женщин. Значимо (p<0,01) чаще прибавка массы тела сопровождается повышением аппетита у женщин при терапии АВП, у мужчин – при терапии АП+АД.
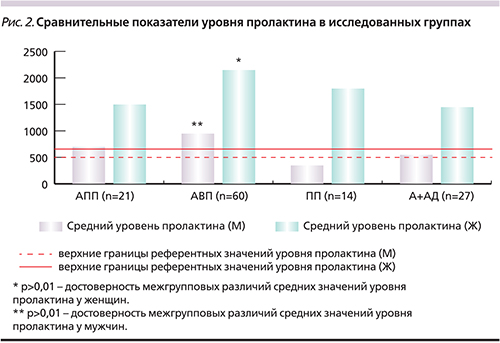
Как было указано выше, всем пациентам было проведено исследование уровня пролактина. Повышение его содержания наблюдалось у 96 (83,6%) пациентов с НЭД. Результаты данного раздела исследования приведены на рис. 2.
Средние значения уровня пролактина у женщин превышали верхние референтные его показатели при всех вариантах терапии, при этом самые высокие концентрации пролактина отмечались в группе АВП (значимые [p<0,01] различия по сравнению с показателями 1-й, 3-й и 4–й групп). У мужчин средние значения уровня пролактина превышали нормативные показатели при терапии АПП, АВП и АП+АД. Так же как и у женщин, значимые (p<0,01) различия показателей гормона у мужчин отмечались в группе АВП по сравнению с другими вариантами терапии.
Таким образом, структурные характеристики НЭД при различных вариантах АПТ у больных параноидной шизофренией, а также их частота, спектр клинических проявлений и содержание пролактина в сыворотке крови имели как сходство, так и ряд различий. В целом НЭД значимо (p<0,01) чаще развиваются при назначении 2 и более АП и сочетанном применении АП и АД. Анализ частоты различных симптомокомплексов НЭД показал, что при всех видах терапии преобладал СНГП, значимо (p<0,01) чаще представленный при терапии ПП. Исследование уровней пролактина у больных параноидной шизофренией продемонстрировало высокую частоту развития гиперпролактинемии при длительном применении различных вариантов терапии. Кроме того, было показано, что спектр клинических проявлений НЭД у женщин более широк (за счет представленности галактореи и нарушений менструального цикла) по сравнению с пациентами-мужчинами. Несмотря на то что проведенное исследование не предполагало строгих критериев, предъявляемых к эпидемиологическим исследованиям, полученные результаты убедительно продемонстрировали высокую частоту встречаемости НЭД у больных параноидной шизофренией при длительной терапии в амбулаторных условиях. Несомненный интерес представляют данные о плохой переносимости (высокой частоте формирования НЭД) при полипрагмазии и сочетанном применении АП и АД, что дает основание рекомендовать практическим врачам избегать указанных терапевтических подходов с целью улучшения качества жизни и комплаентности больных. Высокая распространенность СНГП у пациентов с шизофренией при длительной антипсихотической терапии подтверждает необходимость разработки стандартов профилактики, диагностики и методов коррекции указанного симптомокомплекса.



