Введение
Кожа является крупнейшим органом человека, в котором постоянно происходят процессы деления, миграции и трансформации кератиноцитов. В результате формируется главный защитный слой кожи человека – роговой, клетки которого содержат специ-фический белок кератин, придающий ей прочность.
Кератинизазия является сложно регулируемым процессом, в котором принимают участие более 54 генов. В ходе этого процесса кератиноциты почти в 30 раз увеличиваются в размерах, уплощаются, в них постепенно конденсируется ядро, а в цитоплазме накапливается кератогиалин. При переходе от зернистого слоя к роговому кератиноциты вступают в путь ороговения, при котором клетка становится безъядерной и образуются ферментативные поперечные связи между структурными белками, такими как филаггрин, инволюкрин, лорикрин. Филаггрин является ключевым белком, участвующим в дифференцировке клеток эпидермиса и осуществлении его барьерной функции. Он образуется в ходе окончательной дифференцировки зернистых клеток эпидермиса, когда профилаггрин кератогиалиновых гранул протеолитически разрезается на молекулы филаггрина, состоящие из 324 аминокислот. Филаггрин быстро агрегирует с кератиновым цитоскелетом, что приводит к коллапсу зернистых клеток. На этой стадии липидная оболочка экструдируется в межклеточное пространство из пластинчатых тел с образованием липидных слоев, состоящих из церамидов, холестерина и свободных жирных кислот. Этот процесс приводит к образованию богатого липидами рогового слоя, состоящего в основном из корнеоцитов, которые представляют собой плоские, полиэдрические безъядерные клетки.
В результате нарушения процесса ороговевания возникает множество различных патологических состояний, одним из которых является ихтиоз.
Ихтиоз – гетерогенная группа заболеваний, для которой характерно генерализованное нарушение кератинизации, приводящее к снижению барьерной функции кожи и повышению трансэпидермальной потери воды. Частота встречаемости, равно как и степень тяжести различных форм врожденного ихтиоза варьируется в широком диапазоне – от распространенных легких форм вульгарного ихтиоза, составляющих 1:250–300 в общей популяции, до крайне редких и тяжелых форм аутосомно-рецессивного ихтиоза, встречающихся с частотой 1:100–300 тыс. человек [1, 2].
Врожденный ихтиоз
Классифицировать ихтиозы с учетом их значительной молекулярно-генетической, патогенетической и клиничесой гетерогенности затруднительно. В 2009 г. проведена Первая Международная консенсусная конференция по ихтиозу, результатом которой стала действующая в настоящее время классификация врожденного ихтиоза [3]. Согласно этой классификации, все врожденные ихтиозы подразделяются на несиндромальные и синдромальные формы (рис. 1).
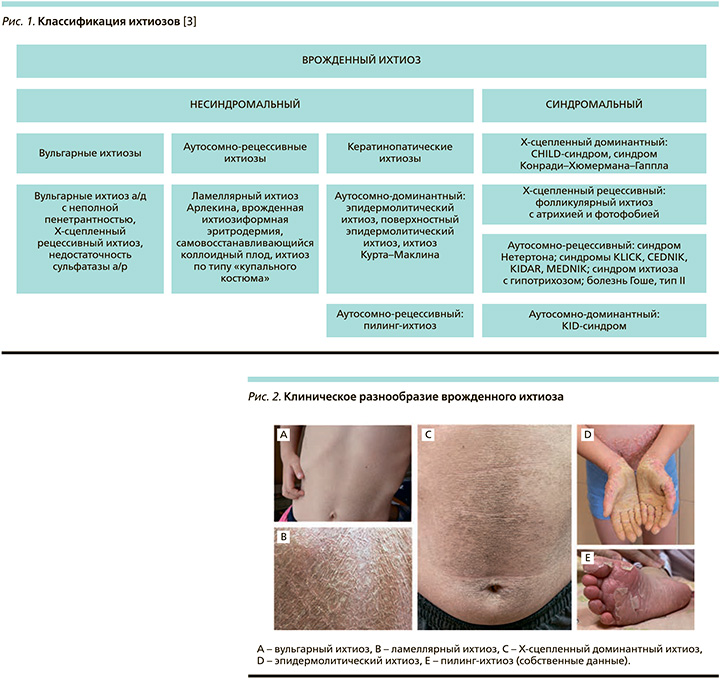
В основе развития врожденного ихтиоза лежат многочисленные мутации более чем 50 генов, что придает болезни чрезвычайную клиническую вариабельность, порой затрудняющую диагностику (рис. 2).
Клиническая картина
Однако, несмотря на различную генетическую основу заболевания, общим для всех форм ихтиоза является наличие генерализованного шелушения, гиперкератоза и различной выраженности воспаления кожи, проявляющегося в виде вариабельной эритродермии [4, 5]. Также частыми симптомами является наличие коллодиевой мембраны при рождении и эктропиона (рис. 3).
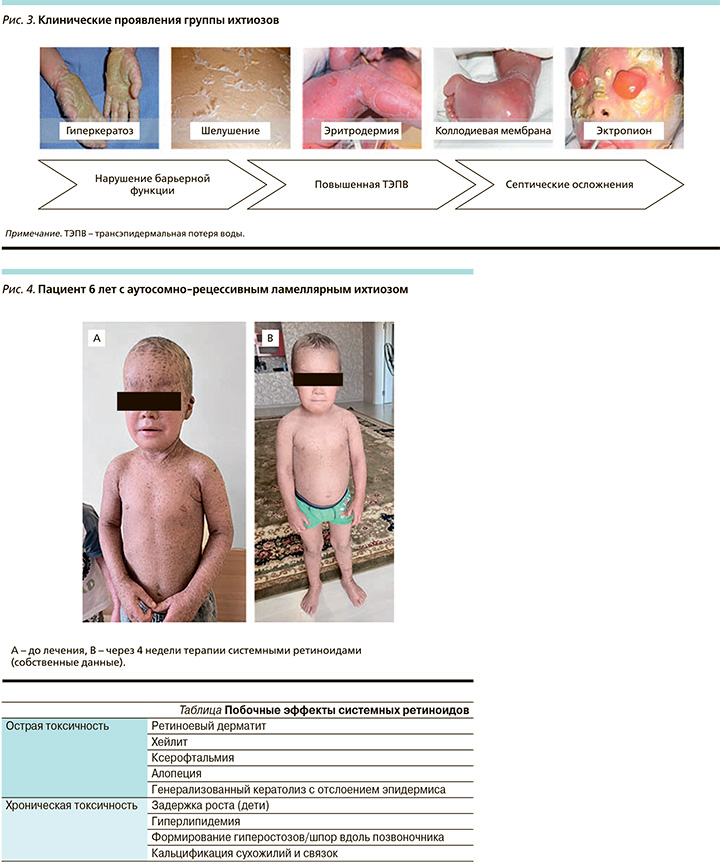
Ихтиоз значительно ухудшает качество жизни пациента и всей его семьи. Проведенные исследования показали, что у детей показатели качества жизни были значительно хуже, чем у взрослых. Большинство, если не все, пациенты с ихтиозом имеют депрессию и тревожное расстройство из-за обезображивания внешности и функциональных ограничений [6]. Они ежедневно сталкиваются с домогательствами, дискриминацией и страдают от неприятных кожных симптомов, таких как боль, зуд и стянутость кожи [7, 8].
Лечение ихтиоза
Способов полностью излечить пациента с ихтиозом на данном уровне развития медицины не существует. До недавнего времени подходы к терапии ихтиозов ограничивались симптоматическими средствами, в основную задачу которых входили уменьшение сухости и шелушения кожи, увлажнение и смягчение рогового слоя, ограничение избыточной трансэпидермальной потери воды, контроль воспаления и зуда кожи. С этой целью применяются лечебные ванны, различные кератолитические наружные средства, местные ретиноиды или средства, содержащие кальципотриол, а также увлажняющие и смягчающие средства. Эффективность этих методов лечения умеренная и обычно не эффективна при воспалении кожи.
Революционный переворот в лечении ихтиозов произошел после введения в терапию системных ретиноидов, которые, являясь аналогами витамина А, избирательно связываются со специфическими субъединицами ядерных рецепторов ретиноевой кислоты, модулируют созревание эпидермиса и дифференцировку кератиноцитов, тем самым уменьшая гиперкератоз и шелушение, при этом не влияя на воспаление и эритродермию [9]. Показанием к назначению системных ретиноидов являются формы ихтиоза, преимущественно аутосомно-рецессивные, сопровождающиеся выраженным диффузным шелушением и гиперкератозом, которые недостаточно отвечают на местную терапию (рис. 4).
Недостатком данной терапии является отсутствие воздействия на воспаление и наличие острой и хронической токсичности (см. таблицу) [10].
К острым побочным эффектам относится усиление ксероза, появление хейлита и ксерофтальмии, алопеции, но они обратимы после прекращения терапии. Редко сообщалось об изменении текстуры волос с появлением вьющихся волос, которое может быть необратимым. При эпидермолитическом ихтиозе высокие дозы ретиноидов вызывают генерализованный кератолиз с образованием булл и массивное отслоение эпидермиса. Длительное применение ретиноидов сопровождается развитием хронической токсичности, проявляющейся в основном в виде формирования гиперостозов или шпор вдоль позвоночника (обычно передней связки позвоночника), кальцификации сухожилий и связок. Поскольку ретиноиды могут воздействовать на растущие кости, в т.ч. на эпифизарное сращение, при раннем начале лечения возможна задержка роста, поэтому их применение следует отсрочить, насколько это возможно. Таким образом, становится очевидной необходимость иных патогенетических подходов к терапии ихтиозов, позволяющих воздействовать не только на нарушение дифференцировки эпидермиса, но и на воспаление.
В последние несколько лет были достигнуты большие успехи в понимании патофизиологии ихтиоза, а недавние открытия, касающиеся иммунного профиля пациентов с ихтиозом, дали основание для перепрофилирования биологических препаратов. Так, было выявлено, что цитокиновый профиль пациентов с тяжелыми аутосомно-рецессивными формами ихтиоза напоминает таковой при псориазе и проявляется преобладанием фактора некроза опухоли-α (ФНО-α)/T-хелперов (Th)-17 типа с высокой экспрессией интерлейкина-23 (ИЛ-23), -22 и -17, коррелирующей с выраженностью воспаления и трансэпидермальной потерей воды [11–13]. Следовательно, целевое воздействие на ось ИЛ-17/-23 является рациональным вариантом лечения ихтиоза (рис. 5)
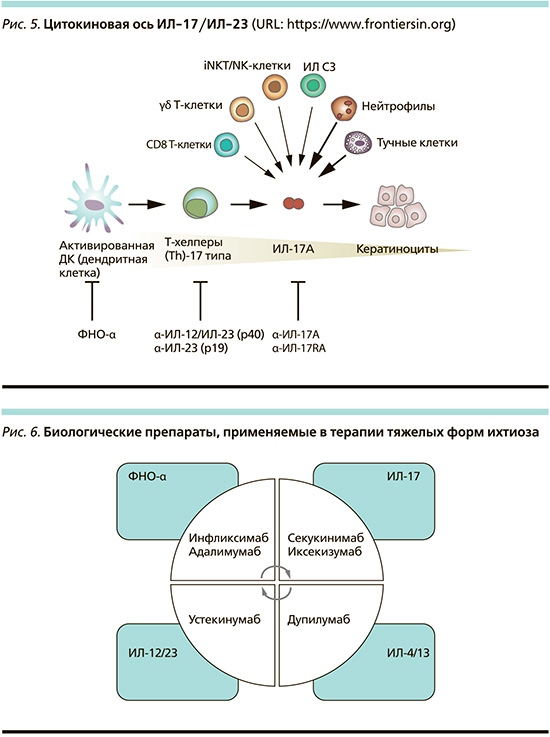
Это позволило перепрофилировать таргетную терапию псориаза для лечения таких форм ихтиоза, как аутосомно-рецессивный врожденный ихтиоз, кератинопатический ихтиоз и синдром Нетертона [14]. В настоящее время применяется несколько препаратов (рис. 6).
Наиболее часто применяется препарат секукинумаб, являющийся рекомбинантным человеческим моноклональным антителом, нацеленным на цитокин ИЛ-17A. При его длительном применении отмечается заметное улучшение у некоторых, но не у всех пациентов с синдромом Нетертона (рис. 7), врожденной ихтиозиформной эритродермией и ламеллярным ихтиозом [15].
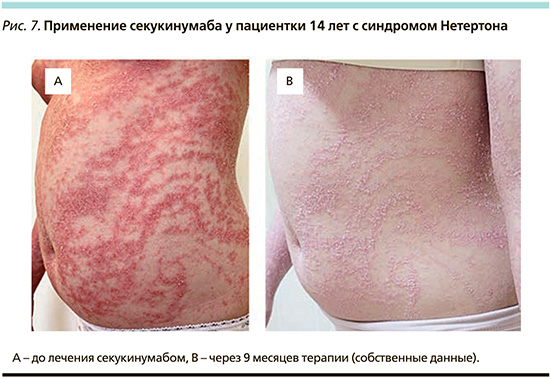
Аналогичный эффект описан и у препарата устекинумаб, косвенно ингибирущего ИЛ-17 путем воздействия на ИЛ-12/-23 [16, 17]. Также в нескольких клинических случаях описаны результаты применения при тяжелых формах ихтиоза иксекизумаба [18], инфликсимаба [19] и дупилумаба [20, 21], но эффект был незначительный и кратковременный.
Заключение
Таким образом, использование биологической терапии может быть полезным при лечении наиболее тяжелых аутосомно-рецессивных подтипов ихтиоза. Однако ответ в основном проявляется в уменьшении воспалительного компонента и зуда, не влияя на гиперкератоз и шелушение. Несмотря на многообещающие результаты, биологическая терапия ихтиозов требует продолжения научных поисков.
Тяжесть и неудовлетворительный эффект от существующих методов лечения заставляют продолжать поиски более эффективного лечения.
В последнее время исследования молекулярной генетики значительно продвинулись вперед, что привело к идентификации новых причинных генов и молекул, лежащих в основе болезни. Получение информации о генетических дефектах и выяснение патомеханизмов ихтиоза важны для возможности разработки новых методов лечения, таких как применение малых молекул, заместительной терапии ферментами и генной терапии [22].
Ихтиоз значительно ухудшает качество жизни пациентов, особенно детей. Дальнейшие исследования и усилия должны быть предприняты для поиска средств, одновременно виляющих на воспаление и нарушение дифференцировки эпидермиса.



