Нозокомиальная пневмония (НП) – одна из наиболее частых инфекций в стационаре и самой частой у больных отделений реанимации и интенсивной терапии (ОРИТ). Клинические последствия НП значимы, особенно для больных, находящихся на искусственной вентиляции легких (ИВЛ). НП, связанная с ИВЛ (НПивл), в настоящее время служит ведущей причиной смертности больных в ОРИТ, при этом цифры атрибутивной летальности достаточно высоки – от 25 до 70% [1–3].
НП и НПивл составляют около 15% от всех инфекций в ЛПУ, вызванных оказанием медицинской помощи, и 25% от инфекций в ОРИТ [4]. Среди факторов риска развития НПивл выделяют длительность ИВЛ, реинтубацию, профилактическое применение антибиотиков, тяжесть состояния больного, сопутствующие заболевания дыхательной системы, ожоги, травмы, острый респираторный дистресс-синдром и др. [1].
По данным российского многоцентрового исследования ЭРГИНИ, проведенного в 2013 г. в 32 стационарах 18 городов РФ [5], распространенность нозокомиальных инфекций в ЛПУ составила в среднем 7,61% (95% ДИ – 6,81; 8,50%), при этом наиболее частой локализацией были нижние дыхательные пути – 39,6% (НП – 20,5%, НПивл – 12,6%, трахеобронхит – 6,5%). В ОРИТ распространенность нозокомиальных инфекций была наибольшей среди разных отделений ЛПУ – 27,6%, причем половина из них была связана с нижними дыхательными путями; наиболее частыми инфекциями в ОРИТ были НПивл (25,0%) и НП (20,2%).
Возбудители НП и НПивл могут быть эндогенного происхождения – главным образом кишечная микрофлора человека (Escherichia coli, Klebsiella spp., Enterobacter spp., другие энтеробактерии), а также экзогенного в результате переноса от других пациентов, с рук медперсонала; из окружающей среды (наиболее характерно для стафилококков, синегнойной палочки, ацинетобактерий). Нозокомиальные штаммы микроорганизмов в ОРИТ традиционно характеризуются множественной устойчивостью к антибактериальным препаратам (АБП) Escherichia, что затрудняет выбор адекватного режима терапии. Проблему усугубляет широко распространенная практика профилактического назначения антибиотиков пациентам в ОРИТ, находящимся на ИВЛ, что способствует селекции антибиотикорезистентных штаммов микроорганизмов к большинству антибиотиков, в т.ч. резервных.
За последние годы наибольшую тревогу вызывает появление и распространение в ОРИТ многих стационаров энтеробактерий (прежде всего Klebsiella spp., E.coli) и ацинетобактерий, продуцирующих карбапенемазы и устойчивых к карбапенемовым антибиотикам. Сложности лечения таких инфекций объясняются следующим: эти микроорганизмы наряду с карбапенемами характеризуются устойчивостью практически ко всем другим АБП, т.е. панрезистентные.
Ситуация с антибиотикорезистентностью в ОРИТ может изменяться достаточно быстро, что требует постоянного мониторинга микрофлоры в ОРИТ и ее чувствительности для быстрого принятия решения о модификации режимов эмпирической антибактериальной терапии.
Целью настоящего многоцентрового исследования было изучить динамику этиологической структуры инфекций нижних дыхательных путей в ОРИТ и антибиотикорезистентность клинически значимых возбудителей НП и НПивл с 2006 по 2012 г. для выработки адекватных рекомендаций эмпирического назначения антибиотиков.
Материал и методы
Дизайн исследования: многоцентровое, ретроспективное, микробиологическое.
Проанализирована чувствительность к антибиотикам всех выделенных из нижних дыхательных путей изолятов в 18 ОРИТ общего профиля из 12 городов России в 2006 г. и 2012 г. (Барнаул, Владивосток, Волгоград, Екатеринбург, Казань, Краснодар, Москва, Сургут, Тольятти, Ульяновск, Якутск, Ярославль). В исследование не включали специализированные ОРИТ (неонатологические, гематологические, кардиологические, онкологические) из-за особенностей этиологической структуры возбудителей в этих отделениях.
В анализ включены только клинически значимые возбудители инфекций нижних дыхательных путей, полученные инвазивными или полуинвазивными методами (бронхоальвеолярный лаваж, аспират трахеи). Во всех центрах для идентификации микробов и определения чувствительности использованы автоматизированные системы и диско-диффузионный метод. Интерпретация чувствительности в оба периода проведена в соответствии с критериями CLSI (США) и МУК 2004 г. (РФ).
Результаты и обсуждение
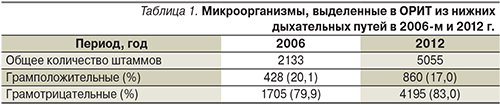
Всего во всех клинических центрах из нижних дыхательных путей в 2006-м и 2012 г. было выделено 2133 и 5055 клинически значимых штаммов микроорганизмов, причем в оба периода доминировали грамотрицательные микроорганизмы (около 80%). Соотношение грамположительных и грамотрицательных микроорганизмов в сравниваемые периоды существенно не изменилось (табл. 1).
Среди грамположительных микроорганизмов доминировал золотистый стафилококк, хотя его доля в этиологической структуре пневмонии с 2006 по 2012 г. немного уменьшилась – с 18,4 до 14,5% (табл. 2).
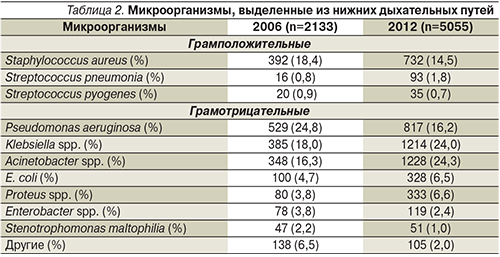
Среди грамотрицательных микроорганизмов доминировали три – клебсиелла, ацинетобактерии и синегнойная палочка, хотя их соотношение в сравниваемые периоды изменилось. Значение P. aeruginosa в этиологии НП за 6 лет существенно уменьшилось – с 25 до 16%, в то время как два других – Klebsiella spp. и Acinetobacter spp. – увеличили свою долю в этиологической структуре примерно на 35% каждый.
В настоящее время в этиологической структуре нозокомиальных инфекций нижних дыхательных путей в ОРИТ лидируют два возбудителя – Klebsiella spp. и Acinetobacter spp. (по 24%), далее идут P. aeruginosa и S. aureus (примерно по 15%), доля остальных микроорганизмов существенно меньше.
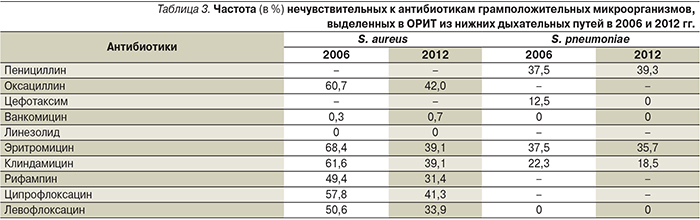
Заметная динамика отмечена в чувствительности возбудителей инфекций нижних дыхательных путей. Так, среди S. aureus достоверно увеличилась чувствительность ко многим антибиотикам, прежде всего к оксациллину: частота MRSA уменьшилась с 2006 по 2012 г. на 1/3, с 60,7 – до 42%. Также наблюдается увеличение частоты чувствительных штаммов к альтернативным антистафилококковым средствам – рифампину, клиндамицину, ципрофлоксацину и левофлоксацину (табл. 3). Традиционно продолжают регистрироваться лишь отдельные штаммы стафилококка со сниженной чувствительностью к ванкомицину (<1%), устойчивых к линезолиду штаммов не наблюдалось.
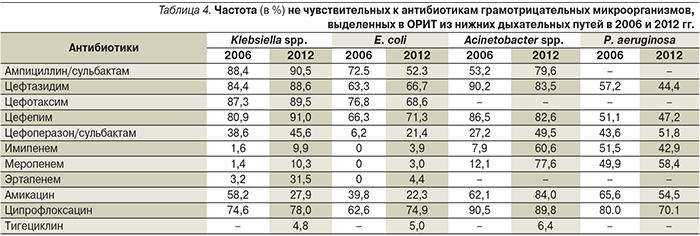
Наиболее драматические изменения в антибиотикорезистентности отмечены среди грамотрицательных бактерий. Отмечено снижение чувствительности ведущих возбудителей нозокомиальных инфекций нижних дыхательных путей практически ко всем АБП (табл. 4).
Среди энтеробактерий в ОРИТ РФ традиционно широко распространены штаммы с низкой чувствительностью к цефалоспоринам III–IV поколений за счет продукции различных β-лактамаз, прежде всего β-лактамаз расширенного спектра – процент нечувствительных штаммов Klebsiella spp. приближается к 100%, а E. coli и других Enterobacteriaceae стабильно превышает 50%. Также высокий уровень устойчивости энтеробактерий отмечен к ципрофлоксацину и ампициллин/сульбактаму. Неприятной тенденцией служит снижение чувствительности E. coli и Klebsiella spp. к цефоперазон/сульбактаму, который в течение последних лет рассматривался как надежная альтернатива карбапенемам при эмпирической терапии НП. Положительной тенденцией на этом фоне является улучшение чувствительности энтеробактерий к амикацину, однако этот антибиотик не служит надежным средством терапии НП и НПивл, по крайней мере в монотерапии.
Неферментирующие грамотрицательные микроорганизмы (Acinetobacter spp., P. aeruginosa) традиционно характеризуются низкой чувствительностью к цефалоспоринам III–IV поколений, фторхинолонам и аминогликозидам. Наряду с этим настораживает факт роста устойчивости ацинетобактерий к сульбактаму (входящему в состав комбинированных АБП), причем процент нечувствительных штаммов к ампициллин/сульбактаму и цефоперазон/сульбактаму в 2012 г. достиг 80 и 50% соответственно, что делает сомнительным эффективное применение этих антибиотиков.
Наиболее тревожным фактом, отмеченным в данном исследовании, является распространение среди возбудителей НП грамотрицательных микроорганизмов, устойчивых к карбапенемам. Если среди P. aeruginosa устойчивость к карбапенемам получила распространение достаточно давно, то появление устойчивости к карбапенемам среди энтеро- и ацинетобактерий – относительно новое явление. Среди Klebsiella spp. и E. coli доля устойчивых к карбапенемам штаммов за 6 лет увеличилась с 1–2 до 10% и с 0 до 3–4% соответственно. Еще больший прирост устойчивости отмечен к эртапенему, особенно среди Klebsiella spp. еще более драматично увеличилась устойчивость ацинетобактерий к карбапенемам: за 6 лет доля не чувствительных к имипенему и меропенему штаммов Acinetobacter spp. увеличилась в 6–7 раз и в 2012 г. составила 61 и 78% соответственно.
Устойчивость энтеробактерий к карбапенемам опосредуется различными механизмами, наибольшее клиническое значение имеют различные β-лактамазы (карбапенемазы), относящиеся к классам А, В и D. Среди Klebsiella spp. в ОРИТ стационаров РФ наибольшее распространение получили карбапенемазы класса D (OXA–48), однако стали регистрироваться и другие карбапенемазы – KPC-2 и металло-βлактамазы: NDM-1 и VIM-4 [6]. Среди Acinetobacter spp. широко распространены карбапенемазы класса D (OXA).
Наименьшая устойчивость Klebsiella spp., E. coli и Acinetobacter spp. в 2012 г. отмечена к тигециклину – соответственно 4,8, 5,0 и 6,4%.
Отмеченные тенденции в распространении антибиотикорезистентности среди основных возбудителей НП и НПивл требуют пересмотра рекомендаций по эмпирической антибактериальной терапии этих инфекций. Относительно недавние рекомендации по возможности лечения НП и НПивл цефалоспоринами III–IV поколений и фторхинолонами [1] должны быть критически пересмотрены из-за практически полной нечувствительности основных возбудителей НП к этим антибиотикам.
В результате снижения роли MRSA в этиологической структуре НП и НПивл (не выше 7%), назначение анти-MRSA антибиотика (линезолид или ванкомицин) в эмпирическом деэскалационном режиме антибактериальной терапии больше не строго обязательно, что позволяет в большей степени сосредоточиться на преодолении полирезистентных грамотрицательных возбудителей. Это может быть достигнуто за счет более активного использования на стартовом этапе терапии комбинированных режимов антибактериальной терапии и оптимизации режима дозирования АБП.
Прежде всего следует отметить, что карбапенемы уже не такие же надежные средства эмпирической терапии НП, какими они были еще 5–10 лет назад, в результате увеличивающего распространения устойчивости к ним среди практически всех грамотрицательных бактерий. Реальной альтернативой карбапенемам в эмпирической терапии мог бы стать тигециклин, однако имеется существенный лимитирующий факт в использовании этого антибиотика – НП и НПивл не являются разрешенным показанием к назначению тигециклина, согласно утвержденной инструкции по медицинскому применению. Поэтому любое назначение тигециклина при НП будет трактоваться как «off–label». В то же время применения тигециклина при НП и НПивл не избежать, по крайней мере в комбинации с другими антибиотиками или в повышенной дозе (200 мг/сут), учитывая современную ситуацию с антибиотикорезистентностью возбудителей к большинству АБП (табл. 4), тем более в случае выделения микроорганизмов, устойчивых ко всем другим антибиотикам [7–8]. Поскольку большинство карбапенемаз-продуцирующих энтеробактерий в РФ сохраняют чувствительность к тигециклину [6], этот очень важный вопрос требует решения не только на медицинском, но и на административном уровне.
В случаях устойчивости энтеробактерий к карбапенемам за счет продукции наиболее распространенных в ЛПУ РФ карбапенемаз класса D (OXA–48), уровень устойчивости может быть не очень высоким (МПК в пределах 2–16 мкг/мл), что позволяет ожидать клинический эффект при применении карбапенемов в максимальных дозах (меропенем 6 г/сут, имипенем 4 г/сут), причем каждая доза должна вводиться продленной в виде 3-часовой инфузии, что повышает вероятность достижения фармакодинамической цели и киллинга даже слабочувствительных бактерий. Кроме того, карбапенемазы классов А и D обычно чувствительны к ингибиторам β-лактамаз, поэтому комбинированное назначение карбапенема с ингибитором (цефоперазон/сульбактам, ампициллин/сульбактам) выглядит перспективным.
В случае продукции энтеро- или ацинетобактериями металло-β-лактамаз (NDM-1 и др.) наблюдается более высокий уровень устойчивости к карбапенемам (МПК>16 мкг/мл), что делает маловероятным эффект при назначении карбапенемов, в т.ч. с ингибиторами β-лактамаз, т.к. металлоэнзимы не чувствительны к последним. В этих ситуациях обсуждаются различные варианты комбинаций антибиотиков (тигециклин, полимиксин В, полимиксин Е, фосфомицин, аминогликозид и др.), однако надежные режимы антибактериальной терапии пока не определены [9–10]. В нашем исследовании не изучена чувствительность к полимиксинам. Литературные данные свидетельствуют о низком уровне устойчивости к полимиксинам грамотрицательных бактерий, в т.ч. устойчивых к карбапенемам, однако клиническая эффективность полимиксинов при НПивл в монотерапии (в рекомендуемых дозах) невысокая (<50%), в т.ч. при ингаляционном применении колистина [11–12].
Заключение
Проведенное многоцентровое исследование в ОРИТ показало значительный рост частоты выделения из нижних дыхательных путей полирезистентных возбудителей НП и НПивл в 2012 г. по сравнению с 2006 г. Наибольшую проблему для эффективной антибиотикотерапии нозокомиальных инфекций нижних дыхательных путей представляют широко распространенные в ОРИТ энтеро- и ацинетобактерии, устойчивые к карбапенемам. Эти данные требуют пересмотра рекомендаций по эмпирической терапии НП и НПивл с более широким использованием уже в 1-й линии терапии комбинированных режимов антибиотикотерапии на основе тигециклина, полимиксинов, карбапенемов и ингибиторов β-лактамаз.



