Введение
Внебольничная пневмония (ВП) в настоящее время определяется как острое инфекционное заболевание, преимущественно бактериальной этиологии, возникшее во внебольничных условиях и сопровождающееся симптомами инфекции нижних отделов дыхательных путей (лихорадка, кашель, продукция мокроты, боль в грудной клетке, одышка), а также рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких [1].
Внебольничная пневмония является распространенным заболеванием у взрослых. Согласно отчетам Минздрава, заболеваемость пневмонией в Российской Федерации в 2010 г. составила 414,3 на 100 тыс. взрослого населения. При этом за последние годы отмечена тенденция к росту данного показателя [2]. Внебольничная пневмония занимает одно из ведущих мест в структуре смертности от инфекционных болезней [3]. Летальность при ВП зависит от тяжести течения и характера изучаемой популяции. Так, у амбулаторных пациентов этот показатель не превышает 1–5 %, а при госпитализации в стационар составляет 8–10 %. Следует отметить, что наибольшую проблему представляет тяжелая ВП, летальность при которой может достигать 40–50 % [1, 3, 4].
Внебольничная пневмония остается не только актуальной медицинской, но и социально-экономической проблемой для развитых стран. Ежегодные затраты на ВП в странах Европы составляют около 10 млрд евро [5]. Прямые затраты на ВП в США, по расчетным данным экспертов, превышают 17 млрд долл. в год [6]. По данным проспективного клинико-экономического исследования, выполненного в РФ в 2006–2007 гг., медиана прямых затрат на лечение одного госпитализированного пациента с ВП составила 10 610 руб., а у лиц с тяжелым течением заболевания, наличием осложнений и неблагоприятных факторов риска достигала 54 751 руб. [7].
В связи с этим быстрая и точная диагностика заболевания, определение тяжести течения, своевременное начало и адекватный выбор антимикробных препаратов (АМП) для пациентов с ВП являются важным предиктором благоприятного прогноза и сокращения затрат на медицинскую помощь данной категории больных. При этом знание спектра ключевых возбудителей и их чувствительности к АМП лежит в основе рациональной эмпирической антимикробной терапии ВП.
Этиология
Наиболее частым бактериальным возбудителем ВП остается Streptococcus pneumoniae, на долю которого приходится до 30–50 % случаев заболевания известной этиологии. Два других микроорганизма – Mycoplasma pneumoniae и Chlamydophila pneumoniae – чаще встречаются при нетяжелом течении заболевания (до 20–30 % в структуре возбудителей). Нетипируемая Haemophilus influenzae чаще вызывает ВП у курильщиков и пациентов с хронической обструктивной болезнью легких (ХОБЛ) [1].
Klebsiella pneumoniae и Escherichia coli (реже другие представители семейства Enterobacteriaceae), как правило, встречаются среди пациентов с факторами риска (сахарный диабет, хроническая сердечная недостаточность, алкоголизм и др.). Вероятность стафилококковой пневмонии возрастает у людей пожилого возраста и после перенесенного гриппа, а инфицирование Pseudomonas aeruginosa – лиц с муковисцидозом, бронхоэктазами, при применении системных глюкокортикостероидов, цитостатиков, предшествующей длительной АМТ. Legionella pneumophila – редкий возбудитель внебольничной пневмонии, однако легионеллезная пневмония чаще требует госпитализации и характеризуется сравнительно высокой летальностью [1, 8].
Определенную роль в этиологии ВП могут играть респираторные вирусы (гриппа, коронавирусы, респираторно-синцитиальный, метапневмовирус человека, бокавирус и др.), которые, по данным ряда исследований, выявляются у 30 % пациентов с подтвержденной ВП [9, 10]. Следует отметить, что в большинстве случаев инфекции, вызываемые группой респираторных вирусов, характеризуются нетяжелым течением, однако у лиц пожилого и старческого возраста при наличии сопутствующих бронхолегочных заболеваний или вторичного иммунодефицита они могут ассоциироваться с развитием тяжелых, нередко угрожающих жизни осложнений.
Важно подчеркнуть, что нередко у взрослых пациентов, переносящих ВП, выявляется смешанная или ко-инфекция, которая может быть вызвана как ассоциацией различных бактериальных возбудителей (например, S. pneumoniae с H. influenzae или M. pneumoniae), так и их сочетанием с респираторными вирусами [1].
Этиологическая структура ВП может различаться в зависимости от возраста больных, тяжести заболевания, наличия сопутствующей патологии. У пациентов с нетяжелым течением заболевания в структуре возбудителей преобладают пневмококки, M. pneumoniae и Ch. pneumoniae, часто выявляются респираторные вирусы. В этиологии тяжелой ВП, требующей лечения в отделении реанимации и интенсивной терапии, возрастает роль L. pneumophila, Staphylococcus aureus и энтеробактерий [1].
Клинический диагноз и методы диагностики ВП
Согласно клиническим рекомендациям Российского респираторного общества и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) 2010 г., диагноз пневмонии устанавливается при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и не менее двух клинических признаков из нижеприведенных [1]:
- острое начало заболевания с повышением температуры тела выше 38 °С;
- кашель с выделением мокроты;
- объективные признаки (фокус крепитации и/или мелкопузырчатые хрипы, бронхиальное дыхание, укорочение перкуторного звука);
- лейкоцитоз (более 10 × 109/л) и/или палочкоядерный сдвиг (более 10 %).
Диагностический минимум обследования пациентов с ВП во многом определяется степенью тяжести заболевания и местом лечения. Так, у амбулаторных пациентов помимо рентгенографии органов грудной клетки он включает проведение общего анализа крови. Госпитализированным пациентам с нетяжелой ВП целесообразно также выполнение биохимического анализа крови (определение уровня креатинина, мочевины, глюкозы, электролитов, печеночных трансаминаз) [1].
В качестве дополнительных методов исследования можно рекомендовать пульсоксиметрию (SрО2 < 90 % является критерием тяжелой ВП и показанием к проведению оксигенотерапии) и электрокардиографическое исследование. При тяжелой ВП целесообразно исследовать газы артериальной крови (PаO2, PаCO2) для уточнения потребности в проведении искусственной вентиляции легких [1].

Рентгенологическое исследование органов грудной клетки остается «золотым» стандартом диагностики ВП. Данный метод позволяет не только подтверждать диагноз, но и оценивать распространенность инфильтрации, наличие плеврального выпота, полостей деструкции.
Следует отметить, что от больных при обезвоживании, нейтропении, пневмоцистной пневмонии и на ранних стадиях заболевания во время рентгенологического исследования органов грудной клетки можно получить ложноотрицательный результат. В подобных случаях показано проведение компьютерной томографии органов грудной клетки, а также исследование биомаркеров воспаления, в частности определение уровня С-реактивного белка и прокальцитонина. Показано, что наиболее высокая концентрация С-реактивного белка отмечается у пациентов с тяжелой пневмококковой или легионеллезной пневмонией, а уровень прокальцитонина коррелирует с тяжестью состояния пациентов с ВП, может быть предиктором развития осложнений и неблагоприятного исхода [11].
С момента установления клинико-рентгенологического диагноза ВП следует сосредоточить усилия на этиологической диагностике заболевания.
С этой целью для культурального исследования проводится получение клинического материала: свободно отделяемой или индуцированной мокроты, реже инвазивных респираторных образцов (трахеальный аспират, бронхоальвеолярная жидкость, материал, полученный при бронхоскопии, защищенной браш-биопсии), мазков/смывов из носоглотки и задней стенки глотки, плевральной жидкости, венозной крови, мочи [12].
При ВП целесообразность выполнения микробиологических исследований определяется тяжестью течения заболевания и местом лечения. Рутинная микробиологическая диагностика в амбулаторной практике не показана, т.к. она недостаточно информативна и не оказывает существенного влияния на выбор АМП. Всем госпитализированным пациентам с ВП, согласно современным клиническим рекомендациям, целесообразно выполнять бактериологическое исследование мокроты для выделения возбудителя и определения его чувствительности к АМП. Пригодным к проведению анализа считается образец мокроты, собранный до начала антибиотикотерапии, полученный при глубоком откашливании и удовлетворяющий следующим критериям: менее 10 эпителиальных клеток и более 25 нейтрофилов в поле зрения при малом увеличении [12].
Пациентам с тяжелой ВП следует до начала антибактериальной терапии (АБТ) получить кровь для культурального исследования (производится взятие двух образцов венозной крови из разных вен).
В качестве экспресс-методов для этиологической диагностики ВП используются методы выявления антигенов микроорганизмов в моче.
В настоящее время доступны тесты для обнаружения антигенов S. pneumoniae и L. pneumophila серогруппы 1, ответственной за 80–95 % случаев внебольничной легионеллезной инфекции. Пневмококковый экспресс-тест рекомендуется использовать в отсутствие возможности получения качественного образца мокроты у пациентов, получающих системные АМП [12]. Показанием к проведению легионеллезного экспресс-теста могут служить тяжелое течение заболевания, недавнее путешествие, наличие диареи, неврологической симптоматики, нарушения функции печени, неэффективность стартовой АБТ β-лактамными антибиотиками при условии их адекватного выбора.
Следует обратить внимание на такой факт: легионеллезный и пневмококковый экспресс-тесты остаются положительными в течение нескольких недель после перенесенного эпизода ВП, поэтому они имеют диагностическую ценность только при наличии клинических проявлений заболевания.
Полимеразная цепная реакция в реальном времени остается наиболее перспективным методом выявления таких бактериальных возбудителей ВП, как C. pneumoniae, M. pneumoniae и L. pneumophila, а также ряда респираторных вирусов (гриппа, парагриппа, респираторно-синцитиального вируса и др.). Для диагностики предпочтительно исследовать клинический материал из нижних дыхательных путей (мокрота, бронхоальвеолярная жидкость, аспират из трахеи), а в отсутствие возможности их получения – объединенный мазок из носоглотки и задней стенки глотки [12, 13].
Оценка степени тяжести ВП
Оценка степени тяжести и прогноза пневмонии, выбор места лечения (на дому, в стационаре, в отделении интенсивной терапии и реанимации) – основные вопросы, стоящие перед врачом, ведущим больного ВП. Разделение больных ВП на тех, кого возможно лечить в амбулаторно-поликлинических условиях, и тех, которые требуют госпитализации, принципиально важно, т.к. место лечения во многом определяет объем диагностических исследований и тактику лечения [1]. Известен ряд клинико-лабораторных шкал, на основании оценки прогноза заболевания дающих рекомендации по выбору места лечения. Наибольшее распространение в мире получили шкалы PORT, CURB/CRB-65, SMART-COP/SMRT-CO, CAP-PIRO, критерии тяжести IDSA/ATS. Однако их практическая ценность для российской популяции пациентов с ВП еще недостаточно изучена.
Согласно клиническим рекомендациям Российского респираторного общества и МАКМАХ, госпитализация при подтвержденном диагнозе ВП показана при наличии как минимум одного из следующих признаков, соответствующих критериям тяжелого течения ВП [1]:
1. Данные физического обследования:
- частота дыхания > 30/мин;
- систолическое артериальное давление < 90 мм рт. ст.;
- диастолическое артериальное давление < 60 мм рт. ст.;
- частота сердечных сокращений ≥ 125/мин;
- температура < 35,5 °С или ≥ 39,9 °С;
- нарушение сознания;
- внелегочные очаги инфекции (менингит, перикардит и др.);
- анурия.
2. Лабораторные и инструментальные исследования:
- количество лейкоцитов периферической крови < 4,0 × 109/л или > 20,0 × 109/л ;
- гематокрит < 30 %;
- гемоглобин < 100 г/л;
- острая почечная недостаточность (креатинин сыворотки крови > 176,7 мкмоль/л или азот мочеви-ны > 7,0 ммоль/л);
- SрO2 < 92 % (по данным пульсоксиметрии), РаО2 < 60 мм рт. ст. и/или РаСО2 > 50 мм рт. ст. при дыхании комнатным воздухом;
- двух- и многодолевое поражение легких, наличие полости (полостей) распада; плевральный выпот, быстрое прогрессирование очагово-инфильтративных изменений в легких (увеличение размеров инфильтрации > 50 % в течение ближайших двух суток);
- полиорганная недостаточность, проявляющаяся метаболическим ацидозом (рН < 7,35) или коагулопатией.
Кроме того, пожилой возраст пациента, наличие серьезных хронических сопутствующих заболеваний, неэффективность стартовой антибактериальной терапии, беременность, а также невозможность адекватного ухода и выполнения всех врачебных назначений в домашних условиях представляются дополнительными факторами, определяющими предпочтительность госпитализации пациента и лечение в стационарных условиях.
Антибактериальная терапия ВП
Антибактериальная терапия пациентов с подтвержденным диагнозом ВП должна назначаться эмпирически и в как можно более короткие сроки, в случае тяжелой пневмонии и сепсиса задержка с введением первой дозы АМП не должна превышать 1 часа.
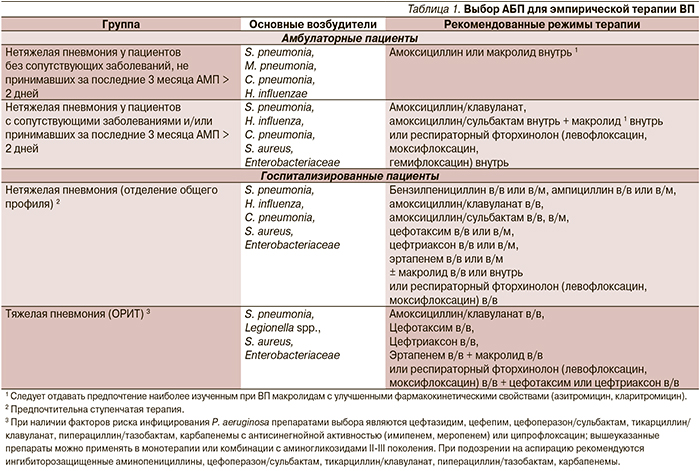
К выбору АБТ следует подходить дифференцированно с учетом тяжести состояния, наличия сопутствующих заболеваний, места лечения (амбулаторно, в общей палате стационара, в отделении реанимации и интенсивной терапии), предшествующей АМТ [1]. Стратификация пациентов и рекомендации по выбору препаратов представлены в табл. 1.
Среди пациентов с ВП, которые могут получать лечение в амбулаторных условиях, выделяют две группы, различающиеся между собой по этиологической структуре и тактике АБТ. В первую группу включены пациенты с нетяжелой ВП без сопутствующей патологии, не принимавшие за последние три месяца системных АМП длительностью два дня и более. В качестве препаратов выбора этой группе рекомендуются амоксициллин или макролидные антибиотики.

Во вторую группу включены больные ВП с сопутствующими заболеваниями (ХОБЛ, сахарный диабет, хроническая сердечная недостаточность, хроническая почечная недостаточность, цирроз печени, алкоголизм, наркомания, истощение) и/или принимавшие за последние три месяца АМП ≥ 2 дней. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в т.ч. обладающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора им рекомендуется амоксициллин/клавуланат. Пациентам данной категории возможно назначение комбинации β-лактама и макролида в связи с возможной «атипичной» этиологией ВП, однако на сегодняшний день не доказано, что такая стратегия улучшает исходы лечения. Альтернативой комбинированной терапии β-лактамами и макролидами может быть применение респираторного фторхинолона [14].
От амбулаторных пациентов с ВП адекватный клинический эффект может быть получен при назначении пероральных АБП, поэтому назначение парентеральной антибактериальной терапии нецелесообразно. Парентеральные АМП могут применяться лишь в случаях предполагаемой низкой комплаентности при приеме пероральных препаратов, отказе или невозможности своевременной госпитализации, несмотря на наличие показаний.
Для госпитализированных пациентов принципиально важно деление пневмонии на нетяжелую и тяжелую. При нетяжелой ВП в качестве стартовой эмпирической терапии рекомендуется парентеральное применение бензилпенициллина, ампициллина, ингибиторозащищенных аминопенициллинов, цефалоспоринов III поколения либо эртапенема.
По данным ряда исследований, наличие в стартовом режиме терапии препарата, активного в отношении «атипичных» микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациентов в стационаре. Это обстоятельство делает оправданным применение комбинированной терапии: β-лактам + макролид. Альтернативой им могут служить респираторные фторхинолоны, используемые в монотерапии табл. 1.
Пациенты с тяжелым течением заболевания должны быть госпитализированы в отделение реанимации и интенсивной терапии. Препаратами выбора являются внутривенные цефалоспорины III поколения или ингибиторозащищенные пенициллины (амоксициллин/клавуланат) в комбинации с макролидами для внутривенного введения (эритромицин, кларитромицин, спирамицин, азитромицин). Следует обратить внимание на следующее: среди пациентов с тяжелой ВП выделяют группы с факторами риска инфицирования P. aeruginosa и аспирацией. В данном случае должны назначаться отличные от стандартных режимы АБТ (табл. 1).
У пациентов с нетяжелой ВП, госпитализированных в отделение общего профиля, оптимальным вариантом является ступенчатая терапия, которая предполагает назначение парентеральных антибиотиков с последующим переходом на пероральный путь введения тех же или близких по спектру активности препаратов. Переход осуществляется при стабилизации состояния пациента и улучшении клинической картины заболевания (это оказывается возможным в среднем через три дня от начала лечения). При тяжелом течении ВП лечение должно начинаться с в/в введения АМП.
Первоначальная оценка эффективности антибактериальной терапии при ВП должна проводиться через 48–72 часа после начала лечения. Основной критерий эффективности в эти сроки: снижение температуры тела, выраженности интоксикации и симптомов ВП, в первую очередь дыхательной недостаточности. Если у пациента сохраняются высокая лихорадка и интоксикация или прогрессируют симптомы заболевания, лечение следует рассматривать как неэффективное. В этом случае необходимо пересмотреть тактику АБТ. Рекомендации по смене АМП у амбулаторных и госпитализированных больных приведены в табл. 2 и 3 [1].
Оптимальная продолжительность применения АБТ при ВП до настоящего времени окончательно не определена. При нетяжелой ВП АБТ может быть завершена по достижении стойкой нормализации температуры тела в течение 48–72 часов (при положительной динамике со стороны других симптомов заболевания и отсутствии признаков клинической нестабильности) [1, 11]. Длительность лечения при таком подходе обычно не превышает 7 дней. Следует отметить, что короткие курсы АБТ могут быть недостаточно эффективными для лиц пожилого возраста с хроническими сопутствующими заболеваниями, при медленном клиническом «ответе» на лечение и инфицировании такими микроорганизмами, как S. aureus и P. aeruginosa. Поэтому в данном случае продолжительность АБТ определяется индивидуально и, если необходимо, может быть увеличена до 14 дней.
Сохранение отдельных клинических, лабораторных или рентгенологических признаков ВП не служит абсолютным показанием к продолжению АБТ или ее модификации.
В подавляющем большинстве случаев их разрешение происходит самостоятельно. Рентгенологические признаки пневмонии разрешаются медленнее клинических симптомов, поэтому контрольная рентгенография не может служить критерием отмены антибиотиков, а сохраняющаяся инфильтрация – показанием к продолжению АБТ пациентов с положительной клинической динамикой. Однако в случае длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматики ВП необходимо проводить дифференциальную диагностику с другими заболеваниями, прежде всего с раком легкого и туберкулезом [1].
Следование современным рекомендациям позволяет снижать частоту госпитализаций пациентов с низким риском неблагоприятного исхода заболевания, уменьшать продолжительность госпитального этапа лечения взрослых пациентов ВП, повышать эффективность терапии и улучшать прогноз.
Профилактика
С целью профилактики ВП в настоящее время используются пневмококковая и гриппозная вакцины. Целесообразность применения пневмококковой вакцины объясняется тем, что S. pneumoniae остается ведущим возбудителем ВП у взрослых и, несмотря на эффективную АБТ, обусловливает высокую заболеваемость и летальность. С этой целью применяют вакцину, содержащую очищенные полисахариды 23 серотипов S. pneumoniae. Вакцинацию рекомендуется проводить пациентам, имеющим повышенный риск развития инвазивных пневмококковых инфекций, включая лиц пожилого возраста, проживающих в учреждениях длительного ухода (дома престарелых, инвалидов), с частыми госпитализациями (в т.ч. по поводу ХОБЛ, астмы, сахарного диабета, сердечной недостаточности). К группе риска также относятся пациенты с алкогольной и никотиновой зависимостью, ослабленным иммунитетом (больные серповидно-клеточной анемией, нефротическим синдромом, а также пациенты, перенесшие спленэктомию). Использование вакцины позволяет значительно уменьшить число случаев пневмококковой пневмонии в группах риска [15].



