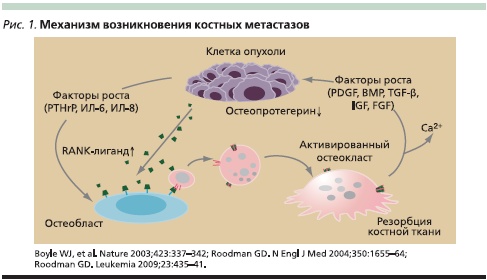
Кости являются одним из излюбленных мест метастазирования некоторых злокачественных опухолей, но частота поражения скелета и форма поражения (литические, бластические, смешанные метастазы) варьируются в зависимости от нозологического варианта опухоли. Наиболее часто метастазы в костях регистрируют при миеломной болезни (70–95 %), а среди солидных опухолей – при раке молочной (60–75 %), предстательной (60–75 %), щитовидной (60 %) желез, раке легкого (40 %) и мочевого пузыря (40 %) [1]. Костные метастазы являются следствием комплексных взаимодействий между раковыми клетками и микросредой кости. Выделяя такие ростовые факторы, как паратиреоид-ассоциированный белок (PTHrP), интерлейкин-6 (ИЛ-6), ИЛ-8, рецептор-активатор ядерного фактора kВ (RANK), опухолевые клетки активизируют деятельность остеобластов и остеокластов, в результате чего запускается процесс резорбции костной ткани. Резорбция костной ткани сопровождается выделением других ростовых факторов: тромбоцитарного ростового фактора (PDGF – platelet-derived growth factor), костного морфогенетического протеина (BMP – bone morphogenic proteins), трансформирующего фактора роста β (TGF-β – transforming growth factors), инсулиноподобного ростового фактора (IGF – insulin-like growth factor), фибробластного ростового фактора (FGF – fibroblast growth factor), что поддерживает стимуляцию опухолевых клеток, замыкая “порочный круг” (рис. 1). Наиболее часто поражаются плоские кости, выполняющие опорную функцию (позвоночник, кости таза, ребра). Это может приводить к развитию серьезных осложнений вплоть до полной инвалидизации пациентов. Так, патологические переломы при раке молочной железы (РМЖ) регистрируются в 52 % наблюдений [2], при миеломной болезни – в 37 % [3], раке предстательной железы – в 25 % [4], раке легкого – в 22 % [5]. В ряде случаев компрессионные переломы позвонков становятся причиной сдавления спинного мозга и развития серьезных неврологических нарушений (3–4 %).
В настоящее время для лечения костных метастазов применяют полидисциплинарный подход. Наиболее важным его компонентом является лечение основного заболевания, в первую очередь применение химиотерапии, зачастую с включением антрациклин-содержащих препаратов. При гормонально чувствительных опухолях используют гормональную терапию. С симптоматической и паллиативной целью применяют облучение и хирургические методы лечения. Однако выявление основных этапов развития костных метастазов послужило основанием для создания препаратов, обладающих способностью оказывать влияние как на костный обмен, нарушенный опухолевым процессом, так и на метаболизм опухоли (Beghe, Luzzani, 1993). Подобными свойствами обладают бисфосфонаты. Они представляют собой стабильные аналоги природных неорганических фосфатов и являются первыми специфическими средствами для лечения метастазов в костях, прочно вошедшими в клиническую практику.
Основным эффектом данной группы препаратов до последнего времени считались их способность уменьшать потерю костной ткани на фоне лечения рака и профилактика осложнений костных метастазов. Однако на протяжении последних лет дополнительно появились данные о способности бисфосфонатов оказывать противоопухолевое действие.
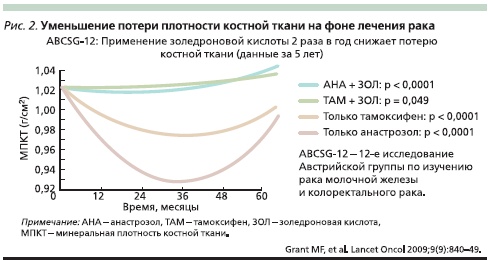
Уменьшение потери плотности костной ткани на фоне лечения рака бисфосфонатами
Иллюстрацией способности бисфосфонатов предотвращать потерю плотности костной ткани на фоне гормональной терапии может служить международное рандомизированное исследование ABCSG-12, которое проводилось с 1999 по 2006 г. и объединило более 1800 пациенток с ранними формами РМЖ (I–II стадий). Дополнительными критериями включения служили: пременопауза, экспрессия рецепторов стероидных гормонов, отсутствие адъювантной химиотерапии. На первом этапе всем больным выполнялась операция и при необходимости – лучевая терапия. После операции проводилось выключение функции яичников с помощью гозерелина по 3,6 мг ежемесячно. Далее пациентки рандомизировались в 4 группы, первая из которых получала тамоксифен по 20 мг/ сут, вторая – тамоксифен по 20 мг/сут в сочетании с золедроновой кислотой по 4 мг каждые 6 месяцев. Третья группа в качестве гормональной терапии дополнительно к гозерелину получала анастразол по 1 мг/сут, четвертая – сочетание анастразола в аналогичной дозе с золедроновой кислотой по 4 мг каждые 6 месяцев. Длительность лечения составила 3 года, период наблюдения за больными был равен 5 годам. К пяти годам наблюдения оказалось, что наибольшая потеря минеральной плотности костной ткани регистрировалась у больных, получавших анастразол. Меньшая потеря наблюдалась у больных, получавших гормональную терапию тамоксифеном. При добавлении к терапии золедроновой кислоты1 раз в полгода удавалось практически полностью избегать потери плотности кости независимо от вида гормональной терапии (рис. 2).
Профилактика осложнений костных метастазов
Применение бисфосфонатов позволяет увеличить время до возникновения костных осложнений метастатического поражения костей, снизить частоту этих осложнений, а также удлинить интервал до появления последующих осложнений. Этим свойством обладают все препараты данной группы, однако наиболее ярко оно проявляется у золедроновой кислоты за счет максимального антирезорбтивного потенциала. Примером эффективности золедроновой кислоты по сравнению с плацебо могут служить результаты нескольких международных рандомизированных исследований [4, 5]. Одно из исследований объединило более 600 больных гормонорезистентным раком предстательной железы с метастазами в костях, часть из которых получали золедроновую кислоту, а остальные – плацебо [4]. Группа больных, получавших золедроновую кислоту, имела достоверные преимущества как по частоте развития осложнений (33 против 44 %, p = 0,021), в т. ч. патологических переломов (13 против 22 %, p = 0,015), так и по времени их возникновения (488 дней против 321, р = 0,01).
Другим примером может служить рандомизированное исследование, проведенное Rosen L.S. и соавт., в которое входили больные немелкоклеточным раком легкого с наличием костных метастазов [5]. Всего были включены 382 больных, половина из которых получала золедроновую кислоту. Оказалось, что применение золедроновой кислоты позволило статистически достоверно увеличить время до развития первого костного осложнения (р = 0,028), а также снизить риск развития таких осложнений на 38 % (p < 0,001). Кроме того, была показана эффективность золедроновой кислоты в отношении профилактики осложнений костных метастазов при раке почки, раке мочевого пузыря, других солидных опухолей.
Данные этих и других исследований позволили рекомендовать бисфосфонаты в качестве обязательного компонента лечения костных метастазов у больных солидными опухолями.
Противоопухолевое действие бисфосфонатов
На протяжении последнего десятилетия накапливаются убедительные данные о том, что применение N-бисфосфонатов (азотсодержащих) улучшает результаты лечения метастатического опухолевого процесса. Предполагается, что существуют два вероятных механизма данного эффекта. Первый связан со способностью бисфосфонатов предотвращать или отодвигать время наступления осложнений костных метастазов. Второй связывают со способностью бисфосфонатов оказывать прямой и непрямой противоопухолевые эффекты. Так как возникновение метастазов в костях является сложным многоступенчатым процессом, угнетение данного процесса на любом из этапов может предотвращать их появление [6].
На этапе метастазирования происходит активный процесс образования новых сосудов. При применении бисфосфонатов наблюдается подавление неоангиогенеза (непрямое противоопухолевое действие). Примером могут служить результаты пилотного клинического исследования, в котором 30 пациентам с солидными опухолями и метастазами в костях однократно назначали 4 мг золедроновой кислоты. На первый, второй день, через неделю и через три недели оценивали уровень сывороточного фактора роста эндотелия сосудов (VEGF – vascular endothelial growth factor) и сравнивали его с исходным уровнем. Оказалось, что золедроновая кислота приводила к статистически значимому снижению уровня VEGF по сравнению с исходным уровнем в течение 2 дней после инфузии (-23 %; p < 0,05) и он оставался значительно ниже исходного уровня (на 34 %) на 21-й день (p = 0,0011) [7].
Непрямое противоопухолевое действие бисфосфонатов проявляется в их способности стимулировать пролиферацию Т-лимфоцитов и секрецию Т-лимфоцитами цитокинов (ИЛ-4, ИЛ-10, фактор некроза опухоли α – ФНО-α и интерферон γ – ИФН-γ). Активированные Т-лимфоциты γ/δ оказывают прямое цитотоксическое действие на клетки опухоли, ИЛ-4 и ИЛ-10 стимулируют гуморальный ответ со стороны В-лимфоцитов, а ФНО-α и ИФН-γ активируют антигенпрезентирующие клетки (дендритные клетки и макрофаги) и Т-хелперы [8].
Способность бисфосфонатов оказывать прямое противоопухолевое действие была продемонстрирована в значительном числе исследований как invitro, так и invivo. В доклинических исследованиях показана активность бисфосфонатов в отношении клеток миеломы, РМЖ, рака простаты, легких, поджелудочной железы и остеосаркомы [9]. В исследовании Senaratne S.G. и соавт. продемонстрирован дозозависимый эффект подавления жизнеспособности клеток РМЖ (MDA-MB-231) памидроновой и золедроновой кислотами, но у золедроната этот эффект наблюдался при меньших концентрациях. Клодроновая кислота также снижала жизнеспособность опухолевых клеток, однако только при относительно высоких концентрациях [10].
Клинической демонстрацией противоопухолевого действия бисфосфонатов могут служить результаты исследований AZURE и ABCSG-12. В международное рандомизированное исследование AZURE, объединившее 3360 больных, включили пациенток с РМЖ II и III стадий. Одна группа пациенток получала стандартную терапию в соответствии со стадией заболевания. Второй группе больных к стандартному варианту лечения в адъювантном режиме добавили золедроновую кислоту в стандартной дозе 4 мг. Длительность лечения и наблюдения за больными составила 5 лет. Среди включенных в исследование пациенток 205 получали неоадъювантную терапию (химиотерапия ± золедроновая кислота). Оказалось, что среди больных, получавших дополнительно к химиотерапии золедроновую кислоту, размер остаточной опухоли в молочной железе был меньше на 33 % по сравнению с пациентками, получавшими только химиотерапию (28,2 против 42,4 мм, р = 0,002). Более того, процент больных, у которых удалось достичь полного морфологического ответа, был практически в 2 раза выше на фоне химиотерапии в сочетании с золедроновой кислотой (10,9 против 5,8 %, р = 0,03) [11].
Возвращаясь к исследованию ABCSG-12, о котором говорилось выше, можно подчеркнуть, что его результаты оказались несколько неожиданными. Основной задачей исследования была сравнительная оценка результатов адъювантной гормональной терапии тамоксифеном и анастразолом у больных ранними формами РМЖ. Дополнительно предстояло оценить выживаемость без метастазов в костях с учетом того, что половина больных получали дополнительно к гормональной терапии золедроновую кислоту в дозе 4 мг 1 раз в полгода. Длительность лечения составила 3 года. Период наблюдения за пациентками составил 84 месяца (медиана – 60 месяцев), к концу которого не было зарегистрировано различий в безрецидивной и общей выживаемости в зависимости от вида гормональной терапии. При этом добавление к гормональной терапии золедроновой кислоты приводило к увеличению относительной выживаемости без прогрессирования на 36 % (p = 0,012) по сравнению с плацебо [12]. Кроме того, при анализе прогрессирования заболевания отмечено, что при добавлении золедроновой кислоты реже регистрировалось появление отдаленных метастазов не только в костях, но и в других органах, реже возникал рак другой железы, уменьшалось число местных рецидивов.
Выводы
- Бисфосфонаты, в частности золедроновая кислота, приводят к уменьшению потери минеральной плотности костной ткани на фоне лечения РМЖ.
- Бисфосфонаты снижают риск развития осложнений метастазов в костях, и их назначение увеличивает время до развития этих осложнений.
- Бисфосфонаты способны оказывать непрямое противоопухолевое действие за счет подавления процесса неоангиогенеза и стимуляции цитотоксической активности Т-лимфоцитов.
- Бисфосфонаты обладают прямой противоопухолевой активностью за счет подавления основных этапов патогенеза механизмов метастазирования (инвазии, адгезии и пролиферации опухолевых клеток).
- Полученные результаты позволяют предположить, что как можно более раннее включение бисфосфонатов в лечебные схемы поможет улучшить результаты лечения ряда солидных опухолей.
Информация об авторе:
Болотина Лариса Владимировна – кандидат медицинских наук, руководитель отделения химиотерапии. Московский научно-исследовательский онкологический институт им. П.А. Герцена. E-mail: lbolotina@yandex.ru



