Остеопороз (ОП) относится к наиболее серьезным медико-социальным проблемам современного общества, что обусловлено широкой распространенностью этого заболевания, его отрицательным влиянием на качество и продолжительность жизни людей, а также все более улучшающимися возможностями диагностики данной патологии [1–3].
Эпидемиологические исследования свидетельствуют, что частота ОП увеличивается с возрастом как у мужчин, так и у женщин [4, 5]. Важная особенность этого заболевания заключается в следующем: уменьшение массы и изменение микроархитектоники костной ткани (КТ) приводят к нарастающему снижению костной прочности, из-за которого со временем многим пациентам приходится испытывать осложнения ОП – переломы при минимальных травмах. Каждую минуту в Российской Федерации происходит 7 переломов позвонков, каждые 5 минут – перелом шейки бедра. Частота переломов предплечья в некоторых городах РФ превышает показатель 1200 на 100 тыс. населения [1]. Однако при своевременных медикаментозных вмешательствах остеопоротические переломы можно предотвратить. Раннее лечение ОП может затормозить процесс прогрессирования заболевания, уменьшить риск возникновения переломов и повысить качество жизни пациента в целом [6, 7].
С учетом этиологических, патогенетических особенностей различают первичный и вторичный ОП. Преобладает первичный ОП; это самостоятельное заболевание, которое развивается в любом возрасте, но чаще встречается среди женщин в постменопаузе [6, 8, 9]. За первые 5 лет после наступления менопаузы потеря костной массы у женщины может составить до трети от общей ее потери за всю жизнь; в постменопаузе ОП отмечается почти у 30 % женщин [2, 9]. На долю вторичных форм в общей структуре ОП приходится около 15–20 %; в большинстве случаев это проявление других заболеваний или следствие приема ряда лекарственных средств, отрицательно воздействующих на КТ [8, 10]. Между тем потенциальный риск переломов при вторичном ОП сопоставим с таковым при первичной форме заболевания.
К наиболее распространенным формам можно отнести вторичный ОП, развившийся у пациентов с эндокринными и ревматологическими заболеваниями [11, 12].
 Нарушение баланса между процессами костного ремоделирования, превалирование костной резорбции над процессом формирования новой кости являются ведущим механизмом развития ОП. В патогенезе постменопаузального ОП пусковым фактором остается дефицит эстрогенов, вызывающий ускорение потери костной массы [2, 9]. Хотя небольшая возрастная потеря костной массы начинается уже в репродуктивном периоде, наибольшей выраженности процесс достигает, как правило, спустя 5–10 лет после наступления менопаузы. При этом костные потери могут ежегодно составлять до 5 %. В результате масса КТ снижается примерно на 25–30 % и резко повышается риск атравматических переломов под влиянием даже минимальных нагрузок [2, 9]. Между тем все женщины в менопаузе имеют недостаточность эстрогенов, но ОП развивается только у каждой третьей из них. Это свидетельствует о влиянии различных, в т.ч. генетических, факторов на возникновение и развитие заболевания. К известным факторам риска развития ОП относятся пожилой возраст, низкая масса тела, злоупотребление алкоголем, кофеином, курение, семейный анамнез заболевания, указания на предшествующие малотравматичные переломы, низкий индекс массы тела (менее 20 кг/м2), ранняя менопауза (до 45 лет), аменорея (более года) в репродуктивном возрасте, овариэктомия в молодом возрасте, иммобилизация [2, 5, 13].
Нарушение баланса между процессами костного ремоделирования, превалирование костной резорбции над процессом формирования новой кости являются ведущим механизмом развития ОП. В патогенезе постменопаузального ОП пусковым фактором остается дефицит эстрогенов, вызывающий ускорение потери костной массы [2, 9]. Хотя небольшая возрастная потеря костной массы начинается уже в репродуктивном периоде, наибольшей выраженности процесс достигает, как правило, спустя 5–10 лет после наступления менопаузы. При этом костные потери могут ежегодно составлять до 5 %. В результате масса КТ снижается примерно на 25–30 % и резко повышается риск атравматических переломов под влиянием даже минимальных нагрузок [2, 9]. Между тем все женщины в менопаузе имеют недостаточность эстрогенов, но ОП развивается только у каждой третьей из них. Это свидетельствует о влиянии различных, в т.ч. генетических, факторов на возникновение и развитие заболевания. К известным факторам риска развития ОП относятся пожилой возраст, низкая масса тела, злоупотребление алкоголем, кофеином, курение, семейный анамнез заболевания, указания на предшествующие малотравматичные переломы, низкий индекс массы тела (менее 20 кг/м2), ранняя менопауза (до 45 лет), аменорея (более года) в репродуктивном возрасте, овариэктомия в молодом возрасте, иммобилизация [2, 5, 13].
На фоне дефицита эстрогенов наиболее выраженные изменения происходят в трабекулярной (губчатой) кости, в основном представленной в телах позвонков, плоских костях, в костях предплечья и пяточных костях [4, 10]. Так, например, масса трабекулярной кости позвонков снижается ежегодно на 5, а кортикального слоя – на 1,5 %. Переломы тел позвонков, как правило возникающие раньше остеопоротических переломов любой другой локализации, являются наиболее частым осложнением заболевания, составляя около половины всех переломов [3, 6]. ОП – это основная причина переломов шейки бедра, часто встречающихся у женщин старше 65 лет [14].
Поскольку стероидный ОП относится к наиболее тяжелым формам вторичного ОП, следует остановиться на механизмах его развития. Длительный избыток глюкокортикоидов любой природы (эндо- или экзогенный) способен приводить к развитию ОП и его осложнений [9, 15]. Эндогенный гиперкортицизм (болезнь, или синдром, Иценко–Кушинга) – достаточно редкая патология, самую частую проблему представляет ОП вследствие лечения фармакологическими дозами глюкокортикостероидов (ГКС; ятрогенный гиперкортицизм). Прочность КТ начинает снижаться уже на ранних этапах такой фармакотерапии, а остеопоротические переломы наблюдаются у 30–50 % пациентов [8, 16]. До сих пор остается не ясным: существует ли относительно безопасная доза ГКС? Наиболее высокий риск существует у пациентов, принимающих препараты этого класса в дозе 7,5 мг/сут и более (в эквиваленте к преднизолону) [11].
В наши дни существует эффективное лечение ОП, сочетающее нефармакологические подходы с современными антиостеопоротическими средствами. Медикаментозное лечение ОП достигается назначением лекарственных средств, влияющих на основные патогенетические механизмы этого нарушения. Суть лечения ОП сводится к нормализации процессов костного ремоделирования методом ингибирования костной резорбции, а также увеличению минеральной плотности КТ (МПКТ). Процесс стабилизации или увеличения МПКТ приводит к уменьшению вероятности возникновения переломов, снижению болевого синдрома, к повышению физической активности и качества жизни пациента в целом [6, 13].
 В настоящее время невозможно представить лечение больных ОП без использования бисфосфонатов (БФ). История использования их в медицине насчитывает не один десяток лет, а большая доказательная база позволила включить БФ в современные руководства как лекарственные средства первой линии для лечения различных форм ОП [13, 17]. Наибольший опыт применения этого класса препаратов накоплен при постменопаузальном ОП.
В настоящее время невозможно представить лечение больных ОП без использования бисфосфонатов (БФ). История использования их в медицине насчитывает не один десяток лет, а большая доказательная база позволила включить БФ в современные руководства как лекарственные средства первой линии для лечения различных форм ОП [13, 17]. Наибольший опыт применения этого класса препаратов накоплен при постменопаузальном ОП.
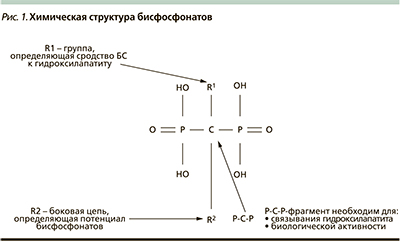
Целесообразность назначения БФ не подлежит сомнению, поскольку основной терапевтический эффект этих препаратов заключается в ингибировании костной резорбции [2]. Напомним, что БФ рассматриваются как средство первой линии в лечении постменопаузального, стероидного ОП, а также ОП у мужчин. Эти лекарственные средства представляют собой стабильные аналоги природных неорганических фосфатов, устойчивые в отличие от пирофосфата к ферментам желудочно-кишечного тракта. Химическую структуру БФ отличает замена атома кислорода в молекуле пирофосфата на атом углерода (Р-С-Р), а также наличие в боковых цепях двух радикалов: R1-ОН – группа, увеличивающая физико-химическое связывание БФ с гидроксиапатитом, и R2 – определяющая воздействие лекарственных средств на костные клетки [18] (рис 1). Селективное влияние БФ на КТ обусловлено высоким сродством препаратов к кристаллам костного гидроксиапатита и как следствие – их высокой способностью откладываться в зонах образования новой кости, где интенсивно протекают процессы ремоделирования [19].
В целом антиостеопоротический эффект БФ реализуется за счет снижения костного ремоделирования с более выраженным угнетением костной резорбции, чем костеобразования, а также снижения частоты активации ремоделирования [20–22]. Принципиально, что БФ уменьшают или предупреждают отрицательное влияние на кость практически всех известных стимуляторов резорбции. Детальное изучение эффектов этих лекарств показало, что, проникая в КТ, БФ концентрируются в лакунах резорбции вокруг остеокластов [18].
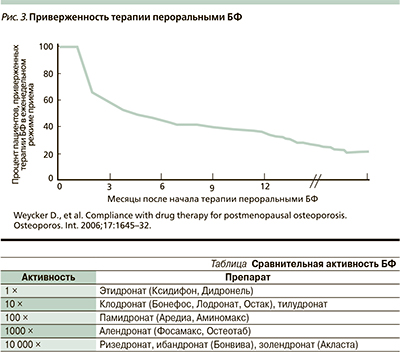
В настоящее время особое место среди БФ занимает золендроновая кислота (ЗК). В России ЗК зарегистрирована под названием «Акласта» в конце 2006 г. [17]. ЗК стала первым препаратом однократного ежегодного введения при ОП [24]. За исключением выраженного антирезорбтивного действия, воздействие ЗК на КТ сходно с таковым других БФ. Отдельного внимания заслуживает то обстоятельство, что антирезорбтивный потенциал золендроната в 10 тыс. раз превышает потенциал БФ первого поколения [7] (см. таблицу).
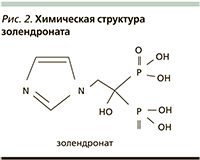
Молекула ЗК имеет в своей структуре два атома азота в пятичленном гетероцикле в позиции R2 [24] (рис. 2). Принято считать, что в ряду БФ азотсодержащие средства являются более сильными ингибиторами остеокластической активности и остеолизиса по сравнению с препаратами, не содержащими в своей структуре азот [25]. Напомним, что БФ первого поколения (этидронат, клодронат и тилудронат) не содержат в своей структуре атомов азота и метаболизируются внутриклеточно (в остеокластах) до цитотоксичных аналогов аденозинтрифосфата.
В свою очередь ЗК, как и другие азотсодержащие БФ, блокирует синтез фарнезилдифосфатсинтазы. Как следствие – снижается образование мевалоната, вещества, необходимого для поддержания жизнедеятельности остеокластов [18, 25]. Кроме того, структурные различия в азотсодержащей цепочке БФ влияют на их эффективность в отношении ингибирования костной резорбции. Присутствие атома азота в боковой цепи объясняет особый механизм действия азотсодержащих БФ, связанный со способностью ингибировать процесс модификации белков в остеокластах, что ведет к апоптозу зрелых клеток и подтверждается появлением специфических изменений в клетке и структуре ядра [19, 23, 25]. Одновременно отмечается потеря клетками-предшественниками остеокластов способности дифференцировки и созревания, что приводит к уменьшению их числа. Кроме того, данные in vitro свидетельствуют, что под влиянием БФ остеобласты снижают секрецию остеокласт-стимулирующего фактора [22].
ОП является хроническим заболеванием, лечение которого представляет длительный процесс, поэтому от приверженности пациента режиму лечения напрямую зависит и прогноз недуга [26]. Между тем будет ли пациент регулярно принимать препарат, зависит не только от его эффективности, переносимости, но и от удобства применения (рис. 3). Существенным обстоятельством, обеспечивающим приверженность пациентов к терапии золендронатом, является возможность применения препарата в дозе 5 мг методом однократной внутривенной инфузии 1 раз в год [21, 23].
 За время, прошедшее с момента появления золендроната в клинической практике, накоплена мощная доказательная база, свидетельствующая о высокой эффективности и благоприятном профиле безопасности этого препарата при применении в лечении различных форм ОП [6, 7, 27]. Так, подтверждение клинической значимости ЗК было получено в международном многоцентровом клиническом исследовании (КИ) HORІZON (The Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly), включившим 7736 пациенток в возрасте 65–89 лет из 240 клинических центров 27 стран мира [28]. КИ касалось снижения рисков возникновения переломов у женщин с постменопаузальным ОП, которые были рандомизированы в две группы. Основная группа (n = 3889) получала 5 мг ЗК (15-минутную капельную инфузию препарата), контрольная (n = 3876) – плацебо в начале КИ, через 12 и 24 месяца от нулевой точки отсчета. Ежедневно все участники исследования принимали препараты витамина D (400–1200 МЕ) и кальция (1000–1500 мг). Исследование длилось в течение 3 лет.
За время, прошедшее с момента появления золендроната в клинической практике, накоплена мощная доказательная база, свидетельствующая о высокой эффективности и благоприятном профиле безопасности этого препарата при применении в лечении различных форм ОП [6, 7, 27]. Так, подтверждение клинической значимости ЗК было получено в международном многоцентровом клиническом исследовании (КИ) HORІZON (The Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly), включившим 7736 пациенток в возрасте 65–89 лет из 240 клинических центров 27 стран мира [28]. КИ касалось снижения рисков возникновения переломов у женщин с постменопаузальным ОП, которые были рандомизированы в две группы. Основная группа (n = 3889) получала 5 мг ЗК (15-минутную капельную инфузию препарата), контрольная (n = 3876) – плацебо в начале КИ, через 12 и 24 месяца от нулевой точки отсчета. Ежедневно все участники исследования принимали препараты витамина D (400–1200 МЕ) и кальция (1000–1500 мг). Исследование длилось в течение 3 лет.
Результаты данного исследования показали, что за 3 года с момента начала КИ в группе пациенток, принимавших золендронат, по сравнению с группой плацебо на 70 % уменьшился риск компрессионных переломов позвонков (3,3 против 10,9 %, р < 0,05) и на 41 % снизилась вероятность переломов шейки бедра (1,4 против 2,5 %, p < 0,05). Вероятность клинически значимых переломов позвоночника и других костей, вневертебральных переломов снизилась на 77, 33 и 25 % соответственно (p < 0,001 для всех параметров). При терапии ЗК также наблюдалось значительное улучшение показателей костного метаболизма и МПКТ. Важно, что лечение золендронатом сопровождалось выраженным уменьшением болевого синдрома на 6-м месяце после однократного введения в дозе 5 мг. Частота побочных явлений в двух группах была сопоставимой, в т.ч. и со стороны мочевыводящей системы.
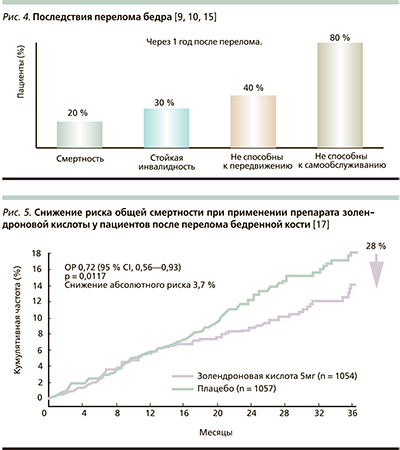
ОП – это основная причина переломов шейки бедра, особенно среди людей старшего возраста. Последствия переломов шейки бедра катастрофические (рис. 4): 20 % больных погибают в течение полугода, у половины выживших после перелома бедра снижается качество жизни, а треть нуждается в длительном уходе и теряет свою независимость [15, 29, 30]. К сожалению, лечение и реабилитация таких переломов, особенно у пожилых пациентов, имеют низкую эффективность. В связи с этим внимания заслуживает многоцентровое рандомизированное двойное слепое плацебо-контролируемое КИ в рамках HORIZON-RFT. В нем приняли участие 2127 пациентов (средний возраст – 74,5 года), ранее подвергшихся хирургическому лечению перелома шейки бедренной кости [31].
Целью данного исследования была оценка влияния применения ЗК (1 внутривенная 15-минутная инфузия в год в дозе 5 мг) на протяжении 3 лет для предотвращения развития новых переломов костей различных локализаций; анализировалось также влияние золендроната на летальность. Инфузию проводили через 90 дней после остеосинтеза. Первичной конечной точкой КИ был новый перелом. Подтверждением высокой клинической эффективности препарата для такой категории пациентов с ОП стало снижение риска развития новых патологических переломов бедра на 35 %. Кроме того, было зарегистрировано снижение на 28 % смертности по разным причинам по сравнению с группой плацебо (рис. 5). Лечение препаратом ЗК приводило к увеличению МПКТ в проксимальных отделах бедренной кости. ЗК также продемонстрировала хороший профиль безопасности – частота и характер побочных явлений достоверно не различались у больных, принимавших золендронат и плацебо.
Клинический опыт свидетельствует, что ЗК высокоэффективна при большинстве форм ОП. Как уже отмечалось выше, длительный избыток ГКС любой природы (эндо- или экзогенный) способен приводить к развитию ОП и его осложнений. В этом плане интерес представляет многоцентровое двойное слепое КИ, в котором золендронат или ризедронат назначались 833 мужчинам и женщинам, получавшим ≥ 7,5 мг преднизолона [32]. Участники КИ в зависимости от продолжительности применения ГКС (≤ 3 или > 3 месяцев) были стратифицированы в 2 группы: профилактики и лечения. Спустя год после лечения золендронатом отмечено достоверно большее повышение МПКТ поясничного отдела позвоночника по сравнению с ризедронатом (4,06 против 2,71 %, р = 0,0001); аналогичная ситуация касалась МПКТ бедра (1,45 против 0,39 %, р = 0.005). Подобные результаты были получены и в группе профилактики.
В целом у пациентов с ОП, вызванным применением ГКС, терапия препаратом ЗК значительно увеличивала МПКТ (поясничных позвонков, шейки бедра, вертела, лучевой кости), не оказывая отрицательного влияния на структуру и минерализацию КТ [33].
 Применение препарата ЗК эффективно для мужчин с первичным (сенильным) или вторичном (при гипогонадизме) ОП [28]. Так, в недавнем КИ S. Boonen и соавт. 1199 мужчин с первичным ОП на фоне низкой концентрации тестостерона были рандомизированы в группы лечения ЗК или плацебо; все участники дополнительно принимали кальций и витамин D [34]. Риск вертебральных переломов при применении ЗК в течение 2 лет, по данным рентгеноморфометрии, снижался на 67 % (1,6 против 4,9 %, p = 0,002). При этом общий уровень тестостерона не оказал влияния на эффективность ЗК в отношении снижения риска переломов.
Применение препарата ЗК эффективно для мужчин с первичным (сенильным) или вторичном (при гипогонадизме) ОП [28]. Так, в недавнем КИ S. Boonen и соавт. 1199 мужчин с первичным ОП на фоне низкой концентрации тестостерона были рандомизированы в группы лечения ЗК или плацебо; все участники дополнительно принимали кальций и витамин D [34]. Риск вертебральных переломов при применении ЗК в течение 2 лет, по данным рентгеноморфометрии, снижался на 67 % (1,6 против 4,9 %, p = 0,002). При этом общий уровень тестостерона не оказал влияния на эффективность ЗК в отношении снижения риска переломов.
Профиль безопасности пероральных форм БФ характеризуется побочными эффектами со стороны верхних отделов пищеварительного тракта [35]. Режим применения препарата ЗК способствует уменьшению числа побочных явлений. Препарат эффективен в отношении пациентов, получавших ранее лечение пероральными БФ [7].
Рекомендуемая доза ЗК составляет 5 мг (1 флакон – 100 мл раствора) внутривенно 1 раз в год. Перед введением препарата следует обеспечить адекватную гидратацию организма, что особенно важно для пациентов пожилого возраста, а также лиц, получающих терапию диуретиками. Нет необходимости в коррекции дозы для пациентов с клиренсом креатинина ≥ 35 мл/мин. Назначение ЗК пациентам с клиренсом креатинина < 35 мл/мин не рекомендуется из-за недостаточного клинического опыта применения препарата в этой популяции больных. Поскольку биодоступность, распределение и выведение этого препарата сходны для пожилых и более молодых больных, пациентам в возрасте 65 лет и старше не требуется коррекции дозы препарата.
Одним из условий эффективного лечения ОП золендронатом, как и любым другим БФ, при наличии у больного гипокальциемии служит обязательная коррекция этого явления до начала терапии. Дополнительно следует рекомендовать препараты кальция и витамин D.
К побочным эффектам, которые наиболее часто возникают при терапии ЗК, относятся гриппоподобные состояния с повышением температуры, появляющиеся в первые 3 дня после первого введения препарата больным, не получавшим ранее терапии БФ по поводу ОП. Назначение нестероидных противовоспалительных препаратов позволяет легко справиться с подобными явлениями. Также следует отметить развитие иногда таких побочных явлений, как головная боль, боли в костях и мышцах.
В заключение следует подчеркнуть, что многолетний опыт лечения препаратом ЗК в сочетании с высокой его эффективностью в отношении предупреждения переломов различной локализации, удобный режим применения все чаще останавливают наш выбор на этом БФ в качестве терапии ОП. Своевременное применение препарата ЗК в комплексной антиостеопоротической терапии вносит незаменимый вклад в успешное лечение различных форм ОП и способствует решению конечной цели лечения заболевания – снижению риска остеопоротических переломов.



